2006

Pauline Bonvin Décembre ‘07
Synthèse n°37
SYNTHÈSE DE LA DIAMINO-2,4-HYDROXY-6-PYRIMIDINE
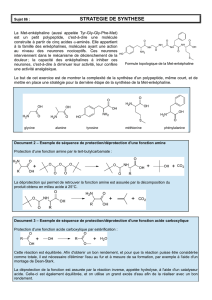
INTRODUCTION :
Le but de ce projet était de synthétiser de la diamino-2,4-hydroxy-6-
pyrimidine à partir de la guanidine (NH2C(NH)NH2)) et du cyanoacétate
d’éthyle (CNCH2COOCH2CH3). Cette réaction a eu lieu en milieu basique
protique ? EtO-Na+/EtOH.
Schéma de la réaction :
NH
2
NH
NH
2
+
N
O
OCH
3
N
N
NH
2
NH
2
OH
E t O
-
N a
+
/ E t O H
La diamino-2,4-hydroxy-6-pyrimidine est utilisée en tant que XY.
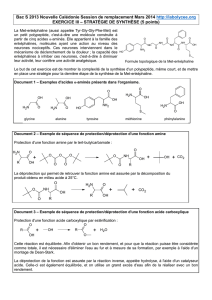
MÉCANISME RÉACTIONNEL :
Ce mécanisme réactionnel comporte plusieurs étapes.
1. Attaque nucléophile de l’oxygène de la fonction ester sur un hydrogène
du NH2 de la guanidine. Ceci aboutit à la formation d’un intermédiaire
tétraédrique.
2. Réaction intramoléculaire aboutissant à la régénération de la fonction
carbonyle et à la libération d’une molécule d’éthanol.
3. La base du milieu (EtO-) attaque l’hydrogène le plus acide, celui de la
fonction amine terminale. On obtient ainsi un azote chargé négativement,
très nucléophile.
4. Attaque intramoléculaire de l’azote nucléophile sur le carbone de la
fonction cyanure aboutissant à la formation d’un cycle azoté.
Reprotonation par l’éthanol du milieu.
5. Attaque de l’éthanolate (basique) sur l’hydrogène le plus acide présent,
celui situé sur le carbone en α du carbonyle. Reprotonation de la fonction
amine située sur le carbone en β du carbonyle.
6. Attaque de l’éthanolate sur le nouvel hydrogène le plus acide, celui
situé sur l’amine en para du carbonyle. Reprotonation de la fonction amine
située sur le carbone en α de l’amine.
- 1 -

Synthèse de la diamino-2,4-hydroxy-6-pyrimidine
Pauline Bonvin
TP 37
7. Attaque de l’éthanolate sur le nouvel hydrogène le plus acide, celui
situé sur l’amine en α du carbonyle. Protonation de l’oxoanion pour former
la fonction alcool.
NH
2
NH
N
H
H
N
O
OCH
3
+
H
NH
NH
2
NH
N
O
-
O
+
CH
3
NH
NH
2
NH
N
O
N
NH
-
NH
NH
O
NH N
H
NH
NH
O
H
H
NH N
H
NH
NH
2
O
NH
2
N
NH
NH
2
O
N
N NH
2
NH
2
OH
1 .
- E t O H
2 .
E t O
-
3 .
E t O H
4 .
E t O
-
/ E t O H
5 .
E t O
-
/ E t O H
6 .
E t O
-
/ E t O H
7 .
ANALYSE DES SPECTRES :
Le produit de la synthèse a été analysé par RMN. Cette dernière a permis
de mettre en évidence. Le solvant utilisé était le DMSO.
RMN
Les valeurs de déplacements chimiques obtenues sont rassemblées dans
le tableau ci-dessous. Elles sont comparées à celles données dans
Beilstein.
- 2 -

Synthèse de la diamino-2,4-hydroxy-6-pyrimidine
Pauline Bonvin
TP 37
Déplacements
chimiques
théoriques
[ppm] (1)
Déplacements
chimiques
expérimentaux
[ppm]
Multiplicit
é
Intégrale Protons
corresponda
nts
3.35 Singulet 3.10 H2O
4.40 Singulet 1.04 H
5.90 Singulet 2.09 NH2
6.10 Singulet 2.00 NH2
9.65 Singulet 1.00 OH
N
N
NH
2
NH
2
OH
H
RENDEMENT ET PURETÉ :
La masse de produit obtenu est de 3.43g ce qui correspond à 0.027 [mol].
Sachant que l’on obtient une mole de produit pour une mole de réactif, la
quantité maximale de diamino-2,4-hydroxy-6-pyrimidine attendue est 0.05
[mol]. Ceci équivaut à un rendement de 53.6%.
Si l’on excepte les traces d’eau relevées précédemment, l’analyse RMN
est exempte de toute trace d’impuretés. On peut donc en déduire que le
produit obtenu est très pur.
CONCLUSION :
L’expérience s’est bien déroulée et a permis d’obtenir un produit d’une
bonne pureté avec un rendement correct.
PARTIE EXPÉRIMENTALE :
Deux solutions identiques d’éthylate de sodium ont été préparées en
dissolvant 1.15g de sodium dans 25mL d’éthanol. Dans la première
solution, 5.65g de cyanoacétate d’éthyle ont été ajoutés alors que 4.85g
de guanidine ⋅ HCl ont été ajoutés dans la deuxième solution. Cette
dernière a été filtrée afin de retirer le NaCl formé puis mélangée à la
solution d’éthyle sodiocyanoacétate. Le mélange a été chauffé deux
heures à reflux avant d’être passé au Rotavapor.
Le solide obtenu a ensuite été recristallisé dans 15mL d’eau chaude,
acidifiée avec 3.5mL d’acide acétique. Le produit final est recueilli sous
forme de cristaux jaunes.
- 3 -

Synthèse de la diamino-2,4-hydroxy-6-pyrimidine
Pauline Bonvin
TP 37
Réactifs
Masse
molaire
[g/mol]
Masse
[g]
Nombre
de moles
[mol]
Equivalent
pour la
réaction
guanidine ⋅ HCl 95.53 4.85 0.051 1
cyanoacétate
d’éthyle 113.11 5.65 0.050 1
éthylate de sodium 68.05 solvant
Produit
Masse
molaire
[g/mol]
Masse
théoriqu
e [g]
Nombre
de moles
[mol]
Masse
obtenue
[g]
Rendement
diamino-2,4-
hydroxy-6-
pyrimidine
128.13 6.40 0.050 3.43 53.6%
RÉFÉRENCES :
(1) Protocole des Travaux Pratiques de Chimie Organique 3ème semestre –
2007/2008
(2) D.H. Williams et I Fleming, Spectroscopic Methods in Organic Chemistry,
Mc Graw-Hill
(3) K.P.C. Vollhardt et N.E. Schore, Traité de Chimie Organique, 4ème édition
(2003), De Boeck
(4) http://fr.wikipedia.org
(5) http://riodb01.ibase.aist.go.jp/sdbs/cgi-bin/direct_frame_top.cgi
- 4 -
1
/
4
100%