Composés Organiques Oxygénés : Cours de Chimie

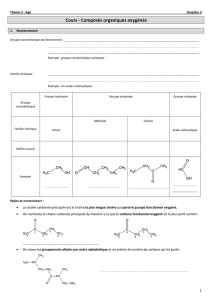
COMPOSÉS ORGANIQUES OXYGÉNÉS
I ) Introduction
L'oxygène possède 6 électrons sur sa couche externe, il donne donc en Chimie Organique
deux liaisons covalentes.
•
••
• Soit deux liaisons dirigées vers deux voisins différents :
•
••
• Soit une double liaison avec un atome de Carbone :
II) Différentes formes de composés oxygénés
Dans les formules suivantes R représente un radical alkyl non cyclique de formule brute
Cn H2n + 1
Alcools de la forme R
OH de formule brute Cn H2n + 2 O
Ethers oxydes R
O
R' de formule brute Cn H2n + 2 O
Aldéhydes R
C
H de formule brute Cn H2n O
||
||||
||
O
Cétones R
C
R' de formule brute Cn H2n O
||
||||
||
O
Acides carboxyliques R
C
O
H de formule brute Cn H2n O2
||
||||
||
O
Esters R
C
O
R' de formule brute Cn H2n O2
||
||||
||
O
C O
O
105°

III) Nomenclature générale
a) Nom principal
Le nom principal est formé :
•
••
• D'un préfixe dépendant du nombre de Carbones
12345678910
meth eth prop but pent hex hept oct non dec
•
••
• D'un suffixe de chaîne (ANE ou ENE) éventuellement précédé du numéro du premier
atome de carbone qui porte la double liaison.
•
••
• D'un suffixe de fonction éventuellement précédé du numéro du carbone portant cette
fonction (dans le cas où la fonction est sur le Carbone numéro 1, ce numéro n'est pas
mentionné).
Différents suffixes de fonction : Alcool : OL
Aldéhyde : AL
Cétone : ONE
Acides carboxyliques : OÏQUE
Remarque :
Si la fonction possède un atome de Carbone, celui-ci est compté dans la chaîne principale
pour donner le préfixe de chaîne.
Pour les molécules ayant plusieurs fonctions, on peut mettre plusieurs suffixes de fonction.
b) Dénomination des substituants.
Les substituants sont des groupements greffés sur la chaîne principale.
Pour les substituants alkyl (dérivés des alcanes), on utilise pour les nommer :
Un préfixe : dépendant du nombre d’atomes de Carbone dans le substituant (voir tableau ci
dessus)
Un suffixe : YL.
c) Ecriture du nom global de la molécule.
On numérote la chaîne principale de manière à ce la double liaison (s'il y a une) ait le plus
bas numéro possible et ensuite à ce que le Carbone qui porte la fonction ait le plus bas
numéro possible.
On fait ensuite figurer devant le nom principal, le nom du substituant précédé du numéro de
l’atome de Carbone qui le porte.
Les différents substituants sont placés par ordre alphabétique.
Dans le cas où le même substituant est répété plusieurs fois dans la molécule, on
utilise devant son nom les préfixes DI, TRI, TETRA, PENTA, HEXA,......

Remarques :
Dans certains cas (composés à plusieurs fonctions) la fonction peut être nommée comme un
substituant.
Exemples
Fonction alcool :
O
H Groupement HYDROXY
Fonction aldéhyde :
C
H FORMYL
||
||||
||
O
Fonction acide carboxylique :
C
O
H CARBOXY
||
||||
||
O
c) Cas particuliers
•
••
•Cas des ethers oxydes : R
O
R'
Le groupe R
O
est appelé groupe "alkoxy"
Le préfixe dépend du nombre de Carbone, ainsi
CH3
O
est appelé groupe méthoxy
CH3
CH2
O
est appelé groupe éthoxy
Exemple :
La molécule CH3
CH2
O
CH2
CH3 est appelée éthoxy éthane
•
••
• Cas des esters : R
C
O
R'
||
||||
||
O
Dans cette molécule, les groupements R et R' ne sont pas interchangeables.
Le nom de la molécule s'écrit :
Préfixe de R + "OATE de " préfixe de R' + "YLE"
Remarque : Dans le préfixe de R, le carbone du groupement CO est compté

IV) Les Alcools
1) Les classes d'alcools
Les Alcools sont de la forme R
O
H mais il est possible de distinguer 3 classes, selon
le nombre de Carbones auxquels est lié le Carbone portant la fonction alcool OH.
a) Alcools Primaires
Ce sont les alcools de la forme
Le carbone qui porte le groupement OH est lié à un seul autre atome de Carbone
Le méthanol CH3
OH est considéré comme un alcool primaire
b) Alcools Secondaires
Ce sont les alcools de la forme
Le Carbone qui porte le groupement OH est lié à deux autres atomes de Carbone.
c) Alcools Tertaires
Ce sont les alcools de la forme
Le Carbone qui porte le groupement OH est lié à trois autres atomes de Carbone.
2) Propriétés chimiques des alcools
a) Action du Sodium
2
alcoolate
- H
2
1
Na O R Na OH R +
++
++
++
+
→
→→
→
+
++
+
+
++
+
Cette réaction met en évidence la présence d'un atome d'Hydrogène mobile dans le
groupement OH, cet Hydrogène est en effet plus mobile que les autres atomes d'Hydrogène
de la chaîne.
b) Oxydation des alcools
CH
O
H
R
R'
C
O
H
R
R'
R'
R
CH2
O
H

•
••
• Oxydation totale - Combustion
Comme toutes les molécules organiques les alcools peuvent donner des réactions de
destruction (combustion).
Dans le cas d'une combustion complète, il se forme du dioxyde de Carbone et de l'eau.
Exemple : Combustion complète de l'éthanol
OH3 CO 2 O3 OHHC 22252 +
++
+
→
→→
→
+
++
+
•
••
• Oxydation ménagée
Une oxydation ménagée est une réaction ayant lieu uniquement sur le site fonctionnel
(groupement hydroxyde et carbone qui le porte), le reste de la chaîne n'étant pas affecté par
la réaction.
Une oxydation ménagée est une réaction qui permet d'augmenter le nombre de liaisons
Carbone
Oxygène sans rupture de la chaîne carbonée.
Cette oxydation peut se faire par action de l'Oxygène ou à l'aide d'oxydants minéraux
comme le dichromate de Potassium (K2Cr2O7) ou permanganate de Potassium (KMnO4) en
milieu acide.
Pour ces oxydants minéraux, il s'agit de réactions d'oxydoréduction.
Les demi réactions faisant intervenir ces oxydants sont :
OH 7 Cr 2 e 6 H 14 OCr 2
3 -
- 2
72 +
++
+
→
→→
→
+
++
++
++
++
++
++
++
+
OH 4 Mn e 5 H8 MnO 2
2 -
-
4+
++
+
→
→→
→
+
++
++
++
++
++
++
++
+
Selon la classe de l'alcool le produit obtenu par oxydation ménagée est différent.
•
••
••
••
• Alcool primaire
Oxydation par l'oxygène
OH O CH R O
2
1
OH CH R 2
aldéhyde
22 +
++
+
→
→→
→
+
++
+
=
==
=
ue carboxyliqacide
2COOH R O
2
1
O CH R
→
→→
→
+
++
+=
==
=
L'oxydation se fait en deux temps, d'abord formation d'un aldéhyde puis s'il y a excès
d'oxydant, formation d'un acide carboxylique.
ue carboxyliqAcide Aldéhyde primaire Alcool oxydation oxydation
→
→→
→
→
→→
→
 6
6
 7
7
 8
8
1
/
8
100%