Résumé protocole BRIM 8

Résumé protocole PIMASERTIB
Titre de l’étude
Etude de phase II multicentrique, randomisée, en
ouvert, évaluant le pimasertib (inhibiteur de MEK) ou
la dacarbazine chez des patients atteints de
mélanome malin localement avancé ou métastasé à
mutation N-ras, naïfs de traitement spécifique
Objectifs de l’étude
Objectif principal
Comparer la survie sans progression [tumorale] (SSP)
des patients traités par le pimasertib ou la
dacarbazine
Objectifs secondaires
Efficacité
Comparer la réponse objective chez les patients
traités par le pimasertib ou la dacarbazine.
Comparer le contrôle de la maladie chez les
patients traités par le pimasertib ou la
dacarbazine.
Evaluer la survie globale (SG) chez les patients
traités par le pimasertib ou la dacarbazine
Tolérance
Comparer le profil de tolérance chez les patients
traités par le pimasertib ou la dacarbazine
.
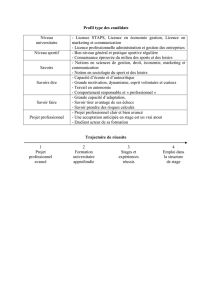
Schéma et plan de l’étude
Essai de phase II, multicentrique, randomisé, en
ouvert, évaluant le pimasertib versus la dacarbazine
(2 vs 1).
Pour chaque patient, l’essai comprendra :
Une période de sélection et de référence pouvant
aller jusqu’à 35 jours,
Une période de traitement à l’étude, consistant en
cycles consécutifs de 21 jours,
Une période post-traitement : 30 ±3 jours après la
dernière prise du traitement à l’étude.
Les données de suivi de la survie seront collectées
tous les 6 mois, jusqu’à la fin de l’étude

Principaux critères d’inclusion et
d’exclusion
Critères d’inclusion
1. Présence d’un mélanome malin inopérable
localement avancé ou métastasé (stade IIIc ou
M1a-c) à mutation N-ras, mesurable, confirmé par
histologie ou par cytologie.
2. Lésions tumorales pouvant faire l’objet d’une
biopsie ou existence d’échantillons de tissu
tumoral archivés.
3. Age ≥ 18 ans.
4. Patient acceptant de donner son consentement
éclairé, après avoir lu et compris le formulaire de
consentement éclairé. Patient pleinement
conscient des exigences de l’étude et acceptant de
respecter toutes les visites et évaluations de
l’étude.
5. Les femmes en âge de procréer doivent présenter
un test sérique de grossesse négatif à la visite de
sélection.
6. Les femmes en âge de procréer et les hommes
dont la partenaire féminine est en âge de procréer
doivent utiliser une méthode de contraception
fiable tout au long d’une période allant de 2
semaines avant la première prise du traitement à
l’étude à 4 semaines après la dernière prise du
traitement à l’étude.
Critères d’exclusion
7. Antécédents de traitement systémique pour
mélanome malin localement avancé ou métastasé
(à l’exclusion d’un traitement adjuvant).
8. Lésions non mesurables, maladie non évaluable
selon les critères RECIST v. 1.1.
9. Score ECOG (Eastern Cooperative Oncology Group)
> 1.
10. Insuffisance médullaire,
11. Insuffisance rénale,
12. Fonction hépatique anormale
13. Anomalies significatives de la conduction
cardiaque,
14. Hypertension non contrôlée par médicaments.

15. Maladie dégénérative de la rétine
16. Métastases actives au SNC.
17. Sérologie positive pour le VIH, hépatite C active
ou hépatite B active.
18. Intervention chirurgicale dans les 28 jours
précédant le 1er jour du traitement à l’étude (J1).
19. Antécédents de radiothérapie étendue sur plus
de 30% des réserves médullaires ou de
transplantation de moelle osseuse/cellules
souches, dans les 5 ans précédant J1.
20. Antécédents d’une autre pathologie médicale
significative
21. Hypersensibilité à la dacarbazine.
22. Grossesse ou allaitement.
23. Participation à un autre essai clinique dans les
28 jours précédant J1.
1
/
3
100%