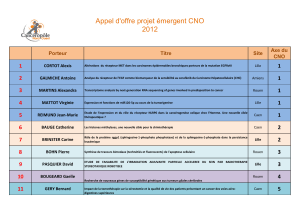
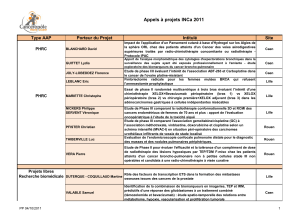
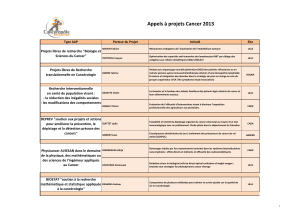
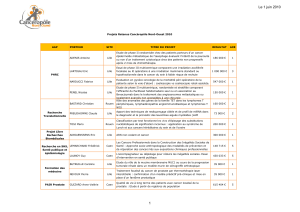
Livret des communications - Canceropole Nord

Livret des
communications

6èmes Journées Scientifi ques
15 au 17 mai 2013 – Deauville
2
SOMMAIRE
EDITORIAL DU PRÉSIDENT DU CANCÉROPÔLE NORD-OUEST p3
PROGRAMME DES 6ÈMES JOURNÉES SCIENTIFIQUES p 4 - 7
COMMUNICATIONS :
- La radiothérapie adaptative dans le Cancéropôle Nord-Ouest...................
- La recherche clinique dans le Cancéropôle Nord-Ouest.........................
- Génétique des tumeurs....................................................................
- Biomarqueurs pronostiques et prédictifs.............................................
p
p
p
p
8 - 10
11 - 13
14 - 16
17 - 19
- Session jeunes chercheurs
- Communications par ordre alphabétique..................................
- Résumés des 10 communications orales sélectionnées .............
- Résumés des communications affi chées..................................
p
p
p
21
22 - 31
32
- Axe 1 ................................................................... p 33 - 66
- Axe 2 ................................................................... p 67 - 76
- Axe 3 ................................................................... p 77 - 90
- Axe 4 ................................................................... p 91 - 95
- Axe 5 ................................................................... p 96 - 99

6èmes Journées Scientifi ques
15 au 17 mai 2013 – Deauville
3
Editorial du Pr
é
sident
Les journées 2013 du Cancéropôle Nord-Ouest s’inscrivent dans un contexte tout
particulier, car nous y célébrons les dix ans du Cancéropôle et nous sommes engagés
dans la préparation de notre nouveau projet pour le troisième plan cancer récemment
annoncé par le Président de la République.
Nous avons pris la mesure du chemin parcouru depuis 2003 et commencé à défi nir ce
qui reste à réaliser dans les quatre ans qui viennent. 2013 sera donc pour nous une
année exceptionnellement riche et studieuse! Nous l’avons entamée avec enthou-
siasme, car 2012 a été l’occasion de grandes satisfactions, avec notamment l’orga-
nisation du congrès international «Troubles cognitifs et cancer», l’obtention d’un pre-
mier soutien de la Ligue contre le Cancer pour la plate-forme «Inégalités sociales», le
développement impressionnant de l’utilisation du NGS par nos équipes de génomique
et enfi n le soutien important obtenu tout récemment de la DGOS pour un projet très
original favorisant la diffusion de la recherche clinique dans les hôpitaux non universi-
taires. La création du SIRIC OncoLille, qui développera ses activités en pleine synergie
avec le Cancéropôle, est également une excellente nouvelle.
Nous n’avons pas à rougir de notre bilan et nos points forts s’inscrivent parfaitement
dans les priorités du futur plan cancer.
Tout ceci justifi ait pleinement de donner un lustre particulier à nos journées. Une nou-
velle formule et un programme scientifi que exceptionnel vous y attendent!
Excellentes journées à toutes et à tous !
Pierre Formstecher
Président du Cancéropôle Nord-ouest

6èmes Journées Scientifi ques
15 au 17 mai 2013 – Deauville
4
Programme
Mercredi 15 mai
2013 - A.Midi
13h00 - 13h45 Café d’accueil
Enregistrement des participants
13h45 - 14h50 Introduction des journées, aspects stratégiques
- Pierre Formstecher, Véronique Pancré
- Véronique Atger, responsable du département biologie du cancer, INCa
LA RADIOTHÉRAPIE ADAPTATIVE DANS LE CANCÉROPÔLE NORD-OUEST
Modérateurs : Pierre Véra et Eric Lartigau
10 minutes d’introduction
15h00 - 16h00 CONFÉRENCE DE PRESTIGE
Le Dose painting en radiothérapie
Soren Bentzen
16h00 - 17h00 Projets émergents AAP 2012 CNO
- Pierre Bohn : Synthèse de traceurs bimodaux (technétiés et fl uorescents)
de l’apoptose
- David Pasquier : Etude de faisabilité de l’irradiation adjuvante partielle
accélérée du sein par radiothérapie stéréotaxique robotisée
- -Victor Emmanuel Pernin : Impact de la tomothérapie sur la xérostomie
et la qualité de vie des patients présentant un cancer des voies aéro-diges-
tives supérieures
17h00 - 17h30 Pause
17h30 - 18h30 Visite des posters
18h30 - 20h00 Evénement 10 ans du Cancéropôle Nord-Ouest
20h00 - 22h00 Cocktail dînatoire
opôle
Nord-Ouest

6èmes Journées Scientifi ques
15 au 17 mai 2013 – Deauville
5
Programme Jeudi 16 mai
2013 - Matin
8h30 - 9h00 Café d’accueil
Enregistrement des participants
LA RECHERCHE CLINIQUE DANS LE CANCÉROPÔLE NORD-OUEST
Modérateurs : Jean-Claude Barbare et Gérard Zalcman
9h00 - 9h10 Introduction
9h10 - 10h10 CONFÉRENCE DE PRESTIGE
L’apport des groupes coopérateurs
Jean Faivre
10h10 - 10h30 Projets émergents AAP 2012 CNO
Antoine Galmiche : Analyse du récepteur de l’EGF comme biomarqueur de
la sensibilité au sorafénib du Carcinome Hépatocellulaire (CHC)
10h30 - 10h50 Projet METACOLO
David Tulasne : Cartographie des altérations des récepteurs tyrosine
kinase par séquençage haut débit dans les tumeurs colorectales et leurs
métastases
10h50 - 11h20 Pause
11h20 - 12h35 SESSION JEUNES CHERCHEURS [1]
5 communications orales
12h35 - 14h00 Cocktail déjeunatoire
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
1
/
108
100%