Contrôle du cycle cellulaire

Contrôle du cycle cellulaire
I. Généralités
Phénomène très précis : quand une cellule mère se divise elle donne deux cellules filles
identiques, avec un volume identique à celui de la cellule mère avant son entrée en division.
Tout a donc doublé.
A. Approches Cellulaires
1) Hybridation Cellulaire
Cellules hybrides : ne se forment pas généralement de manière naturelle.
Il existe en revanche à certains stades de certaines cellules, des fusions cellulaires.
Provoqué artificiellement via :
- Petits virus à enveloppe (entourés par un morceau du plasmalemme de la cellule où ils
se sont multipliés) qui ont l’aptitude à se coller sur la membrane bio d’une autre
cellule.
Sendaï permet de faire des hybridations : créer des pontages entre deux cellules
permettant la fusion de celles-ci, créant une cellule hybride.
- De manière chimique : le Poly Ethylène Glycol (PEG) modifiant la structure chimique
des membranes biologiques favorisant la fusion entre deux membranes bio.
Dans tous les cas, on obtient des Hybridomes, qui conservent de manière séparé leur
information génétique : hétérocaryon (les noyaux ne fusionnent pas).
On peut les faire survivre pendant un certain temps.
B. Approches Biochimiques
Besoin de beaucoup de cellules au même stade du cycle cellulaire en même temps, pour
permettre une étude biochimique.
C. Approches Génétiques (levures)
Saccharomyces cereminae : cellule Bourgeonnante.
Elle a une mitose inégale.
On lui préfère donc la Schizosaccharomyces pombe : levure fissipare. On obtient deux cellules
identiques lors de la méiose.
On peut créer des mutants dont l’expression phénotypique est dépendant de la température. Or
pour comprendre les mutants il faut les comparer à des levures sauvages équivalentes.
Et, avec les levures, lorsque l’on créer un mutant, selon la température à laquelle on le cultive,
il va pouvoir exprimer soit un phénotype sauvage, soit le phénotype mutant.
Ce sont des températures dites restrictives pour le phénotype mutant, alors que pour le
sauvage, c’est une température permicide.

II. Données Cellulaires et Biochimiques
A. Hybridations cellulaires : les Points de Contrôle
1) S + G1
La cellule dont le noyau étant en phase G1 va entrer immédiatement en phase S et celui en
phase S reste en S.
Une cellule en phase G1 est donc immédiatement prête à duplique son ADN, mais il doit lui
manquer quelque chose, que l’on appeler un « activateur de la phase S ».
La frontière G1 – S est marquée par la présence d’un élément chimique appelé activateur de la
phase S.
2) S + G2
Le noyau en phase S reste en S et le G2 en G2.
Le G2 est donc devenu réfractaire à sa division cellulaire.
Donc après une duplication de l’ADN, il est impossible de le dupliquer une seconde fois.
Le noyau G2 ne possède pas d’inhibiteur à la duplication, mais simplement une non réponse
des cellules en phase G2.
L’activateur de la phase S a donc disparu à la fin de celle-ci.
3) G1 + G2
Tout le monde reste comme avant.
Ne déclenche pas la synthèse de l’ADN.
4) M+ G1 / S / G2
Dans tous les cas, cela déclenche l’équivalent d’une mitose dans les noyaux au stade G1 / S
ou G2.
D’abord l’enveloppe nucléaire disparait, puis la chromatine se condense donnant :
- G2 = chromosomes à deux chromatides réunit par le centromère.
- G1 = chromosomes à une chromatide
- S = morceaux d’ADN, ou bien à une chromatide ou encore, partiellement à deux
chromatides.
Si l’on fait une hybridation d’une cellule en phase M avec n’importe quel autre stade
cellulaire, on déclenche l’équivalent d’une mitose dans chacune d’elles.
Donc, chaque stade, chaque cellule est susceptible d’entré en division : facteur promoteur de
la mitose : MPF.
MPF : G2 → M
B. Nature chimique du MPF
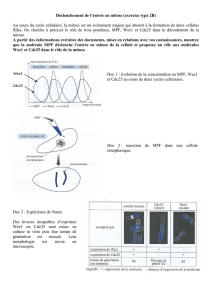
Démontré chez un organisme modèle : Xenopus (crapaud africain).
Au cours de son développement embryonnaire, il y a formation d’abord d’une cellule initiale :
l’œuf de fécondation (zygote) avec une taille énorme : 1mm.
Permet de faire des prélèvements de cytosol sans faire exploser la cellule, mais également de
leur injecter des produits.

De plus, il possède une particularité biologique : lorsqu’il y a fabrication des gamètes (surtout
femelle), il y aura des blocages naturels. Il en existe un à l’entrée de la prophase méiotique au
niveau des ovocytes de première génération. On considère qu’ils sont bloqués en G2.
Normalement, fait suite un pic de progestérone permettant la reprise de cette mitose.
Il existe également un blocage en métaphase de la 2e division, levé par la fécondation.
Si on prend du cytosol d’une cellule en mitose et que l’on injecte ce cytosol dans les ovocytes
bloqués en G1 ou G2 et l’on achève la division cellulaire.
Grace à ce modèle on a montré la chose suivante : quel que soit l’organisme animal ou
végétal, du cytosol d’une cellule en mitose provoque l’entrée en mitose de la cellule à laquelle
on injecte le produit.
Il existe donc un seul facteur responsable de l’entrée en mitose.
MPF est donc un facteur universel à tous les organismes vivants. Il ne possède aucune
spécificité.
On peut également montrer que ce facteur a une variation cyclique au cour d cycle cellulaire.
Activité maximale du MPF : au milieu de la mitose : stade métaphase.
Augmente son activité au début de la mitose, puis diminution après la métaphase.
1 Kinase (PM=34) = Cdc2=Cdk1
Il s’agit d’un hétérodimère protéique :
1 Protéine(PM=45)=Cycline B =Cdk1
C. Les Cyclines
12aine de protéine
Parmi toutes les protéines existantes, il existe une seule famille dont on voit des variations
cycliques au cours du cycle cellulaire : Famille des Cyclines.
En particulier la Cycline B (PM = 45)
A la fin de la mitose, tout comme au départ, on n’en trouve pas, en revanche, concentration est
maximale lors de la mitose.
Degré d’homologie dans leur structure primaire, en particulier un domaine de 100-150AA
CyclineBox
Elles sont dégradées par les protéasomes, elles speuvent être chargées donc en ubiquitine.
Existe aussi la Boite D (boite de destruction)
Tous les membres de cette grande famille peuvent s’associer à la Protéine P34 (Kinase à
PM=34) ou bien apparentées.
Elles ont étés synthétisées à un moment particulier du cycle cellulaire.
Elles vont réguler l’activité des kinases auxquelles elles se lieront. Ce sont des Kinases
dépendantes des Cyclines : CdK

D. Les CdK
Protéines Kinases dont l’activité est dépendant de l’association avec une Cycline.
Première kinase dépendant de la présence d’une cycline, est la CdK1
On connait 10-12aine de CdK, mais attention, leur numérotation provient de l’ordre de
découverte de celles-ci, et non de leur chronologie.
Toutes les CdK ont une particularité qui est de posséder des sites de phosphorylation.
(page44)
Il existe trois sites de phosphorylation que l’on peut mettre en évidence :
- AA en position 161 qui est toujours une Thréonine
Phosphorylation activatrice : enzyme devient active, sans cette phosphorylation la
kinase ne fait rien, que dalle, nada !
- En 14, une Thréonine, et en 15 une Tyrosine qui peuvent eux-aussi être phosphorylés
Phosphorylation inhibitrice.
Lorsque ces familles sont triplement phosphorylées, alors la Kinase n’aura pas d’activité.
III. Approches Génétiques
Mutants Thermosensibles
Levure Fissipare : Schizosaccharomyces pombe
Toute la nomenclature des gènes et protéines qui leur correspondent, est celle que l’on utilise
à propos des Schizosaccharomyces pombe.
Une bonne 50aine des mutants intéressent le déroulement du cycle.
Une 50aine de gènes interviennent donc dans le cycle.
Finalement, le cycle cellulaire peut être considéré comme une succession de phases, et pour
qu’une phase n puisse se dérouler, il est nécessaire que la phase (n-1) se soit correctement
déroulée.
Parmis ces 50 gènes on montre qu’il existe dans ce schéma linéaire, deux points de contrôle,
deux étapes clés.
- La frontière entre G1 – S est essentielle.
- La deuxième est l’entrée en Mitose : G2 – M
(C’est le moment où le MPF devient actif)
5gènes sont répertoriés ici, car ils auront un rôle bien précis.
Tous ces gènes ont parfois étés identifiés par des laboratoires différents, donc des
nomenclatures différentes, normalement, on devrait appeler tous ces mutants, des gènes de
type Cdc fabricant des protéines correspondantes, Cdc
Cdc2 = CdK1 (p34)
Cdc25
CdC13 = Cycline B (p45) tous de type Cdc, qui expliquent l’activation du MPF
Wee1
Nim1

IV. Les Mécanismes Moléculaires du Cycle ȻR
Point Start et entrée en mitose = découlent de l’analyse des mutants.
Sortie de mitose = ne découle pas d’analyse mutant etc… important pour la succession des
cycles.
A. L’induction Mitotique (schéma milieu p.45)
Nécessite du MPF actif.
Il existe chimiquement avant l’entrée en mitose, mais il est inactif.
Il sera actif lorsque la Kinase P34 pourra exprimer son activité.
Pendant la G2, la p34 et la cycline associée au MPF (cycline B) sont rattachés au MPF, qui
reste inactif car la p34 est triphosphorylée. (notée p34–P, induisant le Pré–MPF)
Activation = déphosphorylation du Pré–MPF, la p34 est déphosphorylée.
Ces phosphorylations sont possibles via :
- CAK pour le site 161 (activateur)
- La Wee1 pour le 15
- Il en existe également une pour le site 14, mais non identifiée.
On sait simplement que cette activité kinase et porté par la membrane.
Passage d’inactif à actif : déphosphorylation du MPF sur les deux sites inhibiteurs 14 et 15
par l’action d’une phosphatase (Cdc25) qui, pour fonctionner doit elle-même être
phosphorylée sur un site différent de celui du MPF par une kinase initiale (activateur) =
Polokinase.
Une fois le MPF actif, un des substrats du MPF phosphoryle la Cdc25 (autoentretien du
système).
CAK kinase
Protéine elle-même associée à une cycline (Protéine fabriquée pendant le cycle cellulaire, et
dont la concentration varie).
Nim1 & Wee1
La Wee1 peut-elle-même être phosphorylée, ce qui abolie son aptitude Kinase.
Elle le peut soit par le MPF actif (rétro-contrôle), soit par Nim1 (qui est donc globalement un
activateur du MPF).
B. La Sortie de la Mitose (schéma milieu p.45)
Marquée par l’arrêt de l’activité du MPF.
La solution la plus simple : plus de MPF.
Pour cela, deux solutions :
- Les deux constituants disparaissent
- L’un au moins disparait
On va en effet détruire la Cycline B, donc on ne peut plus parler de MPF.
 6
6
 7
7
 8
8
1
/
8
100%