- enseignement Catholique

1
Document1
AUTEURS : Caroline Destrée, Brigitte Janssens, Pascale Sartiaux
Fiche d’expérience 2
Electrolyse de l’eau
Cette expérience peut être réalisée par les élèves moyennant le respect de certaines précautions (voir
le point 6. Sécurité) : dans ce cas, les points 2, 3, 4 et 6 leur sont destinés.
1. Objectifs de l’expérience
Par cette expérience, les élèves découvrent que certaines matières se décomposent (concept de
molécules) et identifient les atomes constituant les molécules.
2. Description générale
L’électrolyse est une technique scientifique qui vise à transformer des corps purs composés en
corps purs simples en employant le passage d’un courant électrique continu.
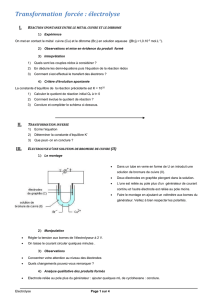
3. Matériel et produits
- 1 petit bac en plastique muni de 2 attaches pour
tenir les électrodes (pièces qui permettent de fixer
des tubes en plastique sur un mur) collées sur les
parois du récipient
- 2 électrodes : pour chaque électrode, introduire 1
morceau de pic à brochette en inox (ou des tiges
filetées ou des tiges en inox) dans une seringue de
10 mL et bien s’assurer que le point d’insertion est
étanche. Au besoin le colmater avec du silicone
(utiliser un pistolet à colle).
- Une solution de carbonate de sodium (soude)
60 g/L (utiliser de l’eau déminéralisée pour
préparer la solution)
- 1 chargeur de GSM (dont la tension est d’environ
5V) dont la fiche a été remplacée par deux pinces
crocodiles
- Allumettes
- Bâton en bois (type pic à brochette)
HPT
Formation scientifique
UAA9

2
Document1
4. Procédure
1) Verser la solution d’électrolyse (carbonate de sodium) dans le bac.
2) Remplir les seringues munies de l’électrode en inox avec cette solution en prenant soin de ne
pas avoir de bulle d’air.
3) Fixer chaque seringue dans les attaches, l’ouverture tournée vers le bas.
4) Placer les pinces crocodiles sur les pics à brochettes.
5) Brancher le chargeur GSM afin de faire circuler le courant dans le dispositif pendant une
quinzaine de minutes et observer.
6) Arrêter l’électrolyse et réaliser les tests d’identification des gaz formés :
- approcher une allumette enflammée dans la seringue contenant le volume de gaz le plus
grand et observer (écouter) ;
- approcher un pic à brochette en bois incandescent près de l’autre seringue et observer.
5. Notes pour le professeur
- Dès que l’on branche le chargeur GSM, on peut distinguer des bulles de gaz qui se forment à
proximité des pics à brochette dans les seringues.
- On peut observer que le volume de gaz dans une des seringues est le double (de l’H2 s’est
formé à la cathode) que celui récolté dans l’autre (O2).
- Après une quinzaine de minutes, on a recueilli une quantité de gaz suffisante pour faire les
tests d’identification :
o Lorsque l’on approche une allumette enflammée de la seringue contenant le dihydrogène,
une petite détonation se produit.
o Lorsque l’on approche un pic à brochette incandescent de la seringue contenant le
dioxygène, la flamme se ranime.
- L’équation bilan peut s’écrire comme suit (forme nominative) :
Eau → Dihydrogène + Dioxygène
- A partir de l’électrolyse du H2O, l’élève modélise le phénomène à l’aide de modèles
moléculaires, où chaque atome est représenté par une sphère (sphère verte pour l’atome
d’oxygène ; sphère orange pour l’atome d’hydrogène) :
Pour arriver à cette modélisation, l’élève pourra manipuler des boules de cotillon de différentes
couleurs et des cure-dents. Pour mettre l’accent sur l’aspect dynamique d’une réaction
chimique, on pourra faire appel à la technique du « Stop motion animation » (appli disponible
pour tablette). On peut aussi utiliser des briques Duplo.
- En associant les formules chimiques ad hoc à chaque modèle moléculaire, les élèves peuvent
donner la composition chimique de chaque molécule.
H2O
H2O
H2
H2
O2

3
Document1
- Principe et description du processus (uniquement à l’usage du professeur)
Le courant électrique dissocie la molécule d'eau (H2O) en ion hydroxyde (HO-) et en ion
hydrogène H+ : dans la cellule électrolytique, les ions hydrogène acceptent des électrons à la
cathode dans une réaction d'oxydation en formant du dihydrogène gazeux (soit H2), selon la
réaction de réduction :
alors qu'une oxydation des ions hydroxyde, qui perdent donc des électrons, se produit à l'anode
afin de « fermer » le circuit électrique (équilibre de la réaction chimique en charges) :
ce qui donne l'équation de décomposition par électrolyse :
La quantité de matière de dihydrogène gazeux produite est donc deux fois celle de dioxygène.
- Pourquoi utiliser une solution de carbonate de sodium (Na2CO3) lors de l’électrolyse de l’eau ?
L’eau pure conduit peu l’électricité ; l’électrolyse de l’eau est alors impossible dans les
conditions standards. Pour que la réaction puisse avoir lieu, il est nécessaire d’ajouter des
électrolytes en solution. L’électrolyte se dissout en solution aqueuse, libérant des cations et des
anions (ainsi, le Na2CO3 en solution aqueuse libère des ions Na+ et des ions CO3=). Ces ions,
chargés électriquement, conduisent donc l’électricité car ils sont mobiles dans l’eau. La
présence d’un électrolyte en solution aqueuse dans une cellule d’électrolyse permet dès lors de
« fermer » le circuit électrique. Les électrolytes sont habituellement des acides, des bases ou
des sels.
6. Sécurité
La réalisation d’expériences en particulier en chimie suppose le respect d’un certain nombre de
règles permettant à chacun, élèves et professeur, de vivre ces séances de laboratoire dans les
meilleures conditions de sécurité.
Pour chaque local où se déroulent de telles expériences, existe un règlement de laboratoire,
approuvé par le Conseiller en Prévention. Il sera signé par le chef d’établissement, le professeur,
l’élève et ses parents/responsables.
Chaque élève a une bonne connaissance de ce document.
Analyse de risques
Cette expérience ne comporte pas de risques majeurs.
Informations sur les réactifs
- Le carbonate de sodium est un sel dérivé de l’acide carbonique qui peut être irritant.
Formule : Na2CO3

4
Document1
7. Développements attendus principalement visés
Sur base d’une expérience réalisée en classe, expliciter la molécule comme étant un assemblage
d’atomes (C1).
À partir d’une transformation chimique réalisée en classe, l’élève modélise le phénomène à l’aide
de modèles moléculaires (sphères qui représentent les atomes et que l’on peut combiner) afin de
comprendre ce qui se passe au cours du phénomène au niveau des molécules et des atomes.
Écrire les symboles des éléments rencontrés (C3).
L'élève connait et utilise le symbole chimique des différents atomes rencontrés lors des activités.
À partir de la formule chimique d’une substance courante, donner sa composition atomique (A2).
Sur base de la formule chimique d’une substance (ou de sa modélisation à partir de modèles
moléculaires), l’élève identifie, nomme et dénombre les atomes de chaque espèce.
8. Bibliographie
- DESTREE, C., HAUTIER, P., Fiche d’expérience 3 - Electrolyse de l’eau, HGT, Sciences de
base et sciences générales, UAA1, http://enseignement.catholique.be/fesec/secteurs/sciences/
(page consultée le 22/10/2015)
- HAUTIER, P., TOUBEAU, J., Fiche d’expérience pour le 2e degré, Congrès des Sciences,
Liège, 2014
- STEPHANI, R., Expériences de chimie low cost, Congrès des Sciences, Liège, 2014
- Wikipédia, Electrolyse de l’eau, https://fr.wikipedia.org/wiki/%C3%89lectrolyse_de_l%27eau
(page consultée le 02/11/2015)
- Wikipédia, Electrolyte, https://fr.wikipedia.org/wiki/%C3%89lectrolyte (page consultée le
22/11/2015)
1
/
4
100%