ÉTUDE GÉNÉALOGIQUE D`INDIVIDUS ATTEINTS DE MALADIES

ANNE-CAROLME TREMBLAY
ÉTUDE GÉNÉALOGIQUE D'INDIVIDUS ATTEINTS
DE MALADIES INFLAMMATOIRES CHRONIQUES
NON-SPÉCIFIQUES DE L'INTESTIN
Mémoire présenté
à la Faculté des études supérieures de
l'Université
Laval
comme exigence partielle du programme de maîtrise en médecine expérimentale
offert à
l'Université
du Québec à CMcoutimi
en vertu d'un protocole
d'entente
avec
l'Université
Laval
pour
l'obtention
du grade de maître es sciences (M.Se.)
FACULTÉ DE MÉDECINE
UNIVERSITÉ LAVAL
QUÉBEC
et
DÉPARTEMENT DES SCIENCES HUMAINES
UNIVERSITÉ DU QUÉBEC À CHICOUTIMI
SAGUENAY
SEPTEMBRE 2004
© Anne-Caroline Tremblay, 2004,

bibliothèque
Paul-Emile-Bouletj
UIUQAC
Mise en garde/Advice
Afin de rendre accessible au plus
grand nombre le résultat des
travaux de recherche menés par ses
étudiants gradués et dans l'esprit des
règles qui régissent le dépôt et la
diffusion des mémoires et thèses
produits dans cette Institution,
l'Université du Québec à
Chicoutimi (UQAC) est fière de
rendre accessible une version
complète et gratuite de cette œuvre.
Motivated by a desire to make the
results of its graduate students'
research accessible to all, and in
accordance with the rules
governing the acceptation and
diffusion of dissertations and
theses in this Institution, the
Université du Québec à
Chicoutimi (UQAC) is proud to
make a complete version of this
work available at no cost to the
reader.
L'auteur conserve néanmoins la
propriété du droit d'auteur qui
protège ce mémoire ou cette thèse.
Ni le mémoire ou la thèse ni des
extraits substantiels de ceux-ci ne
peuvent être imprimés ou autrement
reproduits sans son autorisation.
The author retains ownership of the
copyright of this dissertation or
thesis.
Neither the dissertation or
thesis,
nor substantial extracts from
it, may be printed or otherwise
reproduced without the author's
permission.

Résumé
Ce mémoire s'insère dans le cadre d'un programme de recherche visant
à identifier des loci génétiques jouant un rôle dans le développement des
maladies inflammatoires de l'intestin. Le principal objectif de notre étude est
de mieux comprendre la composante génétique dans l'étiologie des maladies
inflammatoires de l'intestin. Ceci sera fait à l'aide de la reconstitution et de
l'analyse des généalogies ascendantes d'individus atteints et non atteints,
recrutés dans la population du Saguenay-Lac-Saint-Jean. Notre cohorte est
composée de 49 personnes, dont 23 ont la colite ulcéreuse et 26 la maladie
de Crohn. Le groupe témoin, est composé de 49 personnes. Nos analyses
montrent des coefficients d'apparentement plus élevés chez les proposants
non-fumeurs et chez ceux ayant la colite ulcéreuse. Les coefficients de
consanguinité sont aussi plus élevés chez les proposants ayant une histoire
familiale de maladies inflammatoires de l'intestin et chez ceux qui présentent
des manifestations extra-intestinales. Finalement, cette étude nous permet
de conclure qu'il y a probablement un facteur génétique dans les maladies
inflammatoires de l'intestin et que ce facteur pourrait avoir des composantes
récessives et dominantes.

Avant-propos
Je tiens principalement
à
remercier
ma
directrice
de
maîtrise,
Dr Hélène Vézina, qui
a
orienté mes recherches, pour son aide,
sa
patience
et
sa compréhension.
Je veux également remercier Mme Jocelyne Tremblay, infirmière
de
recherche
au
complexe hospitalier
de la
Sagamie,
et le Dr
Gilles Lapointe
pour leur collaboration et leur aide lors de mes recherches.
Je voudrais aussi remercier l'équipe
du
Projet BÂLSÂC, plus
spécialement Mme Michèle Jomphe
et
M. France Néron» qui m'ont aidée lors
des reconstitutions
et
des analyses généalogiques, ainsi que M. Louis Houde,
professeur
à
ITJQAC, pour les calculs des coefficients d'apparentement.
Finalement, je tiens
à
remercier ma famille qui m'a encouragée tout
au
long de ce projet,
Mme
Jeannine Choquette, Mlle Julie Savard pour leur aide,
et toutes les personnes qui ont contribué
à
ce projet de près ou de loin.

Table des matières
RÉSUMÉ....
II
A¥ANT-PROPOS
III
TABLE
DBS
MATIÈRES.....
I¥
LISTE
DES
TABLEAUX
¥11
LISTE
DES
FIGURES
X
INTRODUCTION...........
........1
CHAPITRE
1 :
PRÉSENTATION
DU
SUJET
ET
RECENSION
DES
ÉCRITS. 4
1.1
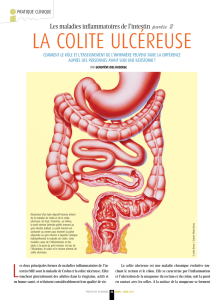
LES MALADIES INFLAMMATOIRES DE L'INTESTIN
4
1.1.1
La
maladie
de
Crohn
5
1.1.2
ha
colite ulcéreuse
7
1.2
FACTEURS DE RISQUE
9
1.2.1 L'âge
10
1.2.2
Le
sexe
10
1.2.3 Le groupe ethnique
11
1.2.4
Le
statut de fumeur
11
1.2.5 Laprise
de
contraceptif.....
13
1.2.6 L'histoire familiale
13
1.3
AUTRES FACTEURS SUSCEPTIBLES D INFLUENCER LA PATHOLOGIE
14
1.3.1 La profession
14
1.3.2
Le
régime alimentaire
14
1.4
ÉTUDES DE PREVALENCE FAMILIALE......
..15
1.5
ÉTUDES GÉNÉTIQUES
.17
1.5.1 Études sur les
chromosomes
de
susceptibilité
18
1.5.2 Études sur
tes
gènes candidats
19
1.6
LA POPULATION DU SAGUENAY-LAC-SAMT-JEAN
23
1.7
ÉTUDES GÉNÉALOGIQUES DES TRAITS COMPLEXES
24
1.8
PROJET MULTICENTRIQUE ET OBJECTIFS DE L'ÉTUDE
28
CHAPITRE
2 :
DONNÉES
ET
MÉTHODOLOGIE
31
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
1
/
145
100%