BACCALAURÉAT TECHNOLOGIQUE - SESSION 2012 SCIENCES ET TECHNOLOGIES DE LABORATOIRE

Sujet 34 1/5
BACCALAURÉAT TECHNOLOGIQUE - SESSION 2012
SCIENCES ET TECHNOLOGIES DE LABORATOIRE
Spécialité : Chimie de Laboratoire et de Procédés industriels
Épreuve Techniques de laboratoire
Durée : 4 heures Coefficient : 7
SUJET N°34
PRÉPARATION DE LA CYCLOHEXANONE
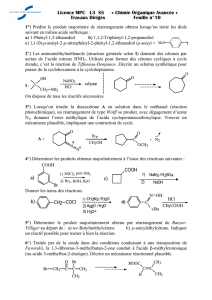
La cyclohexanone (C
6
H
10
O) est obtenue par oxydation du cyclohexanol (C
6
H
12
O) par le
mélange sulfochromique :
OH O
Cr
2
O
7
H
+
2-
I DONNÉES
Les températures d'ébullition sont données sous une pression normale de 1,0135 × 10
5
Pa.
Dichromate de sodium dihydraté :
M = 298 g.mol
-1
pureté (en masse) : 99 %
Toxique par ingestion ou par inhalation ; irritant pour la peau et les
muqueuses.
À utiliser sous la hotte ventilée, avec des gants ; jeter les eaux de lavage
dans un récupérateur approprié.
Cyclohexanone : M = 98,1 g. mol
-1
d = 0,95 T
eb
= 156 °C
Très légèrement soluble dans l'eau
Inflammable ; nocif par inhalation.
La cyclohexanone forme un hétéroazéotrope avec l'eau, T
Az
= 98 °C.
Cyclohexanol : M = 100,2 g. mol
-1
d = 0,96 T
fus
= 25 °C T
eb
= 161 °C
Très peu soluble dans l'eau
Inflammable ; nocif par inhalation.
Acide sulfurique concentré :
M = 98 g.mol
-1
d = 1,83 pureté (en masse) : 98 %
Très corrosif, à utiliser avec des gants ; réaction exothermique avec l'eau.
2,4-DNPH : M = 198,1 g.mol
-1
Explosif à l’état sec. Nocif en cas d’ingestion. Irritant pour les yeux et la
peau.
Solution corrosive, à utiliser avec des gants.

Sujet 34 2/5
II. MODE OPÉRATOIRE
1. Oxydation du cyclohexanol
• Dans un ballon tricol de 250 mL, muni d'une agitation magnétique, placé dans la glace,
introduire successivement :
- 50 mL d’eau ;
- 20 mL d’acide sulfurique concentré ;
- 20 mL de cyclohexanol.
• Placer alors le ballon dans un bain d’eau froide ; l'équiper d’un réfrigérant ascendant, d’une
ampoule de coulée et d'un thermomètre
• Introduire dans l'ampoule de coulée la solution (fournie) de dichromate de sodium, obtenue
en dissolvant 21,0 g de dichromate de sodium dihydraté dans 25 mL d’eau.
• Verser lentement la solution oxydante sous vive agitation : la température ne doit pas
dépasser 60 °C.
2. Extraction de la cyclohexanone
• Modifier le montage afin de procéder à une hydrodistillation (moyen de chauffage : plaque
chauffante).
• Introduire alors par l’ampoule de coulée 30 mL d’eau.
• Chauffer le contenu du ballon et recueillir le distillat.
• Poursuivre l'extraction pendant 10 min après la fin supposée de l'hydrodistillation.
3. Isolement de la cyclohexanone
3.1. Séparation du mélange eau-cyclohexanone.
• Transvaser le distillat dans une ampoule à décanter.
• Séparer les deux phases.
• Mettre de côté et conserver la phase organique.
3.2. Traitement de la phase aqueuse
Dissoudre dans la phase aqueuse une masse de chlorure de sodium correspondant à environ
20 % de la masse de la phase aqueuse ; laisser décanter, puis réunir les phases organiques
dans un erlenmeyer.
Noter le volume V
1
de la phase aqueuse et le volume V
2
de la phase organique.
3.3. Traitement de la phase organique
Sécher la phase organique sur sulfate de magnésium anhydre. Recueillir la cyclohexanone
brute (masse m à mesurer) après filtration.
4.Contrôle de pureté et caractérisation
4.1. Indice de réfraction
• Déterminer l'indice de réfraction de la cyclohexanone brute recueillie; noter la température T.
• Effectuer la correction de température pour donner l’indice à 20 °C grâce à la relation :
n
20
= n
T
+ 0,00045 (T - 20), T en °C.
4.2. Caractérisation
Dans un tube à esais, verser environ 2 mL de solution de 2,4-DNPH (2,4-
dinitrophénylhydrazine) ; ajouter cinq gouttes de la cyclohexanone préparée. Attendre quelques
minutes, fltrer le solide sur büchner (rincer le tube à essais avec un peu d’éthanol froid).
Recristalliser dans l’éthanol.
Sécher les cristaux purifiés et mesurer leur température de fusion.

Sujet 34 3/5
III. Compte rendu
Compléter la feuille de résultats donnée en page 5/5.
1. Écrire l’équation de la réaction d’oxydation du cyclohexanol, ainsi que les demi-équations
électroniques correspondantes ; on utilisera le couple Cr
2
O
72-
/ Cr
3+
.
2. Calculer les quantités de matière de chaque réactif et en déduire le réactif limitant sachant
qu’une mole de dichromate de sodium réagit avec trois moles de cylohexanol. Déterminer alors
la masse théorique de cyclohexanone attendue.
3. Calculer le rendement de la préparation après en avoir rappelé l’expression littérale.
4. Préciser la composition du milieu réactionnel à la fin de la réaction d’oxydation.
5. Décrire la technique utilisée pour identifier la phase organique lors de la décantation.
6. Préciser quels sont les paramètres qui permettent de supposer que l'hydrodistillation est bien
terminée.
7. Indiquer le nom de l'opération effectuée lors de l'ajout de chlorure de sodium à la phase
aqueuse et expliquer son principe.
8. Indiquer les propriétés que doit posséder un solvant de recristallisation.
9. Identifier le spectre IR du cyclohexanol et celui de la cyclohexanone (cf. spectres page 4/5)
en donnant dans chaque cas les bandes caractéristiques des vibrations de valence des
groupements fonctionnels. La cyclohexanone est-elle pure ? Justifier.

Sujet 34 4/5
SPECTRES IR DU CYCLOHEXANOL ET DE LA CYCLOHEXANONE, À IDENTIFIER.
Spectres obtenus à partir de : http://riodb01.ibase.aist.go.jp/sdbs/cgi-bin/direct_frame_top.cgi
SPECTRE A
Nombre d'onde, cm
-
1
Nombre d'onde, cm
-
1
SPECTRE B

Sujet 34 5/5
NOM : Prénom :
FEUILLE DE RESULTATS
• Volumes V
1
et V
2
des phases organiques et aqueuses.
V
1
(phase
aqueuse) =
V
2
(phase
organique) =
• Indice de réfraction.
n
t
= à la température T =
Indice de réfraction corrigé, à 20 °C : n
20
=
•
T
f
pour le dérivé caractéristique :
• Masse de cyclohexanone
m =
• Calcul du rendement
Présenter le produit à l’examinateur.
1
/
5
100%