L Quand la prostate devient neuroendocrine

échec et mat
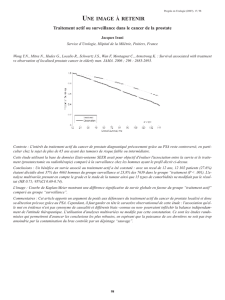
Figure 3. Contingent neuroendocrine exprimant le CD56 (mem-
branaire) [× 400].
Figure 1. Contingent neuroendocrine : nappes de petites cellules
(HES, × 50).
Figure 2. Contingent neuroendocrine : cellules au rapport nucléo-
cytoplasmique élevé et au noyau à chromatique délavée (HES, × 200).
Correspondances en Onco-Urologie - Vol. II - no 4 - octobre-novembre-décembre 2011
187187
Quand la prostate devient
neuroendocrine
P. Camparo*
* Service d’anatomo-
pathologie, hôpital Foch,
Suresnes.
L
es carcinomes neuroendocrines constituent des
formes histologiques agressives de cancers de la
prostate. Le cas présenté ici illustre les particu-
larités cliniques de ces formes anatomopathologiques
rares.
Observation
M. C., âgé en 2007 de 73 ans, est suivi pour un adéno-
carcinome prostatique présentant un score de Gleason
de 5 + 4. Dans ses antécédents, on note essentiellement
une dyslipidémie et une cardiopathie ischémique avec
pontage coronarien. L’adénocarcinome prostatique a été
découvert 4 ans plus tôt devant un taux de PSA de 40.
Le traitement initial a associé divers traitements anti-
androgéniques qui ont permis d’abaisser et de maintenir
le taux de PSA à 0,1 ng/ml.
Le patient consulte en avril 2007 pour des douleurs
pelviennes associées à des symptômes de type réten-
tionnel. Le toucher rectal montre une prostate dont
le volume est estimé à 300 g. Le taux de PSA reste
faible. Le scanner objective plusieurs lésions lytiques.
Sur les copeaux de résection endoscopique qui sont
alors réalisés, l’analyse histologique met en évidence
une population de cellules de petite taille au noyau
hyperchromatique, au cytoplasme réduit, basophile
(fi gures 1 et 2). L’analyse immunohistochimique montre
une expression membranaire forte et spécifi que de
synaptophysine et de CD56 (figure 3). Le dosage
sérique de l’énolase neurospécifi que (NSE [Neuron-
Specifi c Enolase]) confi rme la présence d’un contingent
neuroendocrine. Une chimiothérapie de type étopo-
side + carboplatine est entreprise.
Un an plus tard (en mars 2008), un nouveau scanner
montre une récidive pelvienne majeure avec augmenta-
tion du nombre de métastases osseuses, notamment au
niveau de l’aile iliaque droite, responsables de douleurs
invalidantes du membre inférieur droit.
Une chute survenue 2 mois plus tard, ayant entraîné
une fracture du toit du cotyle, sera responsable d’une
hospitalisation en urgence au cours de laquelle sera
mise en évidence une insuffisance rénale (créati-
nine à 240 mmol/l) d’aggravation rapide (créatinine
à 500 mmol/l le lendemain). Le patient décèdera le
surlendemain de son admission.
COU-12 + pubs.indd 187COU-12 + pubs.indd 187 13/12/11 15:5913/12/11 15:59

échec et mat
Correspondances en Onco-Urologie - Vol. II - no 4 - octobre-novembre-décembre 2011
188188
Discussion
Les cellules neuroendocrines prostatiques dérivent de
précurseurs communs aux cellules basales et sécré-
trices. Certaines conditions microenvironnementales,
comme une déplétion androgénique ou une irradiation,
sont capables d’induire une transdiff érenciation des
cellules basales ou sécrétantes en cellules neuroendo-
crines. Cette population neuroendocrine peut alors se
manifester sous la forme d’éléments isolés au sein d’un
adénocarcinome prostatique ou, plus rarement, sous
la forme de tumeurs neuroendocrines, semblables à
celles habituellement observées dans le tube digestif
ou les poumons (1, 2).
La présence d’éléments neuroendocrines isolés au
cours d’un traitement antiandrogène semble faci-
liter la progression tumorale des cellules exocrines.
Les cellules neuroendocrines n’expriment pas le PSA
et ne possèdent pas de récepteurs aux androgènes.
Elles ne sont donc pas aff ectées par les thérapies anti-
androgéniques. En revanche, elles se caractérisent par
une activité sécrétoire (chromogranines A, B, C, NSE
et synaptophysine) que l’on peut mettre en évidence
par immunohistochimie (anticorps antichromo-
granine, antisynaptophysine, anti-NSE [anti-Neuron
Specifi c Enolase] ou anti-CD56) ou par dosage sérique
(chromogranine A). Ces cellules neuroendocrines
produisent des peptides, des hormones et des facteurs
de croissance capables de stimuler la croissance des
cellules à leur voisinage (chromogranine A, PTHrp
[ParaThyroid Hormone-related protein], bombésine),
inhiber l’apoptose (survivine) et stimuler la néo-angio-
genèse (VEGF). La diff érenciation neuroendocrine est
un phénomène dynamique. Elle augmente au cours
du traitement antiandrogénique ainsi que durant la
phase hormono résistante de la maladie prostatique
où des taux sériques élevés de chromogranine A (ou
un immunomarquage positif à la chromogranine supé-
rieur à 1 %) sont fréquemment observés et corrélés au
pronostic de la maladie prostatique (3-5).
Une série récente rapporte 95 cas de patients
présentant un cancer de la prostate avec un contin-
gent neuroendocrine majoritaire ou exclusif (6). Le
diagnostic de tumeur neuroendocrine a pu être
posé sur biopsies (55 cas : 58 %), résections transu-
réthrales (27 cas : 28 %), prostatectomies radicales
(4 cas : 4 %) ou biopsies de localisation métastatique
(9 cas : 10 %). L’âge des patients était en moyenne de
69 ans (44 à 92 ans). Bien que le taux de PSA ait pu
être élevé chez certains patients, il était le plus souvent
faible (moyenne : 4,0 ng/ml, extrêmes : 0,2-1 893 ng/
ml). Chez les patients pour lesquels des informations
cliniques étaient disponibles, on notait des antécé-
dents d’adénocarcinome prostatique dans seulement
42 % des cas. Le diagnostic de carcinome neuroen-
docrine était posé en moyenne 25 mois après celui
d’adénocarcinome prostatique (extrêmes : 1-300 mois).
Les formes pures de carcinomes neuroendocrines à
petites cellules étaient majoritaires (57 % des cas).
Dans les formes à prédominance neuroendocrine
(plus de 80 % de cellules neuroendocrines) le grade
de l’adénocarcinome prostatique était supérieur ou
égal à 8 dans 85 % des cas.
Dans cette série, 88 % des cas étaient positifs pour au
moins 1 des marqueurs neuroendocrines classiques
(chromogranine, synaptophysine ou CD56), et 52,3 %
étaient positifs pour le TTF1 (Thyroïd Transcription
Factor 1). Quelques cellules neuroendocrines expri-
maient le PSA, le P501S ou le PSAM (prostate-specifi c
membrane antigen) dans respectivement 19 %, 28 %
et 25 % des cas.
Les taux sériques de chromogranine A sont généra-
lement augmentés dans ces tumeurs et corrélés aux
marquages tissulaires (7), mais d’autres méthodes
ont été proposées pour améliorer la recherche de
la présence de contingents neuroendocrines, en
particulier dans le suivi évolutif d’adénocarcinomes
classiques (8).
Dans le cas de tumeurs neuroendocrines pures ou
majoritairement neuroendocrines, comme chez notre
patient, les manifestations cliniques sont peu spéci-
fi ques. Elles ne s’associent pas, ou de façon inhabituelle,
à l’inverse de ce qui peut être observé dans des loca-
lisations digestives ou bronchiques, à des syndromes
paranéoplasiques associés à une sécrétion hormonale
aberrante (2). L’évolution vers les localisations métasta-
tiques osseuses ou viscérales est rapide (9).
L’hormonorésistance impose la mise en route d’un
traitement chimiothérapique spécifi que (cisplatine
ou étoposide). Aucun traitement n’a cependant fait
preuve de son effi cacité, et le pronostic reste sévère.
Dans une série de 30 patients présentant une tumeur
neuro endocrine de la prostate, seuls 5 (17 %) ont
présenté, après un traitement par radio- et chimio-
thérapie (cisplatine), une rémission complète qui n’a
pas dépassé en moyenne 21 mois (6-54). Tous les autres
patients sont décédés rapidement, entre 17 mois (9) et
42 mois (1, 10). Dans cette dernière étude, les auteurs
concluent à l’ineffi cacité des protocoles thérapeutiques
actuellement proposés. ■
1. Stein ME, Bernstein Z,
Abacioglu U et al. Small cell
(neuroendocrine) carcinoma of
the prostate: etiology, diagnosis,
prognosis, and therapeutic impli-
cations − a retrospective study of
30 patients from the rare cancer
network. Am J Med Sci 2008;
336(6):478-88.
2. Oesterling JE, Hauzeur CG,
Farrow GM. Small cell anaplastic
carcinoma of the prostate:
a clinical, pathological and
immunohistological study of
27 patients. J Urol 1992;147(3
Pt 2):804-7.
3. Mosca A, Berruti A, Russo L,
Torta M, Dogliotti L. The neuroen-
docrine phenotype in prostate
cancer: basic and clinical aspects.
J Endocrinol Invest 2005;28(11
Suppl. international):141-5.
4. Heinrich E, Trojan L, Friedrich D
et al. Neuroendocrine tumor cells
in prostate cancer: evaluation
of the neurosecretory products
serotonin, bombesin, and gastrin
− impact on angiogenesis and
clinical follow-up. Prostate 2011;
71(16):1752-8.
5. Krauss DJ, Hayek S, Amin M
et al. Prognostic signifi cance of
neuroendocrine diff erentiation
in patients with Gleason score
8-10 prostate cancer treated with
primary radiotherapy. Int J Radiat
Oncol Biol Phys 2011;81(3):e119-
25.
6. Wang W, Epstein JI. Small
cell carcinoma of the prostate.
A morphologic and immuno-
histochemical study of 95 cases.
Am J Surg Pathol 2008;32(1):65-71.
7.
Sciarra A, Cardi A, Dattilo C,
Mariotti G, Di Monaco F,
Di Silverio F. New perspective in
the management of neuroendo-
crine diff erentiation in prostate
adenocarcinoma. Int J Clin Pract
2006;60(4):462-70.
8. Sciarra A, Innocenzi M, Rava-
ziol M et al. Current diagnostic
procedure on neuro endocrine
diff erentiation of prostate cancer.
Urologia 2011;78(2):132-6.
9. Têtu B, Ro JY, Ayala AG,
Johnson DE, Logothetis CJ,
Ordonez NG. Small cell carcinoma
of the prostate. Part I. A clinicopa-
thologic study of 20 cases. Cancer
1987;59(10):1803-9.
10. Rubenstein JH, Katin MJ,
Mangano MM et al. Small cell
anaplastic carcinoma of the
prostate: seven new cases, review
of the literature, and discussion
of a therapeutic strategy. Am J
Clin Oncol 1997;20(4):376-80.
Références
COU-12 + pubs.indd 188COU-12 + pubs.indd 188 13/12/11 15:5913/12/11 15:59
1
/
2
100%