L Thérapie génique des maladies métaboliques D

L
e but de la thérapie génique des maladies dites méta-
boliques est de modifier ou de corriger leur phénotype
par l’introduction ou la correction d’un gène manquant
ou mutant. La plupart des maladies métaboliques sont liées à
l’absence – ou à la synthèse anormale – d’une protéine habituel-
lement produite par le foie. Les conséquences peuvent être hépa-
tiques comme dans la maladie de Wilson, ou systémiques comme
dans l’hémophilie. Elles sont le plus souvent congénitales et, dans
la mesure où le gène responsable a été cloné et séquencé, il est
envisageable de tenter d’introduire le gène normal dans les hépa-
tocytes ou d’autres cellules pour modifier le cours de la maladie.
Selon la nature de la maladie à corriger, la transduction d’un faible
nombre d’hépatocytes (5 à 10 %) pourrait modifier le phénotype
global. Le problème majeur de la thérapie génique des maladies
métaboliques est l’efficacité du transfert du gène lui-même.
Jusqu’à ce jour, aucune méthode n’a permis un transfert de gène
efficace et une expression prolongée du transgène.
LES AFFECTIONS CANDIDATES
Les maladies métaboliques candidates à ce type de traitement
sont nombreuses et le tableau I en montre quelques exemples.
Leur définition initiale correspondait aux déficits enzymatiques
essentiellement hépatiques. Elles répondent aujourd’hui à
l’ensemble des maladies génétiques par déficit monogénique (1).
Toutefois, nombreuses d’entre elles correspondent à une patho-
logie hépatique même si leur expression peut être systémique ou
associée à l’atteinte de plusieurs organes. Certaines entraînent
une pathologie hépatique propre comme la maladie de Wilson ou
le déficit en α1-antitrypsine, tandis que pour d’autres comme le
syndrome de Crigler-Najjar ou l’hypercholestérolémie familiale,
le foie est macroscopiquement et histologiquement normal.
LES MÉTHODES DE THÉRAPIE GÉNIQUE
Idéalement, la thérapie génique des maladies métaboliques doit
utiliser des vecteurs devant répondre à certains critères. Ainsi ces
vecteurs doivent être non immunogènes, non toxiques, produc-
tibles en grandes quantités, capables d’intégrer le transgène dans
le génome de la cellule hôte, permettant une expression à long
terme. De plus, l’une des conditions nécessaires à l’innocuité de
la thérapie génique est la sélectivité du transfert du gène qui ne
doit intéresser que la seule population cellulaire à corriger. Il est
entre autres indispensable d’éviter toute diffusion des vecteurs
vers les cellules gonadiques.
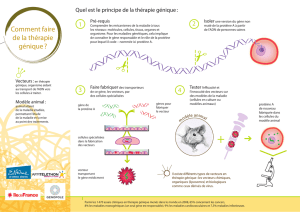
Trois principales stratégies de thérapie génique sont à distinguer
(2). La première, le transfert ex situ, consiste à prélever des cel-
lules du malade (hépatocytes par exemple), à leur transférer un
gène in vitro, et à réinjecter ces cellules dans leur site d’origine.
La deuxième méthode, le transfert in situ, consiste à injecter les
vecteurs directement dans le tissu ou l’organe à modifier géné-
tiquement. Pour le foie, il peut s’agir d’une injection dans la
veine porte, l’artère hépatique ou les voies biliaires intra-
DOSSIER THÉMATIQUE
Thérapie génique des maladies métaboliques
●O. Soubrane*
321
La Lettre de l’hépato-gastroentérologue - no6 - vol. III - novembre-décembre 2000
* Service de chirurgie, hôpital Cochin, Paris.
Maladies métaboliques avec foie normal
Syndrome de Crigler-Najjar de type I
Hypercholestérolémie familiale de type IIa
Phénylcétonurie
Déficit en OCT
Maladies métaboliques avec foie pathologique
Maladie de Wilson
Tyrosinémie
Mucoviscidose
Déficit en α1-antitrypsine
Maladies métaboliques à conséquences systémiques
Hémophilies
Oxalose de type I
Porphyrie aiguë intermittente
Déficit en antithrombine III
Déficit en protéine C
Tableau I. Exemples de maladies métaboliques candidates à
la thérapie génique.
HEPATO-GASTRO 6 27/08/02 16:58 Page 321

322
La lettre de l’hépato-gastroentérologue - no6 - vol. III - novembre-décembre 2000
DOSSIER THÉMATIQUE
hépatiques. La troisième méthode, dite in
vivo, consiste à injecter les vecteurs dans la
circulation systémique. Cette méthode n’est
concevable qu’avec des vecteurs ayant un
tropisme sélectif pour une population cel-
lulaire donnée.
VECTEURS CLASSIQUES
Actuellement, les vecteurs les plus utilisés
sont de nature virale. En effet, les virus pos-
sèdent les capacités génétiques d’infecter des
cellules hôtes. Toutefois, les défenses immu-
nitaires naturellement acquises au long de
l’évolution chez l’homme font obstacle au
transfert de gène par des vecteurs viraux. Les
principaux vecteurs classiques de transfert
de gène sont représentés dans le tableau II.
Les vecteurs viraux utilisés sont dits défec-
tifs car leurs gènes naturels ont été éliminés
les rendant incapables de réplication.
●Les rétrovirus sont dérivés du virus de la leucémie murine de
Moloney (3, 4). Ils contiennent un génome sous forme d’ARN
qui est converti en ADN dans la cellule infectée. Ces vecteurs ne
peuvent transporter qu’un insert de petite taille (7 kb) et ne peu-
vent être produits qu’à des titres relativement faibles (108). Ils
permettent l’intégration du transgène dans le génome cellulaire
permettant une expression durable et transmissible. Toutefois, ils
ne peuvent transfecter les cellules habituellement quiescentes
comme les hépatocytes, les cellules musculaires ou les neurones,
et il s’agit de leur principal inconvénient. Il est donc nécessaire
d’induire la mitose des cellules cibles, par exemple par culture
des cellules in vitro. En ce qui concerne le foie, il est facile
d’induire expérimentalement une régénération, par exemple par
une hépatectomie partielle ou par l’injection d’un produit hépato-
toxique. Injectés dans un foie en régénération, les rétrovirus peu-
vent transfecter plus de 50 % des hépatocytes (5). Enfin l’inté-
gration du transgène se faisant de manière complètement aléatoire,
il existe un risque théorique de mutagenèse insertionnelle, même
si ce phènomène n’a jamais été observé chez l’animal.
●Les caractéristiques de l’adénovirus sont très différentes : il
s’agit de virus à ADN qui peuvent véhiculer un transgène de
grande taille (jusqu’à 35 kb), être produits à des titres élevés (1012)
de façon industrielle (2, 3). Leur efficacité est excellente tant in
vitro qu’in vivo puisqu’après injection systémique d’adénovirus,
quasiment tous les hépatocytes sont transfectés. En revanche, le
transgène reste épisomal, c’est-à-dire dans le compartiment extra-
chromosomique du noyau, ce qui rend transitoire son expression
(10 à 40 jours). Les adénovirus contiennent une douzaine de gènes
dont le gène E1 est essentiel à la réplication virale. La soustrac-
tion de ce gène E1 rend les adénovirus incapables de réplication
et permet d’insérer à sa place un gène thérapeutique ainsi qu’un
élément promoteur. L’inconvénient majeur de ce vecteur est sa
toxicité cellulaire qui n’a pu être complètement éliminée, ainsi
que le déclenchement d’une réaction immunitaire humorale qui
rend les réinjections inefficaces.
●Les liposomes cationiques ont des avantages théoriques
notables : non toxiques, ayant une sécurité biologique, ils peu-
vent transporter des gènes de très grande taille. De plus, les com-
plexes ADN-lipides sont faciles à préparer industriellement. Du
fait de l’absence de composante protéique, ces vecteurs sont
moins immunogènes. Si les complexes ADN-liposomes catio-
niques sont efficaces in vitro, ils ne peuvent transfecter des cel-
lules après injection systémique. De plus, l’expression du trans-
gène est très transitoire. Leur utilisation future est donc
conditionnée par des progrès dans le ciblage du transfert de gène
et l’efficacité d’expression du transgène (6).
NOUVEAUX VECTEURS
Compte tenu de la faible efficacité des vecteurs classiques et de
leurs risques potentiels, de nouveaux vecteurs ont fait l’objet de
recherches actives. D’autres virus ont ainsi été identifiés comme
candidats à leur utilisation en thérapie génique.
●AAV : les virus associés à l’adénovirus ou AAV sont des par-
ticules à ADN, non pathogènes, incapables de réplication en
l’absence d’un autre virus comme l’adénovirus. Ils peuvent
infecter de nombreux types cellulaires comme les hépatocytes,
les neurones, les cellules musculaires, et incorporent leur ADN
dans le chromosome 19 chez l’homme. Leur principal incon-
vénient est la petite taille de l’insert qu’ils peuvent contenir.
Leur production à grande échelle n’est pas encore standardisée.
Des résultats prometteurs ont été obtenus dans le traitement de
souris et chiens hémophiles chez lesquels on parvient à la cor-
rection du trouble hémorragique après transfert du gène du fac-
teur IX dans le foie par un AAV (7). Plus récemment, une étude
clinique a permis de démontrer l’innocuité du transfert du gène
du facteur IX dans le muscle par AAV, chez des patients hémo-
philes (8). L’efficacité sur le syndrome hémorragique reste
encore à confirmer.
Vecteur Avantages Inconvénients
Rétrovirus – Intégration à l’ADN – Intégration aléatoire
chromosomique – Nécessite la division de
– Sécurité d’emploi : pas de la cellule hôte
réaction immune – Titres faibles
– Expression prolongée
Adénovirus – Titres très élevés – Toxicité
– Transferts dans les cellules – Réponse immune
quiescentes – Expression transitoire
– Exposition préalable
Liposomes – Vecteur non viral : – Efficacité très faible
sécurité biologique – Expression transitoire
– Pas de reconnaissance – Pas de ciblage tissulaire
immunitaire
Tableau II. Principaux vecteurs classiques de transfert de gènes.
HEPATO-GASTRO 6 27/08/02 16:58 Page 322

●Les lentivirus : dérivés du virus de l’immuno-déficience
humaine et appartenant à la famille des rétrovirus, les lentivirus
sont susceptibles d’infecter les cellules en division ainsi que cer-
taines cellules quiescentes comme les neurones, les cellules hémato-
poïétiques ou les cellules rétiniennes. En revanche, elles infec-
tent dans des proportions très modestes les hépatocytes et les
cellules musculaires quiescents (9). Ces vecteurs permettent une
expression prolongée du transgène de plus de 6 mois chez le ron-
geur. Ils ne semblent pas induire de réaction immune spécifique.
La taille de l’insert est assez faible (7 kb) et leur production ne
peut encore se faire à grande échelle. Le transfert des gènes des
facteurs VIII et IX humains par des lentivirus a permis d’obte-
nir, chez la souris, des taux efficaces de facteurs VIII et IX cir-
culants (10).
LES ESSAIS CLINIQUES ET LEURS ASPECTS ÉTHIQUES
À ce jour, plus de 400 essais cliniques de thérapie génique (dont
300 aux États-Unis) ont été réalisés ou sont en cours de déroule-
ment (source : National Institute of Health-NIH). Ils concernent
plus de 3 200 malades. Cinquante protocoles incluant environ
300 malades concernent les maladies génétiques par déficit mono-
génique. Jusqu’à une période très récente, aucun résultat signifi-
catif n’a été obtenu depuis le premier protocole qui a débuté en
1990. La plupart des essais cliniques portent sur des maladies de
pronostic grave comme le cancer ou le sida. Concernant les mala-
dies métaboliques, en particulier celles pour lesquelles existent
des traitements efficaces, les essais cliniques ont été beaucoup
moins nombreux. Malgré l’absence de résultat démontrant son
efficacité potentielle, le concept de thérapie génique restait l’objet
d’espoirs thérapeutiques, surtout dans la mesure où ses dangers
paraissaient minimes, jusqu’à la survenue d’un accident mortel.
En effet, à la fin de l’année 1999, le décès d’un jeune américain
de 18 ans était rapporté et faisait l’objet d’un débat dans la presse
spécialisée (11, 12), mais aussi au sein du grand public (13). Ce
jeune homme était atteint d’un déficit peu sévère en ornithine
transcarbamylase (OTC) et était inclus dans un essai de phase I
à l’université de Philadelphie. Au sein de cette équipe dirigée par
James Wilson, une dizaine de protocoles de thérapie génique
étaient en cours. Le but de cet essai de phase I-II était d’étudier
le transfert du gène de l’OTC par des vecteurs adénoviraux injec-
tés à titres croissants dans l’artère hépatique. Le jeune homme –
19epatient inclus dans l’essai – avait reçu le titre viral le plus
élevé (6 1011 par kilo) et est décédé très rapidement de syndrome
inflammatoire systémique et de détresse respiratoire de l’adulte.
Outre la polémique scientifique et publique déclenchée par cet
accident, une enquête sénatoriale a montré que les effets indési-
rables de ces essais de thérapie génique étaient rarement rappor-
tés à la commission ad hoc du NIH et que des conflits d’intérêt
financiers étaient présents au sein des équipes de recherche cli-
nique. Des garanties éthiques et de sécurité ont ainsi été récla-
mées par les politiques, les scientifiques et les associations de
malades (14).
CONCLUSION
Les résultats cliniques de la thérapie génique sont attendus depuis
10 ans. Un optimisme prudent renaît depuis les récents résultats
obtenus dans les déficits immunitaires sévères. En ce qui concerne
les maladies métaboliques, les essais thérapeutiques ont été peu
nombreux dans la mesure où des alternatives thérapeutiques
(régimes, médicaments, greffe...) existent. Cette réserve était
d’autant plus justifiée par la crainte de la toxicité des vecteurs
viraux employés, récemment démontrée par le décès d’un jeune
patient aux États-Unis. Néanmoins de nouveaux vecteurs, viraux
ou non, sont actuellement étudiés et, à nouveau, font de la thé-
rapie génique un espoir thérapeutique. ■
Mots clés. Thérapie génique – Foie – Virus.
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Chowdhury JR. Prospects of liver cell transplantation and liver-directed
gene therapy. Semin Liver Dis 1999 ; 19 : 1-6.
2. Anderson F. Human gene therapy. Nature 1998 ; 392 : 25-8.
3. Verma IM, Somia N. Gene therapy – promises, problems and prospects.
Nature 1997 ; 389 : 239-42.
4. Kalpana GV. Retroviral vectors for liver-directed gene therapy. Semin
Liver Dis 1999 ; 19 : 27-37.
5. De Godoy JL, Malafosse R, Fabre M et al. In vivo hepatic retroviral gene
transfer through the rat biliary tract. Hum Gene Ther 1999 ; 10 : 249-57.
6. Kay M, Liu D, Hoogerbrugge PM. Gene therapy. Proc Natl Acad Sci USA
1997 ; 94 : 12744-6.
7. Snyder RO, Miao C, Meuse L et al. Correction of hemophilia B in canine
and murine models using recombinant adeno-associated viral vectors. Nat
Med 1999 ; 5 : 64-70.
8. Kay MA, Manno CS, Ragni MV et al. Evidence for gene transfer and
expression of factor IX in hemophilia B patients treated with an AAV vector.
Nat Genet 2000 ; 24 : 257-61.
9. Miyoshi H, Takahashi M, Gage FH, Verma IM. Stable and efficient gene
transfer into the retina using an HIV-based lentiviral vector. Proc Natl Acad
Sci USA 1997 ; 94 : 10319-23.
10. Park F, Ohashi K, Kay MA. Therapeutic levels of human factor VIII and
IX using HIV-1-based lentiviral vectors in mouse liver. Blood 2000 ; 96 :
1173-6.
11. Wadman M. NIH under fire over gene-therapy trials... Nature 2000 ; 403 :
237.
12. Hollon T. Gene therapy investigations proliferate. Nature Med 2000 ; 6 :
235.
13. Weiss R, Nelson D. Teen dies undergoing gene therapy. Washington Post,
29 septembre 1999.
14. Friedmann T. Principles for human gene therapy studies. Science 2000;
287 : 2163-5.
323
La lettre de l’hépato-gastroentérologue - no6 - vol. III - novembre-décembre 2000
HEPATO-GASTRO 6 27/08/02 16:58 Page 323

L
a thérapie génique offre des perspectives
larges d’application à peu près à tous les sec-
teurs de la médecine. Cependant, les diffi-
cultés de mise au point sont à la hauteur des
espérances… Il faut en effet obtenir l’expres-
sion du bon gène dans le bon tissu au bon
moment, que cette expression ne soit ni trop
importante (toxicité possible), ni insuffi-
sante. Il faut essayer de limiter les éventuelles
réponses immunitaires contre le vecteur ou
le produit du transgène… Bref, les obstacles
sont nombreux et beaucoup d’entre eux sont
bien loin d’avoir été franchis.
De multiples compétences sont nécessaires
pour la mise au point de thérapie génique,
en génétique, biologie moléculaire, virolo-
gie et son dérivé la vectorologie, en chimie,
en immunologie et, bien sûr, en médecine.
Ce caractère pluridisciplinaire, en soi pas-
sionnant, est aussi un élément d’explication
du fait que les succès sont longs à venir.
Beaucoup d’équipes ont sans doute sous-
estimé l’ampleur de la tâche et la nécessité
de rassembler les compétences nécessaires.
Néanmoins, des progrès notables, et parfois
relativement inaperçus, ont été obtenus au
cours de ces dernières années, par exemple
dans le domaine du transfert de gènes dans
les cellules souches hématopoïétiques. On
peut citer successivement au début des
années 1980 la mise au point de vecteurs
rétroviraux d’origine murine susceptibles de
transduire des cellules souches hémato-
poïétiques murines ; la démonstration au
début des années 90 de cette efficacité in
vivo ; la démonstration que ces mêmes vec-
teurs pouvaient efficacement transduire des
précurseurs hématopoïétiques humains
(mais pas des cellules souches hématopoïé-
tiques) ; l’amélioration notable des vecteurs
(production de titres plus élevés, pseudo-
typage à l’aide d’enveloppes virales) ; amé-
lioration significative des conditions de cul-
ture permettant l’infection des précurseurs
hématopoïétiques (utilisation de cytokines,
de fragments de fribronectine) ; plus récem-
ment, mise au point de vecteurs lentiviraux
permettant l’infection de cellules souches
hématopoïétiques humaines dont cependant
l’utilisation en clinique ne peut encore être
envisagée pour l’instant ; enfin premier
résultat chez la souris à l’aide de tels vec-
teurs lentiviraux permettant l’expression
restreinte à une lignée cellulaire donnée
(globules rouges, de la bêtaglobine). Ce tour
de force représente une étape significative
vers la mise en point d’une thérapie génique
de la bêtathalassémie.
En tirant profit d’une série de progrès énu-
mérés ci-dessus, nous avons élaboré une
thérapie génique d’une maladie héréditaire
rare qui est le déficit immunitaire combiné
sévère lié à l’X. Il s’agit d’une maladie
caractérisée par un défaut complet de déve-
loppement des lymphocytes T et NK, consé-
quence de mutation d’un gène qui code pour
la protéine Boc, qui est un élément des
récepteurs des cytokines interleukines 2, 4,
7, 9 et 15. Une série d’éléments nous ont
permis de considérer cette maladie comme
un modèle idéal pour la thérapie génique.
En effet, l’expression de la protéine Boc per-
met l’induction de signaux de survie et de
prolifération cellulaire des précurseurs lym-
phoïdes susceptibles de conférer un avan-
tage sélectif extrêmement puissant aux cel-
lules transduites, même si celles-ci ne sont
pas nombreuses. Cette notion associée à la
durée de vie extrêmement longue des lym-
phocytes T laisse supposer qu’un transfert
du gène Boc ex vivo dans les précurseurs
hématopoïétiques de tels patients est sus-
ceptible de corriger le déficit immunitaire
pour un certain nombre d’années. Fondé sur
cette hypothèse et sur une série de travaux
précliniques effectués in vitro et in vivo
dans un modèle murin, nous avons entrepris
un tel essai clinique en 1999. Cinq patients
ont ainsi été traités. Le principe du traite-
ment consiste au prélèvement de moelle
osseuse, sélection des précurseurs hémato-
poïétiques exprimant le marqueur CD34, et
en leur infection ex vivo à l’aide d’un vec-
teur retroviral défectif contenant le cDNA
de gc placé sous le contrôle transcription-
nel du LTR viral. Les cellules sont trans-
duites ex vivo en présence de combinaison
de cytokines IL3, thrombopoïétine, SCF et
FLT3-L dans des poches plastiques recou-
vertes d’un fragment de fibronectine. Cette
méthode a permis d’observer chez quatre
patients une correction complète du déficit
immunitaire : génération d’un nombre nor-
mal de lymphocytes T avec un répertoire
diversifié, génération in vivo de réponses
immunes spécifiques d’antigènes T et B. Le
recul aujourd’hui est de 18 mois pour le pre-
mier patient traité (deux patients
aujourd’hui ont dépassé un an). L’effet
observé jusqu’ici est stable. Ces résultats
valident l’hypothèse d’un avantage sélectif
conféré aux cellules transduites.
Naturellement, ces résultats induisent une
série de questions : quelle sera la durée de
l’effet ? Cela dépend de la nature des cel-
lules transduites les plus précoces dans le
schéma de différenciation hématopoïétique.
Il est impossible de répondre à cette ques-
tion aujourd’hui, tout au plus, peut-on men-
tionner le fait que, pour les patients les plus
âgés, il semble qu’une thymopoïèse se pour-
suive, donc qu’il existe toujours des précur-
seurs de lymphocytes, dans la mesure où ces
patients ont un thymus largement visible et
que la majorité des lymphocytes T circulant
sont de phénotype naïf. Bien sûr, une sur-
veillance régulière des patients sera le seul
moyen de répondre précisément à cette ques-
tion. La seconde et importante question est
de savoir à quelle autre maladie peut-on
envisager d’appliquer cette méthode théra-
peutique. Il nous semble que pour les patho-
logies héréditaires du système immunitaire,
dans lesquelles un avantage sélectif peut éga-
lement être conféré, cette méthode pourrait
être efficace. Il en est ainsi de certaines autres
formes de déficits immunitaires combinés
sévères ou de déficit partiel de développe-
ment des lymphocytes T, ainsi que peut-être
du syndrome de Wiskott-Aldrich. Les pro-
grès en vectorologie, et notamment l’avène-
ment des lentivirus, s’il est démontré qu’ils
puissent être utilisés sans danger, permet-
traient d’élargir considérablement l’applica-
tion de la thérapie génique aux maladies san-
guines, qu’il s’agisse des maladies
héréditaires ou de maladies acquises.
Alain Fischer,
Inserm U429 ,
Hôpital Necker-enfants malades, Paris.
324
La lettre de l’hépato-gastroentérologue - no6 - vol. III - novembre-décembre 2000
DOSSIER THÉMATIQUE
Thérapie génique des déficits immunitaires héréditaires
HEPATO-GASTRO 6 27/08/02 16:58 Page 324
1
/
4
100%