Thérapie génique : Stratégies et vecteurs

Genie_Gen-6-ThérapieGénique.pdf
Thérapie génique : Stratégies et vecteurs
Principe : utiliser l'ADN comme médicament.
Certaines maladies sont dues à une altération du génome :
Maladies génétiques : myopathies, mucoviscidose, immunodéficience
Maladies acquises : cancers, infections
L'apport d'un gène fonctionnel peut alors rétablir la fonction déficiente
1 Présentation générale
1.1 Définition de la thérapie génique
A form of molecular medicine based on the addition of a corrected copy of a gene to the somatic
celles of an individual in order to cure or alleviate his disease.
This strategy may provide new treatments for a large number of inherited diseases in the near
future.
1.2 Pathologies concernées
–maladies monogénétiques
–maladies plurigénétiques (plus difficiles à traiter)
2 populations cellulaires cibles :
–¢ souches accessibles
–¢ entièrement différenciées, post-mitotiques à durée de vie longue
1.3 Historique
1989 : 1er transfert de gène pour le traitement de mélanome (Rosenberg)
1990 : 1er essai de thérapie génique approuvée
patiente atteinte d'immunodéficience : défaut dans le gène codant l'adénosine désaminase
(ADA).
Traitement par les cellules sanguines de la patiente préalablement transfectées avec un gène
ADA sain (Blaese, Calver, Anderson).
Juin 2007 : 1346 essais de thérapie génique en cours dans 28 pays (essais cliniques ou approuvés)
La plupart d'entre eux sont en phase 1 en majorité concernant les cancers et maladies
monogéniques.

Genie_Gen-6-ThérapieGénique.pdf
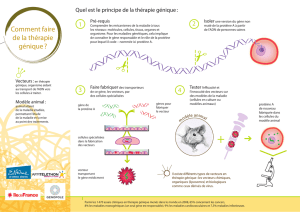
2 Méthodes pour la thérapie génique somatique
Transfert du gène dans les cellules somatiques ex vivo (le plus fréquemment))
Application pour les tissus accessibles
Inection in vivo au niveau de l'organe cible
localement : plasmide nu : gene gun
injection localement dans un tissu : vecteurs viraux recombinant
systémique : ADN empaqueté (liposome...)
2.1 Traitement in vivo de la mucoviscidose
Maladie génétique due à la mutation du gène CFTR
Utilisation d'un aérosol de particules virales recombinées pour action locale au niveau pulmonaire.
2.2 Vecteurs utilisés en thérapie génique
Adénovirus
Rétrovirus
ADN/plasmide nu
Liposome
2.2.1 Vecteurs viraux
Propriétés d'un vecteur viral idéal :
–n'induit pas de pathologie
–production facile et reproductible à haute concentration (> 108 particules virales/mL)
–expression génique à long terme par insertion dans le génome ou expression épisomique
persistante.
–Expression génique régulable
–Expression tissu-spécifique
–Immunogénicité faible
2.2.2 Adénovirus
Virus à ADN double brin linéaire de 30 à 38 kb
Structure eicosahédrique (20 faces), au moins 10 protéines différentes
Génome adénoviral code 11 protéines différentes
Gènes précoces E
Gènes tardifs L
ITR : inverted terminal repeat : importantes
L'adénovirus comme vecteur de thérapie génique
1ère génération : délétion de E1, E3 mais gènes viraux encore nombreux => réaction immunitaire
2e génération : délétion de davantage de gènes viraux mais toujours petite réaction immunitaire
gutless : suppression des différents gènes.
Pour produire des adénovirus gutless, il faut utiliser des adénovirus helper
=> problème pour la séparation des adénovirus recombinants des adénovirus helper
=> choix orienté vers des stratégies permettant de déléter le génome : utilisation de la stratégie Cre-
Lox (cf TD)
Fréquence

Genie_Gen-6-ThérapieGénique.pdf
2.2.3 Rétrovirus
Famille de virus enveloppés à ARN trouvés chez tous les vertébrés
–γ – rétrovirus : virus simples
ne sont efficaces que sur les cellules en division, pas sur les cellules quiescentes
–Lentivirus
–Spumavirus (inefficace sur les cellules quiescentes)
Réplication des virus sauvages
Vecteur dérivé de MoMLV (virus de la leucémie murine de Moloney)
Remplacement des gènes Gag, pol et env par le gène thérapeutique
Encapsidation du gène thérapeutique dans la capside et l'enveloppe virale
Production de virus recombinants dans les ¢ d'empaquetage
Vecteurs dérivés du lentivirus
Transfection possible de cellules quiescentes
Avantages et inconvénients de vecteurs viraux en thérapie génique => développement de vecteurs
non viraux pour le transfert de gènes.
3 Production à l'échelle industrielle
Titres viraux élevés
Infection de cellules quiescentes ou en division
Non intégration dans le génome de la cellule hôte
Taux d'expression élevé – idéal pour la transfection transitoire de cellules
Tropisme large mais possibilité de cibler la nature des protéines présentes sur la capside et donc de
cibler le virus
Réaction du système immunitaire quasiment absente pour les vecteurs gutless si purification
correcte
Gag Pol Env
ψ
LTR LTR
}Organisation plus complexe avec gag,
pol et env + d'autres gènes codant des
protéines virales
1
/
3
100%