Cellules T régulatrices et IL10 : ont-elles un potentiel

L’
asthme allergique, qui affecte jusqu’à 10 % de la popu-
lation des pays industrialisés, est une inflammation
chronique des voies aériennes, caractérisée par des épi-
sodes intermittents d’obstruction des voies respiratoires et de pro-
duction excessive de mucus (1). L’asthme est une maladie hété-
rogène, et malgré de nombreuses tentatives pour déterminer les
facteurs qui conduisent à la lésion du tissu pulmonaire et à la baisse
de la fonction respiratoire, son étiologie est encore largement
inconnue. La réponse inflammatoire dans l’asthme est associée à
une hyperréactivité bronchique et à une infiltration caractéristique
des éosinophiles et des lymphocytes Th dans la sous-muqueuse
bronchique. Dans ce contexte, le relargage par les éosinophiles de
protéines cationiques hautement réactives est considéré comme
important dans la pathogénie de la maladie. De plus, l’interaction
de l’allergène avec les récepteurs de haute affinité pour les IgE à
la surface des mastocytes et des basophiles aboutit au relargage
de médiateurs solubles, tels que l’histamine et les leucotriènes,
associés à l’exacerbation de la maladie.
Cellules clés du système immunitaire, les lymphocytes T, par leur
production de cytokines, jouent un rôle important dans les
réponses immunitaires normales ou pathologiques. La synthèse
de ces cytokines est restreinte et cette observation a permis d’éta-
blir une classification des lymphocytes Th CD4+ en deux sous-
populations exerçant des fonctions différentes. Ainsi, les lym-
phocytes T CD4+ de type 1 (Th1) produisent de l’IFNaprès
activation, mais ne libèrent pas d’interleukine (IL) 4, d’IL5 ou
d’IL13 ; ces cellules sont principalement impliquées dans les phé-
nomènes de défense immunitaire contre les organismes intracel-
lulaires. Par contre, les lymphocytes T de type Th2 produisent de
l’IL4, de l’IL5, de l’IL10 et de l’IL13, mais ne sécrètent pas
d’IFN. Comme l’IL4, l’IL10 et l’IL13 ont une action inhibitrice
sur la production de cytokines pro-inflammatoires, telles que
l’IL1, le TNF, l’IL6 et l’IL8, produites par les monocytes et les
macrophages activés, la sous-population lymphocytaire Th2 agi-
rait donc contre les altérations tissulaires engendrées par des réac-
tions inflammatoires des lymphocytes de type Th1. Étant donné
les activités fonctionnelles des cytokines Th1 et Th2, on s’attend
à ce que les réactions dépendantes des Th1 soient dominantes
dans les réponses immunes précoces, alors que celles de type 2
le seraient dans des réponses plus tardives (2).
Les résultats des modèles expérimentaux animaux et des études
cliniques chez l’homme ont indiqué qu’un déséquilibre local entre
les fonctions effectrices de ces deux sous-populations lympho-
citaires T serait à l’origine de la pathogénie de nombreuses mala-
dies. Ainsi, les lymphocytes Th1 seraient impliqués dans des
maladies inflammatoires comme les colites, l’encéphalite aller-
gique, ainsi que des maladies auto-immunes comme le diabète
ou la thyroïdite de Yashimoto, tandis que l’action des lympho-
cytes Th2 serait à l’origine du lupus érythémateux systémique et
des maladies allergiques, comme l’asthme.
MISE AU POINT
Cellules T régulatrices et IL10 : ont-elles un potentiel
thérapeutique pour le traitement de l’asthme ?
●
H. Yssel*
91
La Lettre du Pneumologue - Volume III - no3 - juin 2000
* INSERM U454, hôpital Arnaud-de-Villeneuve, Montpellier.
L’asthme allergique est une maladie complexe et hétérogène caractérisée par une obstruction réversible des voies aériennes,
une hyperréactivité bronchique et une infiltration des lymphocytes et des éosinophiles dans la sous-muqueuse bronchique
provoquant une inflammation chronique. Des résultats obtenus dans des modèles expérimentaux animaux et des études
cliniques chez l’homme ont démontré un rôle important des lymphocytes T auxiliaires (helper) de type 2 (Th2), produisant
l’IL4, l’IL5 et l’IL13, dans la pathogénie de cette maladie. Cependant, bien que l’IL4 et l’IL13 aient des propriétés anti-
inflammatoires, la réponse physiologique Th2 anti-inflammatoire ne semble pas être opérationnelle dans l’asthme allergique.
En outre, l’induction d’une réponse Th1 semble aggraver plutôt qu’améliorer son caractère inflammatoire. Dans cet article, le
rôle de l’IL10, une autre cytokine aux propriétés anti-inflammatoires importantes, et d’une sous-population T lymphocytaire,
productrice de cette cytokine, dans la pathogénie de l’asthme allergique ainsi que leur potentiel thérapeutique sont discutés.

CELLULES TH2 ET ASTHME
La mise en évidence de la participation des lymphocytes Th2
CD4+ chez l’homme est cependant indirecte, et c’est en grande
partie grâce à l’utilisation de modèles animaux que la contribu-
tion et l’importance des cytokines Th2 et des lymphocytes
TCD4+ dans la pathogénie de l’inflammation allergique ont pu
être démontrées (figure 1). Les résultats des modèles expéri-
mentaux animaux et des études cliniques chez l’homme ont indi-
qué que la pathologie de l’asthme serait associée à la présence
des lymphocytes Th2 et de leurs produits solubles (figure 1).
Notamment, la production de l’IL4 et de l’IL13, qui induisent la
commutation des cellules B vers la synthèse d’IgE, et celle de
l’IL5, une cytokine induisant la différenciation, la prolifération
et la protection contre l’apoptose des éosinophiles, ainsi que de
l’éotaxine, un chimioattractant des éosinophiles, indiquent que
des lymphocytes Th2 jouent un rôle important dans les réponses
retardées à travers des mécanismes différents, comme le recru-
tement des éosinophiles dans la paroi bronchique.
PARADOXE DANS L’INFLAMMATION ALLERGIQUE
Bien que toute l’information expérimentale et clinique disponible
sur la pathologie de l’asthme chez l’homme souligne l’implica-
tion critique des cytokines Th2, les connaissances actuelles de
l’action de ces cytokines constituent un paradoxe apparent.
Comme indiqué ci-dessus, les cytokines du type Th2, comme
l’IL4 et l’IL13, sont considérées comme ayant des propriétés anti-
inflammatoires. Pourtant, ces cytokines sont apparemment inca-
pables de supprimer l’inflammation caractéristique des voies res-
piratoires observée dans l’asthme allergique.
En outre, du fait de leur profil de production différent, les lym-
phocytes Th1 et Th2 forment un système “yin et yang” dans la
réponse immune, en inhibant réciproquement leur propre diffé-
renciation et leurs fonctions effectrices, et on s’attendrait donc à
ce qu’une cytokine typiquement Th1, telle que l’IFN, connu pour
contrebalancer l’activité de l’IL4 et de l’IL13, diminue la sévé-
rité de la maladie. Cependant, il a été démontré que l’administra-
tion de lymphocytes Th1 spécifiques d’un allergène et produc-
teurs d’IFNdans un modèle animal d’asthme non seulement ne
pouvait prévenir l’hyperréactivité des voies aériennes, mais au
contraire, causait une sévère augmentation de l’inflammation
bronchique (3). Il semble, par conséquent, non seulement que le
type d’inflammation observé chez les patients asthmatiques soit
différent de celui induit par les lymphocytes Th1, mais que, de
surcroît, la réponse normale anti-inflammatoire Th2 ne soit pas
opérationnelle dans ce type de maladie inflammatoire.
IL10 ET ASTHME
Il y a peu d’informations sur le rôle d’une autre cytokine Th2
aux propriétés anti-inflammatoires, l’IL10, dans la pathogénie
de l’asthme allergique. L’IL10, décrit à l’origine chez la sou-
ris comme facteur inhibiteur de la synthèse des cytokines
(CSIF), possède des effets suppressifs puissants sur la réponse
immunitaire (tableau I). L’IL10 inhibe la production des cyto-
MISE AU POINT
92
La Lettre du Pneumologue - Volume III - no3 - juin 2000
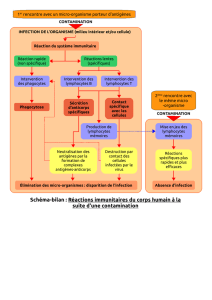
Figure 1. Sous-populations lymphocytaires T et cytokines impliquées
dans la pathogénie de l’asthme allergique. L’IL4 et l’IL13, produites
par des cellules Th2, induisent la commutation isotypique des cellules
B vers la production d’IgE en présence d’un deuxième signal médié
par l’interaction du CD40 avec son ligand CD154. Suite à l’interaction
de l’allergène spécifique avec l’IgE lié à des récepteurs de haute affi-
nité, des mastocytes sécrètent des médiateurs qui contribuent à l’hyper-
réactivité bronchique. L’IL5, facteur de croissance pour les éosino-
philes, induit aussi leur différenciation, aboutissant à leur recrutemen
et à leur activation. L’action des molécules cationiques produites par
ces cellules est responsable de l’inflammation et de l’hyperréactivité
bronchique.
Il est postulé que les cellules Tr, via leur production d’IL10, inhibent la
synthèse d’IgE et l’inflammation bronchique et qu’une partie de la
pathogénie de l’asthme allergique est due à un déséquilibre entre la pré-
sence de cellules Th2 effectrices et celle de cellules Tr.
-
-
Cellule
B
Masto-
cyte
Éosino-
phile
CPA
Cellule
Th1 Cellule
Th2
Cellule
Tr
Allergène IL4
IL13
IL3
IL5
GM-CSF
CD40
CD154
MPB
ECP
Leucotriènes
Tryptase
Leucotriènes
Autres cytokines
Initiation
et amplification
de l’inflammation
Recrutement
Activation
Inflammation
Hyperréactivité
bronchique
IL5
IL10
IL10
IgE
–
?
–
Tableau I. Propriétés fonctionnelles de l’interleukine 10 humaine.
Sources cellulaires
et production
Effets
sur les cellules T
Effets sur les monocytes
et les cellules
dendritiques
Effets sur
les cellules B
Effets sur les mastocytes
Effets sur les éosinophiles
Lymphocytes T, monocytes, kératinocytes,
cellules B transformées par le virus Epstein-Barr,
certaines lignées tumorales.
Produite tardivement après l’activation cellulaire,
consiste en une fonction atténuante de la réponse immunitaire.
Inhibe la prolifération par un effet direct
sur la production d’IL2.
Induit un état d’anergie, pendant lequel les cellules ne répondent
plus à la stimulation spécifique par l’antigène.
Inhibe l’expression membranaire des molécules du complexe
majeur d’histocompatibilité (HLA-DR), via un mécanisme
post-transcriptionnel.
Inhibe l’expression membranaire du CD54, CD80 et CD86.
Inhibe la production de l’IL1, IL6, IL8, du TNF,
ainsi que sa propre production, via une boucle autocrine.
Augmente la production de l’IL1RA, l’antagoniste naturel
de l’IL1.
Diminue la cytotoxicité des macrophages par l’inhibition
de la production de NO.
Facteur de croissance et de différenciation.
Induit la commutation isotypique vers la production d’IgA
en synergie avec le TGF.
Inhibe la commutation isotypique vers la production d’IgE.
Augmente la production d’IgG 4.
Cofacteur de croissance.
Augmente la sensibilité à l’apoptose.

kines pro-inflammatoires comme le TNF, l’IL6 et l’IL1 par
des monocytes, ainsi que sa propre production via une boucle
autocrine. En outre, elle augmente la production de l’IL1RA
par ces cellules (4). En plus de ses effets inhibiteurs sur l’expres-
sion de l’HLA-DR et de plusieurs molécules costimulatoires,
comme le CD54, le CD80 et le CD86, à la surface des cellules
présentatrices d’antigène, l’IL10 présente également des effets
anti-allergiques en inhibant l’expression du CD40 sur les éosi-
nophiles (5), provoquant leur mort cellulaire par apoptose et
constituant ainsi un mécanisme additionnel d’inhibition de
l’inflammation éosinophilique. Étant donné les fortes proprié-
tés suppressives et anti-inflammatoires de l’IL10, on pourrait
donc s’attendre à ce qu’une production diminuée de cette cyto-
kine chez les patients asthmatiques contribue à un accroisse-
ment des cytokines pro-inflammatoires, caractéristiques des
réponses inflammatoires (6). L’observation d’une production
spontanée d’IL10 dans le LBA de patients asthmatiques est plus
faible que chez les individus sains, conséquence d’une dimi-
nution de la transcription de cette cytokine (7), constitue un
argument en faveur de cette hypothèse. Cette notion a été confir-
mée dans une étude montrant que des cellules T purifiées pro-
venant d’enfants atteints d’asthme allergique et d’asthme non
allergique exprimaient des niveaux d’ARN messager pour
l’IL10 qui étaient diminués comparativement à ceux des indi-
vidus sains (8). En outre, l’implication potentielle de l’IL10
dans la pathogénie de l’asthme allergique a été mise en évi-
dence par la démonstration d’un polymorphisme du promoteur
de l’IL10 chez des patients atteints de l’asthme dû à la substi-
tution d’une base située 512 paires de bases en amont du site
d’initiation de la transcription. Cet échange de base serait asso-
cié aux taux élevés d’IgE totales sériques chez des patients
homozygotes ou hétérozygotes pour ce polymorphisme (9).
Cependant, jusqu’à présent, aucune information ne permet de
savoir si l’hyperréactivité bronchique, élément clinique et carac-
téristique de l’asthme, est aussi associée à ce polymorphisme
présent dans le promoteur de l’IL10.
Des études récentes ont indiqué un lien intéressant entre la fonc-
tion immunosuppressive de l’IL10 et l’occurrence des ma-
ladies atopiques. Il a été montré qu’une immunothérapie avec la
phospholipase A2(PLA2), administrée à des patients hypersen-
sibles au venin d’abeille, aboutissait à une production augmen-
tée de l’IL10 par les lymphocytes T spécifiques de la PLA2. En
revanche, ces cellules n’étaient plus capables de proliférer suite
à une stimulation in vitro avec cet allergène (10). Ces résultats
confirment l’observation originale de Groux et al., qui ont mon-
tré que l’IL10 est capable d’induire un état d’anergie des cel-
lules T in vitro (11). D’une façon intéressante, l’ajout de l’IL10
aux cultures de lymphocytes B purifiés des patients hyperim-
munisés à la PLA2inhibait la production d’IgE spécifique de
PLA2, mais il augmentait, en revanche, la production d’IgG 4 (10),
contribuant ainsi au succès de l’immunothérapie. Ces données
confirment une étude précédente montrant que l’IL10 est capable
de réguler la production d’IgE et d’IgG 4 d’une façon différen-
tielle (12), et l’ensemble de ces résultats indique donc que l’IL10
pourrait avoir un rôle important, par des mécanismes différents,
dans des approches du type immunothérapie.
CELLULES T RÉGULATRICES ET ASTHME
Récemment, une population particulière de lymphocytes T CD4+,
dénommés lymphocytes régulateurs type 1 (Tr1), a été décrite
chez la souris, puis chez l’homme. Ces lymphocytes T, qui pos-
sèdent un fort pouvoir suppresseur, sont caractérisés par une pro-
duction élevée d’IL10, associée à une sécrétion faible d’IL2 et à
une absence d’IL4 (13). Dans diverses études, il a été démontré
que les lymphocytes T régulateurs jouaient un rôle primordial au
niveau de la régulation des réponses immunes intestinales (revue
dans 14). Par exemple, des souris déficientes en IL10 qui n’ont
pas de telles cellules développent des colites (15). De plus, des
souris SCID, chez lesquelles une colite a été induite par des cel-
lules Th1 pathogéniques, ont pu être traitées par une injection de
lymphocytes Tr1 générés in vitro à partir de la souche de souris
sauvage (13). Il est tentant d’imaginer que l’absence de cellules
régulatrices, ou au moins une diminution de leur nombre, pour-
rait contribuer à l’inflammation dans l’asthme allergique, et, à
l’inverse, qu’une immunothérapie avec ces cellules pourrait avoir
des bénéfices thérapeutiques. Cependant, bien que les résultats
des modèles animaux utilisant des souris IL10–/–montrent une
inflammation aiguë des intestins, ces animaux ne souffrent pas
d’une inflammation bronchique, contrairement à ce qui est
attendu. En outre, des données récentes, non publiées, montrent
que des souris IL10–/–sont insensibles à l’induction d’une hyper-
réactivité bronchique, situation réversible suite à un transfert de
gène codant pour l’IL10 chez ces animaux (E. Gelfant, commu-
nication personnelle). Ce dernier résultat, encore à confirmer,
indique que l’IL10, au vu de son action pléiotrope, pourrait avoir
certains effets, encore inconnus, sur l’épithélium ou les muscles
lisses, contribuant à l’hyperréactivité bronchique. Il suffit toute-
fois de remarquer que les effets des cytokines dépendent de leurs
concentrations locales, et l’administration de l’IL10 à des doses
bien définies pourrait compenser les effets délétères.
Il est important de signaler que les faibles quantités d’IL10 dans
le LBA des patients asthmatiques ne seraient pas forcement liées
à une baisse du nombre des cellules T régulatrices, mais pour-
raient être le résultat d’une production diminuée par d’autres cel-
lules productrices de l’IL10, comme les macrophages alvéolaires
ou les lymphocytes Th2. Cet argument implique qu’il n’y aurait
pas, a priori, un rôle préférentiel des cellules Tr comme un type
cellulaire unique, producteur d’IL10. De plus, il est à exclure que
l’IL10 produite par les différents types cellulaires ait des pro-
priétés fonctionnelles différentes. Toutefois, des résultats d’études
récentes ont mis en évidence que les cellules Tr seraient dotées
de propriétés migratoires particulières, car elles sont détectées
spécifiquement dans des organes cibles en l’absence d’une acti-
vation spécifique par l’antigène, et ce n’est que suite à cette acti-
vation qu’elles suppriment l’inflammation dans l’environnement
local (H. Groux, résultats non publiés). On peut donc s’attendre
à ce que les cellules Tr aient une composition de molécules mem-
branaires impliquées dans l’adhésion et la migration différente
de celle des cellules Th2, ce qui expliquerait pourquoi l’IL10 pro-
duite par les cellules Th2 ne serait pas efficace pour supprimer
les réponses inflammatoires. À l’heure actuelle, il y a peu d’infor-
mations sur l’expression de ces molécules membranaires spéci-
93
La Lettre du Pneumologue - Volume III - no3 - juin 2000

fiques, impliquées dans la fonction des cellules Tr, et il reste
encore beaucoup à apprendre au sujet de cette sous-population
lymphocytaire particulière et de son rôle possible dans l’asthme
allergique et d’autres maladies inflammatoires.
PERSPECTIVES
Bien que l’asthme allergique soit une maladie complexe et mul-
tifactorielle, un grand nombre de résultats obtenus depuis les dix
dernières années ont démontré un rôle prépondérant pour les
lymphocytes Th2 et leurs produits solubles dans sa pathogénie.
En extrapolant les observations faites dans des modèles expéri-
mentaux de colites, on pourrait mettre en avant l’hypothèse selon
laquelle l’absence des lymphocytes Tr et, par conséquent, la pro-
duction de l’IL10 dans des sites inflammatoires contribueraient
à la réponse inflammatoire caractéristique de l’asthme allergique
(figure 1). La confirmation de cette hypothèse pourrait aboutir
à une utilisation de l’IL10 ou même des cellules Tr dans une
intervention thérapeutique. Bien que le traitement des maladies
avec des cytokines et des dérivés anticytokiniques en soit encore
à ses premiers pas, des résultats prometteurs ont été obtenus dans
la colite, dans laquelle l’absence de l’IL10 a été reliée à la patho-
génie de la maladie. En effet, un petit nombre d’études ont rap-
porté des effets cliniques bénéfiques de traitements avec de
l’IL10 effectués sur des patients souffrant de colites, comme la
maladie de Crohn (16). Il est toutefois important de noter que
les cytokines en général, et l’IL10 en particulier, ont des effets
pléiotropes et, en outre, qu’elles exercent leurs effets au niveau
local. Parmi les problèmes de la thérapie cytokinique figurent le
manque de spécificité et le risque d’effets secondaires du fait de
l’administration systémique des cytokines. Les avantages d’une
thérapie cellulaire utilisant les cellules régulatrices sont que ces
cellules agissent localement et sont dépendantes de leur fonc-
tion effectrice par une activation spécifique de l’antigène. La
caractérisation fonctionnelle des cellules régulatrices est encore
à un stade prématuré, et d’autres expériences seront nécessaires
pour déterminer où ces cellules sont activées in vivo et pour élu-
cider les mécanismes qui se trouvent à la base de leurs proprié-
tés immunosuppressives. En particulier, il est important de savoir
si ces activités sont exercées exclusivement par des molécules
immunosuppressives comme l’IL10, ou si elles sont le résultat
des interactions cellulaires entre des populations lymphocytaires
effectrices et régulatrices, directement ou via les cellules pré-
sentatrices d’antigène. Malgré les progrès de ces dernières
années, la thérapie cellulaire, utilisant des cellules cultivées
ex vivo, est encore à ses débuts, et il reste beaucoup à apprendre
sur la fonction des lymphocytes Tr avant qu’une telle approche
soit réalisable pour le traitement des maladies inflammatoires
comme l’asthme.
Remerciements :
L’auteur tient à remercier le Dr Hervé Groux pour la communi-
cation des données non publiées, le Dr Jérôme Pène pour son
aide scientifique et éditoriale, et le Pr Philippe Godard pour la
lecture critique du manuscrit.
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Global initiative for asthma. A Global strategy for asthma management and
prevention, NHLBI/WHO Workshop Report. National Institutes of Health
National Heart, Lung and Blood Institute Bethesda, MD 1995 ; 95-3659.
2. Abbas AK, Murphy KM, Sher A. Functional diversity of helper T lympho-
cytes. Nature 1996 ; 383 : 787-93.
3. Hansen G, Berry G, DeKruyff RH et al. Allergen-specific Th1 cells fail to
counterbalance Th2 cell-induced airway hyperreactivity but cause severe air-
way inflammation. J Clin Invest 1999 ; 103 : 175-83.
4. De Waal Malefijt R, Abrams J, Bennett B et al. Interleukin 10 (IL10) inhi-
bits cytokine synthesis by human monocytes : an anutoregulatory role of IL10
produced by monocytes. J Exp Med 1991 ; 174 : 1209-20.
5. Ohkawara Y, Lim KG, Xing Z et al. CD40 expression by human peripheral
blood eosinophils. J Clin Invest 1996 ; 97 : 1761-16.
6. Pretolani M, Goldman M. IL10 : a potential therapy for allergic inflamma-
tion ? Immunol Today 1997 ; 18 : 277-80.
7. Borish L, Aarons A, Rumbyrt J et al. Interleukin 10 regulation in normal
subjects and patients with asthma. J Allergy Clin Immunol 1996 ; 97 : 1288-96.
8. Koning H, Neijens HJ, Baert MR et al. T cells subsets and cytokines in
allergic and non-allergic children. II. Analysis and IL5 and IL10 mRNA
expression and protein production. Cytokine 1997 ; 9 : 427-36.
9. Hobbs K, Negri J, Klinnert M et al. Interleukin 10 and transforming growth
factor-beta promoter polymorphisms in allergies and asthma. Am J Respir Crit
Care Med 1998 ; 158 : 1958-62.
10. Akdis CA, Blesken T, Akdis M et al. Role of interleukin 10 in specific
immunotherapy. J Clin Invest 1998 ; 102 : 98-106.
11. Groux H, Bigler M, de Vries JE et al. Interleukin 10 induces a long-term
antigen-specific anergic state in human CD4+ T cells. J Exp Med 1996 ; 184 :
19-29.
12. Jeannin P, Lecoanet S., Delneste Y. et coll. IgE versus IgG 4 production
can be differentially regulated by IL10. J Immunol 1998 ; 160 : 3555-61.
13. Groux H, Bigler M, O’Garra A et al. A CD4+ T-cell subset inhibits anti-
gen-specific T cell responses and prevents colitis. Nature 1997 ; 389 : 737-42.
14. Powrie F. T cells in inflammatory bowel disease : protective and pathoge-
nic roles. Immunity 1995 ; 3 : 171-4.
15. Kuhn R, Lohler J, Rennick D et al. Interleukin 10 deficient mice develop
chronic enterocolitis. Cell 1993 ; 75 : 263-74.
16. Van Deventer SJ, Elson CO, Fedorak RN. Multiple doses of intravenous
interleukin 10 in steroid-refractory Crohn’s disease. Crohn’s Disease Study
Group. Gastroenterology 1997 ; 113 : 383-9.
MISE AU POINT
94
La Lettre du Pneumologue - Volume III - no3 - juin 2000
1
/
4
100%