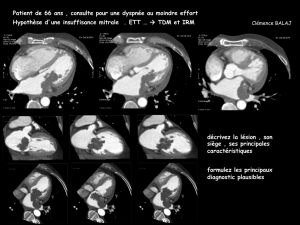
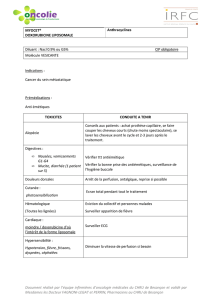
Lire l'article complet

17
La Lettre du Gynécologue - n° 297 - décembre 2004
es sarcomes utérins (SU) sont des tumeurs rares,
comprenant différents sous-types histologiques, et
représentant entre 3 et 5 % de l’ensemble des
tumeurs malignes de l’utérus (1). Ils sont de mauvais pronostic
hormis les sarcomes du stroma endométrial de bas grade, asso-
ciés à un taux important de récidives (entre 50 et 70 % selon
les séries), locales et surtout métastatiques (dans 70% des cas
environ) (1-3). Les taux de survie n’excèdent pas 30% à 5 ans
tous stades confondus et de 30 à 70% pour les stades localisés
(I et II) (1-3). Leur profil évolutif est superposable à celui des
sarcomes des tissus mous (STM), bien que de plus mauvais
pronostic. Ainsi, par extension, le traitement adjuvant est cal-
qué sur celui des STM, et beaucoup de tumeurs de stade I-II
ont un traitement chirurgical exclusif. Malgré l’évolution défa-
vorable de ces tumeurs, peu d’études prospectives randomisées
de traitement adjuvant après chirurgie des SU ont été menées
et la prise en charge optimale n’est pas clairement définie.
Les SU dérivent soit du parenchyme musculaire lisse, soit du
chorion cytogène. La classification proposée par l’OMS recon-
naît trois grands groupes histologiques avec par ordre d’inci-
dence décroissante dans la littérature : des tumeurs mixtes épi-
théliales et mésenchymateuses ; carcinosarcomes pour
l’essentiel (ou tumeurs mixtes mésenchymateuses müllé-
riennes) et exceptionnellement des adénosarcomes ; des léio-
myosarcomes (tissu musculaire lisse) ; des sarcomes stromaux
(du chorion cytogène) (< 10% des SU).
Les facteurs pronostiques des SU rapportés dans la littérature
sont le stade et l’âge (1-3). Des critères histologiques retrouvés
dans les sarcomes des tissus mous (grade de la FNCLCC sur
différenciation tumorale, nombre de mitoses et nécroses [4])
ne sont pas pronostiques dans les sarcomes utérins (2). Hormis
les sarcomes du stroma endométrial de bas grade, selon Norris
(5), le diagnostic même de sarcome utérin est un facteur de
mauvais pronostique. Le nombre de mitoses des léiomyosar-
comes (< 10, 10-20, et > 20/10 champs) et l’importance de
l’infiltration myométriale dans les carcinosarcomes sont les
facteurs histologiques pronostiques les plus souvent décrits (3).
Dans les sarcomes du stroma, le grade défini par Noris et Taylor
est le facteur pronostique le plus important (2, 5). Enfin, aucun
facteur biologique ou moléculaire n’est pronostique.
La prise en charge thérapeutique des sarcomes utérins est très
hétérogène, allant de la chirurgie seule à l’association d’une
chirurgie, radiothérapie pelvienne et curiethérapie vaginale de
complément et chimiothérapie. Il n’y a pas d’attitude concen-
suelle. Les indications sont variables en fonction des théra-
peutes, des centres, des patientes, du temps, des facteurs pro-
nostiques.
La chirurgie est le traitement de référence. Il est impératif,
d’intervenir par laparotomie, de préférence médiane, et d’évi-
ter de morceler la tumeur. Pour les carcinosarcomes, l’exten-
sion ganglionnaire pelvienne est fréquente ; il est donc recom-
mandé de réaliser un curage ganglionnaire pelvien.
Il n’y a pas d’étude randomisée publiée sur la place de la
radiothérapie adjuvante dans les sarcomes utérins. Cependant,
dans beaucoup de séries rétrospectives, la radiothérapie ne
semble pas avoir d’influence sur la survie globale, mais
semble, en revanche, augmenter le contrôle local. Elle se fait
classiquement selon les mêmes modalités que pour les adéno-
carcinomes de l’endomètre (6).
Le taux important de rechutes métastatiques précoces dans
cette pathologie est probablement lié à la présence de micro-
métastases au moment du diagnostic, et la médiane de survie
n’excède pas 1 an lorsque la maladie est métastique. Comme
pour les autres tumeurs solides à haut risque métastatique, se
pose la question de l’influence d’une chimiothérapie adjuvante
sur la survie et la survie sans récidive. En phase II, les drogues
les plus efficaces sont la doxorubicine, l’ifosfamide, le cispla-
tine et l’étoposide. Les associations les plus efficaces rappor-
tées en phase II associent doxorubicine et ifosfamide (30% de
réponses) (7), et plus récemment doxorubicine cisplatine, ifos-
famide ou cyclophosphamide, déticène et vindésine (53% de
réponses) (8), et gemcitabine plus taxotère (53% de réponses)
(9). En phase III, seules deux associations ont été testées par
rapport à l’adriamycine seule : adriamycine + cyclophospha-
mide (10) ; et adriamycine + dacarbazine (11). Aucune de ces
combinaisons n’apporte un avantage en termes de taux de
réponses. Elles ne semblent cependant pas optimales.
Une seule étude randomisée de chimiothérapie adjuvante (12)
a été menée. Elle comparait une chimiothérapie adjuvante par
doxorubicine seule versus observation chez des patientes de
stade I ou II. Sur 225 femmes incluses, seulement 156 sont
évaluables. Il n’y a pas de différence significative sur la survie
D
OSSIER
Prise en charge des sarcomes utérins
●
P. Pautier, C. Lhommé, P. Morice, C. Pomel, D. Castaigne, C. Haie-Meder, P. Duvillard*
* Comité de gynécologie, Institut Gustave-Roussy, 39, rue Camille-
Desmoulins, 94800 Villejuif.
Treatment of uterine sarcoma
L

18
La Lettre du Gynécologue - n° 297 - décembre 2004
D
OSSIER
sans récidive (41% avec adjuvant versus 53% sans adjuvant)
ni sur la survie globale (médiane de survie 74 mois avec doxo-
rubicine versus 55 mois sans chimiothérapie). L’interprétation
de ces résultats doit être prudente (grand nombre de patientes
inéligibles et/ou inévaluables, radiothérapie à la carte, pas de
stratification, choix discutable du traitement adjuvant. Enfin, il
existe une tendance en termes de survie sans récidive en faveur
de la chimiothérapie.
Compte tenu du pronostic réservé de ces tumeurs utérines par
rapport aux classiques tumeurs épithéliales, et en l’absence de
facteurs pronostiques clairement définis (à l’exception du
grade de Norris et Taylor pour les sarcomes stromaux), une
thérapeutique adjuvante plus agressive des stades localisés
peut s’envisager.
Un essai français (SARC-GYN1) de phase III randomisé étu-
diant l’effet de l’adjonction d’une chimiothérapie (adriamy-
cine, cisplatine et ifosfamide) à une radiothérapie adjuvante est
en cours. Elle doit inclure 270 patientes en 6 ans. La tâche est
difficile, compte tenu de la rareté de cette tumeur. Tous les
centres français peuvent y participer ou adresser les patientes
dans un des 31 centres investigateurs*.
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Harlow BL, Weiss NS, Lofton S. The epidemiology of sarcomas of the uterus.
J Natl Cancer Inst 1986;76:399-402.
2. Pautier P, Genestie C, Rey A et al. Analysis of clinicopathological prognostic
factors in 157 uterine sarcoma: interest of a grading score validated in soft tis-
sue sarcoma. Cancer 2000;88:1425-31.
3. Major FJ, Blessing JA, Silverberg SG et al. Prognostic factors in early-stage
uterine sarcoma. A gynecologic oncology group study. Cancer 1993;suppl
71:1702-9.
4. Coindre JM, Binh Bui N, Bonichon F et al. Histopathologic grading in
spindle cell soft tissue sarcomas. Cancer 1988;61:2305-9.
5. Norris HJ, Taylor HB. Mensenchymal tumors of the uterus. A clinical and
pathological study of 53 endometrial stromal tumors. Cancer 1966;19:755-66.
6. Knocke TH, Kucera H, Dorfler D et al. Results of postoperative radiotherapy
in the treatment of sarcoma of the corpus uteri. Cancer 1998;83:1972-9.
7. Sutton G, Blessing JA, Malfetano JH. Ifosfamide and doxorubicine in the
treatment of advanced leiomyosarcomas of the uterus: a gynecologic oncology
group study. Gynecol Oncol 1996;62:226-9.
8. Pautier P, Rey A, Genestie C et al. Chemotherapy with DECAV (cisplatinume
based regimen) in uterine sarcomas. Proceedings of the American Society of
Clinical Oncoloy (ASCO), may 1997. Abstract.
9. Hensley ML, Maki R, Venkatraman E et al. Gemcitabine and docetaxel in
patients with unresectable leiomyosarcoma: results of a phase II trial. J Clin
Oncol 2002;15,20:2824-31.
10. Muss HB, Bundy B, DiSaia PJ et al. Treatment of recurrent or advanced
uterine sarcoma: a randomized trial of doxorubicine versus doxorubicine and
cyclophosphamide (a phase III trial of the Gynecologic Oncology Group).
Cancer 1985;55:1648-53.
11. Omura GA, Major F, Blessing JA et al. A randomized study of adriamycin
with and without dimethyl triazinoimidazole carmoxamide in advanced uterine
sarcomas. Cancer 1983;52:626.
12. Omura GA, Blessing JA, Major F et al. A randomized clinical trial of adju-
vant Adriamycine in uterine sarcomas: a gynecologic oncologic group study. J
Clin Oncol 1985;3 :1240-5.
* Investigateur principal : P. Pautier. Pour renseignements, contacter Mme
Dupouy. Tél. : 01 42 11 41 20 ou 01 42 11 41 20, BIP 4900.
Nous faisons de vos spéciali
notre spécialité...
Nous faisons de vos spéciali
t
notre spécialité...
Société du groupe de presse et d'édition santé
1
/
2
100%