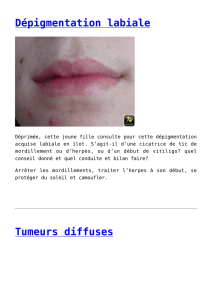
Lire l'article complet

* Hépato-gastroentérologie et oncologie digestive, CHU Ambroise-Paré, AP-HP,
Boulogne.
■Les analogues de la somatostatine sont le traitement de
choix du syndrome carcinoïde.
■En cas de forme lentement évolutive, les analogues de la
somatostatine permettent une stabilisation tumorale dans
environ la moitié des cas pendant plusieurs mois.
■Les tumeurs endocrines bien différenciées du tube digestif
sont peu chimiosensibles.
■Les tumeurs endocrines peu différenciées sont des tumeurs
agressives, chimiosensibles, mais de très mauvais pronostic.
■La place de l’interféron reste discutée.
POINTS FORTS
POINTS FORTS
Traitement médical des tumeurs endocrines digestives
Medical treatment of digestive endocrine tumours
●E. Mitry*
L
es options thérapeutiques disponibles pour le traitement
des tumeurs endocrines du tube digestif (TED) sont nom-
breuses. Le choix de la stratégie de traitement, décidé
en réunion de concertation multidisciplinaire, dépendra des carac-
téristiques de la tumeur (siège, extension, type histologique et diffé-
renciation) et de son évolutivité. Dans tous les cas, un traitement
symptomatique sera prioritaire en cas de forme fonctionnelle avec
syndrome carcinoïde. Une exérèse chirurgicale devra également
être systématiquement discutée.
Plusieurs modalités sont possibles en cas de TED localement évo-
luée ou métastatique non accessible à un traitement chirurgical.
En cas de tumeur bien différenciée non symptomatique, le premier
temps consistera le plus souvent en une simple surveillance clinique,
biologique et morphologique avec examens comparatifs à 2 ou
3mois d’intervalle. Cette analyse comparative permettra de juger
de l’évolutivité tumorale. En l’absence d’évolutivité, cette phase
de surveillance pourra être prolongée. En cas de tumeur évolutive
ou symptomatique, un traitement devra être commencé. Trois options
médicales sont discutées dans ce chapitre : analogues de la somato-
statine, chimiothérapie systémique, interféron.
ANALOGUES DE LA SOMATOSTATINE
Le développement des analogues de la somatostatine a représenté
un progrès majeur dans la prise en charge des TED (1). Récemment
ont été mises sur le marché des formes retard d’octréotide ou de
lanréotide présentant l’avantage de ne nécessiter qu’une injection
mensuelle ou bimensuelle, ce qui permet d’améliorer l’observance
thérapeutique et le confort des patients traités (2, 3).
Traitement du syndrome carcinoïde
L’intérêt des analogues de la somatostatine dans le traitement du
syndrome carcinoïde est bien établi. Leur utilisation permet une
amélioration très nette des symptômes chez 92 % des patients, avec
une rémission complète dans 40 à 60 % des cas. Le lanréotide a
une efficacité comparable à celle de l’octréotide (4). L’utilisation
de formes retard améliore la qualité de vie des patients (4). Un échap-
pement thérapeutique (tachyphylaxie) est relativement fréquent
après quelques mois de traitement et nécessite une augmentation
des doses pour maintenir l’effet symptomatique.
Efficacité antitumorale
L’action antitumorale des analogues de la somatostatine est démon-
trée in vitro mais reste discutée en situation clinique. Une stabi-
lisation tumorale est observée chez environ 30 à 50 % des patients
initialement progressifs pendant une durée médiane de 5 à 18 mois,
mais le taux de réponses objectives reste faible, de l’ordre de 5 %.
L’action antitumorale des analogues serait dose-dépendante, et une
étude récente rapporte 75 % de contrôle tumoral pendant 12 mois
après l’utilisation de fortes doses d’octréotide (5). Les tumeurs len-
tement évolutives sont plus souvent contrôlées que les tumeurs rapi-
dement progressives (6). L’utilisation des analogues de la somato-
statine expliquerait l’amélioration de survie des TED observée aux
Pays-Bas (7). Cette série épidémiologique de 2 400 patients ayant
une “tumeur carcinoïde” (bénigne ou maligne) diagnostiquée entre
1989 et 1996 rapporte un taux de survie relative à 5 ans de 93 % pour
DOSSIER THÉMATIQUE
La lettre de l’hépato-gastroentérologue - n° 3 - vol. VIII - mai-juin 2005
110

les tumeurs localisées, de 74 % en cas d’extension locorégionale et
de 19 % en cas de forme métastatique. La survie à 3 ans des tumeurs
métastatiques s’est améliorée au cours de la période d’étude, pas-
sant de 29 % à 66 %, et les auteurs suggèrent que cette améliora-
tion serait secondaire à l’utilisation, depuis 1992, des analogues de
la somatostatine.
CHIMIOTHÉRAPIE
Tu meurs bien différenciées
(tableau I)
Les essais thérapeutiques ayant évalué la chimiothérapie systé-
mique dans les TED bien différenciées sont peu nombreux, souvent
anciens et méthodologiquement critiquables.
En monochimiothérapie, le 5 fluoro-uracile (5-FU) et l’adriamy-
cine (ADR) ont donné les meilleurs résultats, avec respectivement
26 et 21 % de réponses tumorales objectives (RO). L’association
5-FU + streptozotocine (STZ), considérée comme la polychimio-
thérapie de référence dans cette indication, ne donne que 20 à
30 % de RO, avec un risque notable de toxicité rénale ou hépatique.
L’association ADR + STZ a permis d’obtenir 40 % de RO dans
un essai de phase II (8),mais semblait avoir une efficacité moindre
que l’association 5-FU + STZ dans une étude de phase III, avec une
toxicité plus importante (9). L’association étoposide-cisplatine
(VP16-CDDP) n’a pas d’efficacité dans les tumeurs carcinoïdes
bien différenciées (10).
Compte tenu de ces résultats, on considère que les TED bien dif-
férenciées sont moins chimiosensibles que les tumeurs endocrines
duodénopancréatiques, et que la chimiothérapie systémique n’est
pas un traitement de première intention.
Tumeurs peu différenciées
(tableau II)
La situation est tout à fait différente pour les TED peu différen-
ciées, qui ont des caractéristiques histologiques et immunohisto-
chimiques proches de celles des carcinomes à petites cellules
bronchiques. Ces tumeurs sont caractérisées par leur agressivité
et leur évolution souvent rapide. Elles sont le plus souvent méta-
statiques d’emblée et non accessibles à un traitement chirurgical.
L’association VP16-CDDP est considérée comme la chimiothéra-
pie
de référence dans cette situation. Le taux de RO varie selon les
séries
de 41 à 67 %, avec une survie médiane de l’ordre de 15 mois
(10, 11).
Malgré leur bonne chimiosensibilité, le pronostic des
TED peu différenciées reste mauvais, avec une survie à deux ans
inférieure à 20 %.
INTERFÉRON
L’effet antisécrétoire et symptomatique de l’interféron alpha est
bien démontré. Il permet d’obtenir une diminution des flushs dans
60 à 80 % des cas et de la diarrhée dans un peu plus de 50 % des
cas. L’effet antitumoral est moins important, avec environ 15 % de
réponses objectives et 40 % de stabilisation tumorale (12). L’effet
antitumoral de l’interféron est cependant difficile à évaluer en rai-
son du possible remplacement des cellules tumorales par une fibrose
qui empêche l’utilisation des critères morphologiques classiques
de réponse tumorale (13). Deux études randomisées, de faible puis-
sance et critiquables sur le plan méthodologique, sont en faveur d’un
avantage de survie après traitement par interféron (14, 15). Une
étude menée chez 23 patients a comparé l’interféron alpha 2 recom-
binant administré seul à l’interféron combiné à une chimiothérapie
(ADR + STZ) et n’a retrouvé aucun avantage en faveur de l’asso-
ciation, qui était plus toxique (16). L’adjonction d’interféron chez
des patients présentant un syndrome carcinoïdien résistant aux ana-
logues de la somatostatine a permis un contrôle des symptômes
dans un peu plus de la moitié des cas (17). Récemment, un essai
randomisé a comparé un traitement par lanréotide, par interféron
ou par l’association des deux sans mettre en évidence de différence
Références Protocole Nombre RO (%) Survie médiane
de patients (mois)
Mayo Clinic (10) VP16 130 mg/m2IVPC de J1 à J3 18 67 19
+ CDDP 45 mg/m2IVPC J2 et J3
Institut Gustave-Roussy (11) VP16 100 mg/m2IV 1h J1 à J3 41 41,5 15
+ CDDP 100 mg/m2J1
Tableau II. Chimiothérapie des tumeurs endocrines peu différenciées.
Référence Protocole n RO (%) Survie médiane
(mois)
Frame, 1988 (8) ADR + STZ 33 40 11
Haller, 1990 (9) 5-FU + STZ 67 16 24
5-FU + ADR 75 13 16
Rougier, 1991 (18) 5-FU + ADR + CDDP 15 14 27
Bajetta, 2002 (19) 5-FU + ADR + DTIC 12 50 -
5-FU : 5 fluoro-uracile ; STZ : streptozotocine ; ADR : adriamycine ; CDDP : cisplatine ; DTIC : déticène.
Tableau I. Polychimiothérapie des tumeurs endocrines bien différenciées du tube digestif.
DOSSIER THÉMATIQUE
La lettre de l’hépato-gastroentérologue - n° 3 - vol. VIII - mai-juin 2005 111

d’efficacité entre les trois bras, mais avec une augmentation de la
toxicité en cas de traitement combiné (12). Ces résultats font que
l’interféron n’est pas considéré par la plupart des équipes comme
un traitement de première intention des TED évolutives.
CONCLUSION
La prise en charge des TED est parfois complexe en raison des divers
traitements disponibles et de la variabilité évolutive des tumeurs.
C’est pourquoi la stratégie thérapeutique doit être discutée de façon
individuelle en réunion de concertation multidisciplinaire. Les ana-
logues de la somatostatine, de la chimiothérapie systémique et de
l’interféron alpha sont des options thérapeutiques possibles. Les
analogues de la somatostatine ont un intérêt majeur dans la prise
en charge des formes symptomatiques avec syndrome carcinoïde
et permettent un contrôle tumoral dans environ la moitié des cas
dans les formes lentement évolutives. Dans cette situation, il s’agit
souvent du traitement de première intention. En cas de tumeur évo-
lutive (progression morphologique ou nouveaux sites métastatiques),
un traitement antitumoral sera envisagé et l’indication d’une chimio-
thérapie systémique ou d’un traitement par interféron pourra être
discutée, sachant que, pour les TED peu chimiosensibles, une chimio-
embolisation en cas de métastases hépatiques isolées ou prédomi-
nantes est souvent l’option privilégiée. ■
Mots-clés.Tu meurs endocrines du tube digestif - Analogues de
la somatostatine - Chimiothérapie - Interféron alpha - Syndrome
carcinoïde.
Keywords. Neuroendocrine carcinoma - Somatostatin analogues -
Chemotherapy - Alpha interferon - Carcinoid syndrome.
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Lamberts SW, van der Lely AJ, de Herder WW, Hofland LJ. Octreotide. N
Engl J Med 1996;334:246-54.
2. Ruszniewski P, Ducreux M, Chayvialle JA et al. Treatment of the carcinoid
syndrome with the long-acting somatostatin analogue lanreotide: a prospective
study in 39 patients. Gut 1996;39:279-83.
3. Rubin J, Ajani J, Schirmer W et al. Octreotide acetate long-acting formula-
tion versus open-label subcutaneous octreotide acetate in malignant carcinoid
syndrome. J Clin Oncol 1999;17:600-6.
4. O’Toole D, Ducreux M, Bommelaer G et al. Treatment of carcinoid syndrome:
a prospective crossover evaluation of lanreotide versus octreotide in terms of
efficacy, patient acceptability, and tolerance. Cancer 2000;88:770-6.
5. Welin SV, Janson ET, Sundin A et al. High-dose treatment with a long-acting
somatostatin analogue in patients with advanced midgut carcinoid tumours. Eur
J Endocrinol 2004;151:107-12.
6. Aparicio T, Ducreux M, Baudin E et al. Antitumour activity of somatostatin
analogues in progressive metastatic neuroendocrine tumours. Eur J Cancer
2001;37:1014-9.
7. Quaedvlieg PFHJ, Visser O, Lamers CBHW et al. Epidemiology and survi-
val in patients with carcinoid disease in the Netherlands. Ann Oncol 2001;12:
1295-300.
8. Frame J, Kelsen D, Kemeny N et al. A phase II trial of streptozotocin and
adriamycin in advanced APUD tumors. Am J Clin Oncol 1988;11:490-5.
9. Haller DG, Schutt A, Dayal Y et al. Chemotherapy for metastatic carcinoid
tumors: an ECOG phase II-III trial. Proc Am Soc Clin Oncol 1990;9:102.
10. Moertel CG, Kvols LK, O’Connell MJ, Rubin J. Treatment of neuroendocrine
carcinomas with combined etoposide and cisplatin. Cancer 1991;68:227-32.
11. Mitry E, Baudin E, Ducreux M et al. Treatment of poorly differentiated neuro-
endocrine tumours with etoposide and cisplatin. Br J Cancer 1999;81:1351-5.
12. Faiss S, Pape UF, Bohmig M et al. Prospective, randomized, multicenter
trial on the antiproliferative effect of lanreotide, interferon alfa, and their com-
bination for therapy of metastatic neuroendocrine gastroenteropancreatic
tumors-The International Lanreotide and Interferon Alfa Study Group. J Clin
Oncol 2003;21:2689-96.
13. Andersson T, Wilander E, Eriksson B et al. Effects of interferon on tumor
tissue content in liver metastases of human carcinoid tumors. Cancer Res
1990;50:3413-5.
14. Jacobsen MB, Hanssen LE, Kolmannskog F et al. Interferon-alpha 2b, with
or without prior hepatic artery embolization: clinical response and survival in
mid-gut carcinoid patients. The Norwegian Carcinoid Study. Scand J
Gastroenterol 1995;30:789-96.
15. Oberg K, Funa K, Alm G. Effects of leukocyte interferon on clinical symp-
toms and hormone levels in patients with mid-gut carcinoid tumors and carci-
noid syndrome. N Engl J Med 1983;309:129-33.
16. Janson ET, Ronnblom L, Ahlstrom H et al. Treatment with alpha-interferon
versus alpha-interferon in combination with streptozocin and doxorubicin in
patients with malignant carcinoid tumors: a randomized trial. Ann Oncol
1992;3:635-8.
17. Tiensuu Janson EM, Ahlstrom H, Andersson T, Oberg KE. Octreotide and
interferon alfa: a new combination for the treatment of malignant carcinoid
tumours. Eur J Cancer 1992;10:1647-50.
18. Rougier P, Oliveira J, Ducreux M et al. Metastatic carcinoid and islet cell
tumours of the pancreas: a phase II trial of the efficacy of combination chemo-
therapy with 5-fluorouracil, doxorubicin and cisplatin. Eur J Cancer
1991;27:1380-2.
19. Bajetta E, Ferrari L, Procopio G et al. Efficacy of a chemotherapy combi-
nation for the treatment of metastatic neuroendocrine tumours. Ann Oncol
2002;13:614-21.
DOSSIER THÉMATIQUE
La lettre de l’hépato-gastroentérologue - n° 3 - vol. VIII - mai-juin 2005
112

Les tumeurs endocrines
gastriques
B. Landi (hôpital européen
Georges-Pompidou, Paris)
L
a plupart des tumeurs endocrines
gastriques sont des tumeurs bien dif-
férenciées du fundus non sécrétantes,
développées à partir des cellules ECL (1).
Trois types sont distingués :
–le type I , associé à une gastrite chro-
nique auto-immune ;
–le type II, associé à la NEM1 et au syn-
drome de Zollinger-Ellison ;
–le type III, sporadique, sans hyper-
gastrinémie ou gastrite chronique auto-
immune.
Le type I représente environ 75 % des
tumeurs endocrines gastriques, le
type II 6 % et le type III 13 % (1). Les
autres tumeurs endocrines gastriques
sont très rares (tumeurs à cellules G de
l’antre, tumeurs peu différenciées).
Les tumeurs endocrines bien différen-
ciées fundiques (“EC-Lomes”) des types I
et II surviennent dans un contexte d’hyper-
gastrinémie, contrairement aux tumeurs
de type III. Il est fondamental de diffé-
rencier ces deux situations de prise en
charge et de pronostic différents par des
biopsies fundiques multiples en zone non
tumorale et le dosage de la gastrinémie.
Dans les tumeurs des types I et II, il existe
une hyperplasie des cellules endocrines
fundiques associée soit à une gastrite
atrophique fundique, soit à une muqueuse
le plus souvent normale dans le syn-
drome de Zollinger-Ellison. Les tumeurs
sont bien différenciées, le plus souvent
petites (moins de 10-15 mm), multiples
et d’évolution lente et de bon pronostic.
Les métastases à distance sont rares, mais
des métastases ganglionnaires peuvent
être observées, notamment dans les
tumeurs de type II. Les tumeurs de type I
représentent exceptionnellement une
cause de mortalité, alors que les tumeurs
de type II sont responsables du décès
dans 10 % des cas environ (1).
Les tumeurs de type III ne sont pas
associées à une hypergastrinémie. Elles
sont uniques, infiltrantes et de mauvais
pronostic. En effet, des métastases gan-
glionnaires et à distance sont présentes
dans 70 % des cas (1).
Les facteurs associés à une évolution
bénigne des tumeurs endocrines bien
différenciées fundiques sont l’absence
d’atteinte de la musculeuse, l’absence
d’invasion vasculaire, un diamètre infé-
rieur à 1 cm et la survenue dans un
contexte d’hypergastrinémie. L’écho-
endoscopie est utile pour les tumeurs
de plus de 1 cm, permettant d’apprécier
l’infiltration pariétale et l’éventuel enva-
hissement ganglionnaire.
La prise en charge thérapeutique dépend
de plusieurs paramètres (2). Dans les
tumeurs des types I et II, si le diamètre
est inférieur ou égal à 1 cm, une surveil-
lance ou une résection endoscopique
par mucosectomie peuvent être propo-
sées. Si le diamètre est supérieur à 1 cm
ou si la tumeur s’étend au-delà de la
musculeuse en échoendoscopie, une
résection chirurgicale, endoscopique ou
une antrectomie peuvent être discutées
selon le terrain, l’extension des tumeurs
et leur nombre. Les analogues de la
somatostatine ont été proposés par cer-
tains comme alternative au traitement
chirurgical. Dans les tumeurs de type III,
une chirurgie carcinologique est recom-
mandée si elle est possible. ■
RÉFÉRENCES BIBLIOGRAPHIQUES
1.Capella C, Solcia E, Sobin LH, Arnold R. Endo-
crine tumours of the stomach. In: Hamilton SR,
Aaltonen LA (eds). WHO classification of tumours.
Pathology and genetics of tumours of the digestive
system. IARC Press 2000;53-7
2.Cadiot G, Baudin E, Partensky C, Ruszniewski P,
pour la SNFGE. Thésaurus de bonnes pratiques en
cancérologie digestive : tumeurs endocrines diges-
tives et pancréatiques. 2002. www.snfge.asso.fr
DOSSIER THÉMATIQUE
La lettre de l’hépato-gastroentérologue - n° 3 - vol. VIII - mai-juin 2005 113
1
/
4
100%