Voies de signalisation des récepteurs couplés aux protéines G

Voies de signalisation des
récepteurs couplés aux
protéines G (RCPG ou GPCR)
Audrey Claing, Ph.D
Département de Pharmacologie
Université de Montréal
10 janvier 2013

Plan du cours
1) Structure et fonction des GPCRs
2) Transduction signalitique protéines G dépendante et
indépendante
3) Mécanismes de désensibilisation
4) Mécanisme d’internalisation/trafficking intracellulaire
5) Signalisation biaisée
6) Signalisation vers la voie des MAPK

Adaptation de la réponse pharmacologique:
-Plus de 40% des agents pharmacologiques ciblent les récepteurs
couplés aux protéines G (RCPGs)
-Environ 1 000 gènes encodent les RCPGs
-Les RCPG sont responsable de la pluspart des réponses
physiologiques et leur fonction est déréglée lors du développement
de pathophysiologies.
The Nobel Prize in Chemistry
Lefkowitz and Kobilka
made groundbreaking
discoveries, mainly in the
1980s, on an important
family of receptors, known
as G-protein-coupled
receptors. In 2011, Mr.
Kobilka's team captured an
image of the receptor for
adrenaline at the moment
when it is activated by a
hormone and sends a
signal into the cell.

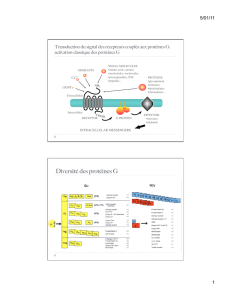
Récepteurs couplés aux protéines G
Ca2+!
ODORANTS!
SMALL MOLECULES:!
• amino acids, amines!
• nucleotides, nucleosides!
• prostaglandins, PAF!
• peptides...!
PROTEINS:!
• glycoprotein
hormones!
• interleukines!
• chemokines...!
LIGHT!
G PROTEIN!
EFFECTOR:!
• enzymes!
• channels!
INTRACELLULAR MESSENGERS!
Extracellular!
Intracellular!
RECEPTOR!
COOH!
NH2!

(A) Three main families (1, 2 and 3) can be easily recognized when
comparing their amino-acid sequences. Receptors from different
families share no sequence similarity, suggesting that we are in the
presence of a remarkable example of molecular convergence.
Family 1 contains most GPCRs including receptors for odorants.
Group 1a contains GPCRs for small ligands including rhodopsin
and -adrenergic receptors. The binding site is localized within the
seven TMs. Group 1b contains receptors for peptides whose
binding site includes the N-terminal, the extracellular loops and
the superior parts of TMs. Group 1c contains GPCRs for
glycoprotein hormones. It is characterized by a large extracellular
domain and a binding site which is mostly extracellular but at least
with contact with extracellular loops e1 and e3. Family 2 GPCRs
have a similar morphology to group Ic GPCRs, but they do not
share any sequence homology. Their ligands include high molecular
weight hormones such as glucagon, secretine, VIP-PACAP and the
Black widow spider toxin, -latrotoxin (Krasnoperov et al., 1997;
Davletov et al., 1998). Family 3 contains mGluRs and the Ca2+
sensing receptors (Pin and Bockaert, 1995). Last year, however,
GABA-B receptors (Kaupmann et al., 1997) and a group of
putative pheromone receptors coupled to the G protein Go
(termed VRs and Go-VN) became new members of this family
(reviewed in Bargmann, 1997). (B) Family 4 comprises pheromone
receptors (VNs) associated with Gi (Dulac and Axel, 1995). Family
5 includes the 'frizzled' and the 'smoothened' (Smo) receptors
involved in embryonic development and in particular in cell
polarity and segmentation. Finally, the cAMP receptors (cAR) have
only been found in D.discoïdeum but its possible expression in
vertebrate has not yet been reported. The dendrogram has been
established with Clustal W.
Familles des RCPG
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
1
/
63
100%