Agir : Synthétiser des molécules/ Stratégie de la synthèse organique

Agir : synthèse de l’aspirine TP A4
1/6
COMMENT SYNTHETISER UNE MOLECULE
ORGANIQUE D’INTERET BIOLOGIQUE ?
Compétences attendues :
- Pratiquer une démarche expérimentale pour synthétiser une molécule organique d’intérêt
biologique à partir d’un protocole.
- Identifier des réactifs et des produits à l’aide de spectres et de tables fournis.
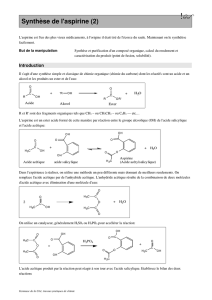
Document n°1. Synthèse de l’aspirine
L’aspirine (acide acétylsalicylique) est connue pour ses
propriétés antalgiques. Elle peut être synthétisée au
laboratoire de deux façons différentes :
A partir d’acide salicylique et d’anhydride éthanoïque selon
l’équation de la réaction :
A partir d’acide salicylique et d’acide éthanoïque.
Acide salicylique acide éthanoïque acide acétylsalicylique eau
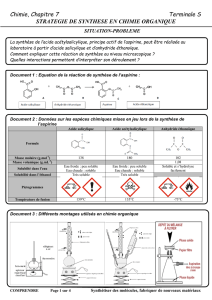
Document n°2. Montage et
filtration sur Buchner
Document n°3. Protocole de la synthèse dans les deux cas.
Observer les pictogrammes des réactifs utilisés et s’organiser en conséquence.
(1) Préparer un bain marie à 60°C dans un récipient. La température ne devra pas dépasser
80°C.
(2) Dans un erlenmeyer sec, introduire :
- une masse m précise d’environ 3,0 g d’acide salicylique en poudre (déjà pesée), un barreau
aimanté.
- un volume Van = 6,0 mL d'anhydride acétique ou Vac = 4,0 mL d’acide acétique prélevé au
distributeur sous la hotte.

Agir : synthèse de l’aspirine TP A4
2/6
- 6 gouttes d’acide sulfurique concentré avec un compte-goutte sous la hotte (le volume
d’une goutte est estimé à 0,05 mL).
(3) Adapter un réfrigérant à eau sur l’erlenmeyer puis chauffer le mélange au bain marie
pendant 20 min environ en maintenant une agitation douce.
(4) Au bout de 20 min, cesser de chauffer, sortir l’erlenmeyer du bain marie sans débrancher
le réfrigérant. Laisser refroidir l'erlenmeyer.
(5) Ajouter par le sommet du réfrigérant, environ 10 mL d'eau distillée mesurée à l'aide de
l'éprouvette graduée afin de détruire l’excès d’anhydride éthanoïque, en prenant garde aux
vapeurs chaudes et acides.
(6) Quand l'ébullition est calmée, ajouter 20 mL d'eau distillée glacée, arrêter la circulation
d'eau et ôter le réfrigérant. Rajouter encore 30 mL d'eau glacée. On pourra éventuellement
initier la cristallisation en grattant le fond de l’erlenmeyer avec un agitateur en verre.
(7) Placer l'erlenmeyer dans un bain d'eau glacée (eau froide + glaçons) pendant 10 minutes.
Ne pas agiter !
(8) Filtrer les cristaux obtenus sur filtre Buchner et les rincer à l'eau distillée froide.
Document n°4. Identification du produit.
Par chromatographie : (9)
Verser 5 mL d'éluant dans le bécher à chromatographie (éluant déjà préparé).
Sur la plaque CCM, pour chaque solution, faire les dépôts (vérifier les dépôts sous UV).
C : solution dans l’éthanol d’aspirine contenue dans un Comprimé.
AS : solution dans l’éthanol d’Acide Salicylique (déjà prêt).
S : solution dans l’éthanol des cristaux Synthétisés.
Mettre à éluer.
Révéler sous UV et entourer les taches observées.
Par RMN (10)

Agir : synthèse de l’aspirine TP A4
3/6
Document n°5. Rendement d’une synthèse
Le rendement r d’une synthèse est le rapport de la masse de produit réellement obtenue à
la masse de produit que l’on obtiendrait en considérant la réaction comme totale soit :
imalemasse obtenuemasse
rmax
Questions :
Pour répondre aux questions, vous pourrez vous aider de la préparation et du tableau des données.
1. Etapes d’une synthèse
Le protocole d’une synthèse organique peut se découper en plusieurs étapes. Associer pour le
protocole réalisé les numéros indiqués sur le protocole aux trois étapes d’une synthèse :
transformation, traitement et identification.
2. Identification des espèces chimiques mises en jeu
a. Nommer le produit d’intérêt (l’espèce que l’on souhaite effectivement synthétiser). Quel est
le sous-produit formé ?
b. La réaction est-elle une réaction d’élimination, substitution ou d’addition ?
c. Retrouver alors le rôle respectif des différentes espèces chimiques introduites.
d. Un solvant est-il introduit dans cette synthèse ?
e. Déterminer les quantités de matière des réactifs introduits.
f. Quel est le réactif limitant ?
g. Calculer le rendement de chaque réaction de synthèse.
3. Choix des paramètres expérimentaux (température, solvant, durée de la réaction, pH…)
Préciser quels paramètres expérimentaux sont spécifiés dans le protocole et leur effet sur la réaction
chimique.
4. Choix du montage et des techniques expérimentales utilisées
Le montage utilisé lors de la transformation est un chauffage à reflux.
a. Justifier le choix du montage et de la technique utilisée lors de l’opération de séparation.
b. Expliquer le double rôle de l’ajout d’eau réalisée à l’étape (5) et (6) du protocole avec
l’anhydride acétique et le simple rôle dans la synthèse avec l’acide éthanoïque.
5. Aspects liés à la sécurité
Indiquer quelles précautions ont été prises lors des manipulations.
6. Choix de l’analyse du produit
a. Indiquer le résultat de l’analyse du produit obtenu
b. Proposer une autre méthode d’identification de l’acide acétylsalicylique.
7. Avantages et inconvénients des deux protocoles
Discuter du choix des espèces chimiques utilisées dans l’un et l’autre des protocoles et du
choix du réactif limitant en prenant en compte les coûts.

Agir : synthèse de l’aspirine TP A4
4/6
8. Mécanisme réactionnel
1.
2.
3.
4.
5.

Agir : synthèse de l’aspirine TP A4
5/6
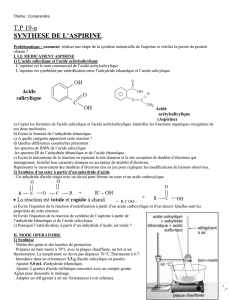
Données :
Nom
Acide
salicylique
Acide
acétylsalicylique
Acide éthanoïque
Anhydride éthanoïque
Acide sulfurique
Formule
H2SO4
Masse molaire (g.mol-1)
138
180
60
102
98
Etat physique à 20°C
solide
solide
liquide
liquide
liquide
Température d’ébullition
118°C
136°C
336 °C
Température de fusion
158 °C
135°C (risque de
décomposition vers 80
°C)
densité
1,05
1,08
1.84
Solubilité dans l’eau
Eau froide :
peu soluble
Eau chaude :
soluble
Eau froide : peu
soluble
Eau chaude :
soluble
Très soluble dans l’eau
Soluble
S’hydrolyse facilement
Très soluble dans l’eau
Pictogramme
remarques
S’hydrolyse au contact de
l’eau en donnant de l’acide
éthanoïque : réaction lente à
froid et assez violente à
chaud
on utilise ici une solution
très concentrée : 5 mol/L
Prix
1 kg : 30 €
1L : 18 €
1 L : 10 €
 6
6
1
/
6
100%