Néphropathie diabétique : EC ou sartans ? I T

NÉPHROPATHIE DIABÉTIQUE : GÉNÉRALITÉS
Épidémiologie
Le diabète est devenu la cause la plus fréquente d’insuffisance
rénale aux États-Unis (40 %), au Japon et dans certains pays d’Eu-
rope, en raison de l’augmentation de la prévalence du diabète,
notamment de type 2, d’une meilleure espérance de vie des
patients diabétiques et de la prise en charge de ces patients en dia-
lyse (1). Environ 20 à 40 % des diabétiques de type 2 vont évo-
luer en une vingtaine d’années vers une néphropathie avérée (2).
Histoire naturelle : un fléau silencieux et insidieux
La néphropathie diabétique spécifique, glomérulaire, évolue pro-
gressivement d’une phase précoce caractérisée par des anoma-
lies fonctionnelles de la fonction rénale (hyperfiltration glomé-
rulaire, excrétion augmentée de l’albumine) à une phase de
néphropathie lésionnelle, avec protéinurie persistante, cette der-
nière pouvant évoluer vers l’insuffisance rénale (3).
Ainsi, la néphropathie diabétique débute par ce qu’il est convenu
d’appeler une “microalbuminurie” (albuminurie > 30 mg/24 h ou
20 µg/mn) qui définit une néphropathie incipiens (3). Le terme
“micro” est exclusivement quantitatif et désigne en fait une albu-
minurie trop faible pour être détectée par la bandelette urinaire
standard ou pour être dosée par les méthodes traditionnelles de
mesure qui ne sont pas assez sensibles. La néphropathie patente
est
définie par une albuminurie supérieure à 300 mg/24 h
(200 µg/mn).
Cette dernière est parfois appelée à tort macroalbuminurie, terme
impropre qu’il convient d’éviter au profit de protéinurie clinique,
car à ce stade apparaissent dans l’urine d’autres éléments d’une
protéinurie glomérulaire. Ces anomalies doivent, par ailleurs, être
validées sur plusieurs dosages.
Le dépistage recommandé actuellement de la microalbuminurie
est annuel chez les diabétiques de type 1 ayant un diabète de plus
de 5 ans et chez tous les diabétiques de type 2 dès la découverte
de la maladie (1). Le dépistage commence par une bandelette uri-
naire standard, puis un dosage de microalbumine lorsque la ban-
delette est négative. Ce dépistage permet également de détecter
des néphropathies différentes de la glomérulonéphrite diabétique
THÉRAPEUTIQUE
La Lettre du Cardiologue - n° 381 - janvier 2005
35
Néphropathie diabétique : IEC ou sartans ?
M. Laville*
spécifique (qui ne représente que 60 % des cas), qui peuvent être
observées chez le diabétique de type 2, d’autant qu’il s’agit d’un
sujet âgé à risque vasculaire (néphroangiosclérose, sténose arté-
rielle rénale) (3). Le recueil des urines de 24 heures étant relati-
vement fastidieux, il est actuellement recommandé d’utiliser le
rapport albumine/créatinine sur un échantillon d’urine. Le seuil
de positivité est à 30 mg/g (3,4 mg/mmol).
La présence d’une microalbuminurie doit être confirmée par deux
autres dosages successifs. Chez un diabétique de type 2, c’est
surtout un marqueur de gravité générale de la maladie (notam-
ment vis-à-vis du risque cardiovasculaire), plus qu’un marqueur
spécifiquement néphrologique (3).
Le paramètre le plus précis pour évaluer la fonction rénale est le
débit de filtration glomérulaire (DFG) qui peut être mesuré par
des méthodes spécifiques (clairance de marqueurs glomérulaires
comme le iohexol), et peut être estimé en routine clinique par la
formule de Cockcroft et Gault (4) ou la formule du MDRD sim-
plifiée (5) (encadré) :
Selon les recommandations de l’ANAES (4),on peut distinguer
quatre stades :
–stade 1 : maladie rénale chronique 3DFG ≥60 ml/mn/1,73 m
2
–stade 2 : insuffisance rénale chronique (IRC) modérée
3DFG : 30-59 ml/mn/1,73 m
2
–stade 3 : IRC sévère
3DFG : 15-29 ml/mn/1,73 m
2
–stade 4 : IRC terminale 3DFG < 15 ml/mn/1,73 m
2
Dans le diabète de type 2, une étude prospective récente (6) a
montré que le déclin moyen du DFG était de 5,2 ml/mn/an, les
principaux facteurs de ce déclin étant les niveaux de base d’al-
buminurie, de pression artérielle systolique (PAS), d’hémoglo-
bine glycosylée, du DFG, de l’âge et enfin du degré de rétino-
pathie diabétique (R
2
ajusté 0,24).
*Hôpital Édouard-Herriot, Lyon.
Encadré. Estimation du débit de filtration glomérulaire.
Formule de Cockcroft et Gault :
DFG (ml/mn) = 140 – âge (année) xpoids (kg) xK/créatininémie
(µmol/l)
K = 1,23 pour l’homme et 1,04 pour la femme.
Si la créatinine est exprimée en mg/l, il faut en multiplier le chiffre
par 8,8 pour l’obtenir en µmol/l.
Formule du MDRD simplifiée :
DFG* = 186 xcréatininémie
–1,154
xâge
–0,203
*ml/mn/1,73 m
2
,corriger par 0,742 pour les femmes, 1,21 pour les Noirs.

La Lettre du Cardiologue - n° 381 - janvier 2005
36
Un pronostic sombre
Les patients diabétiques de type 2 atteints de néphropathie dia-
bétique ont une mortalité accrue essentiellement d’origine car-
diovasculaire (7). Le diabète est actuellement reconnu comme
un paramètre déterminant de l’évaluation du risque cardiovas-
culaire ; ainsi, dans les dernières recommandations de l’ESH (8),
l’existence d’un diabète a le même “poids” que l’existence de
trois facteurs de risque. Le diabète est responsable en France de
8500 amputations et de 30 000 infarctus du myocarde par an (9).
De plus, la microalbuminurie est un marqueur intermédiaire de
risque d’atteinte cardiovasculaire dans le diabète de type 2. Sa
présence indique un risque de mortalité cardiovasculaire trois
fois plus important (9) et son identification est recommandée en
particulier chez tous les patients hypertendus (8).
Il existe une relation continue entre albuminurie et risque car-
diovasculaire, au-delà même de la microalbuminurie (10, 11).
Cette relation a été confirmée par une étude récente (12) où le
risque cardiovasculaire est directement proportionnel au niveau
d’albuminurie : multiplié par 1,92 pour les événements cardio-
vasculaires et multiplié par 2,7 pour le risque d’insuffisance car-
diaque chez les patients ayant une albuminurie élevée (≥3g/g
de créatinine) par rapport aux patients ayant une faible albumi-
nurie (< 1,5 g/g de créatinine).
Enfin, dans une étude particulièrement intéressante, réalisée chez
des patients diabétiques asymptomatiques (13),il a été démon-
tré que, sur un suivi moyen de 2,3 années, les patients ayant un
DFG réduit (< 60 ml/mn/1,73m
2
) avaient un risque multiplié par 2
d’avoir un événement cardiaque. En analyse multivariée, le DFG,
indépendamment du niveau d’albuminurie, était un facteur pré-
dictif indépendant d’événements cardiaques (angor instable,
infarctus du myocarde, pontage aorto-coronaire, intervention
coronaire percutanée) (OR = 2,2 ; IC 95 % : 1,1-4,46).
NÉPHROPATHIE DIABÉTIQUE :
IMPACT DU CONTRÔLE TENSIONNEL
ET DU BLOCAGE DU SYSTÈME RÉNINE-
ANGIOTENSINE-ALDOSTÉRONE (SRAA)
Contrôle tensionnel
Le diabète est un facteur de risque majeur chez l’hypertendu et
impose un contrôle strict des paramètres tensionnels. Ainsi,
dans les recommandations récentes l’objectif tensionnel est
< 130/80 mmHg (8),et < 125/75 mmHg si la protéinurie dépasse
1 g/24 h. D’une façon générale, l’objectif est d’obtenir la plus
basse pression artérielle tolérée par le patient. Ce contrôle ten-
sionnel strict impose le plus souvent une association d’antihy-
pertenseurs (avec au moins un diurétique).
Toutes les études (14) montrent d’une part la relation linéaire
entre abaissement de la pression artérielle et ralentissement de
la progression de l’insuffisance rénale, et d’autre part la difficulté
à atteindre chez le patient diabétique les cibles tensionnelles
recommandées avec moins de trois médicaments antihyper-
tenseurs.
Une étude japonaise (15),réalisée chez 170 patients diabétiques
de type 2, a souligné l’intérêt de contrôler l’hypertension arté-
rielle matinale chez le patient diabétique de type 2. Cette étude
a démontré en particulier que l’hypertension artérielle systolique
matinale (automesure) était fortement corrélée au risque de
néphropathie : en analyse multivariée (OR = 1,07 ; p < 0,001).
La prise en charge intensive et stricte des autres facteurs de risque
cardiovasculaire est nécessaire et utile comme l’a bien démontré
l’étude STENO II (16) chez des patients diabétiques de type 2 et
microalbuminuriques, où une prise en charge intensive (par rap-
port à une prise en charge conventionnelle) était associée à une
diminution du risque cardiovasculaire de 50 % (p = 0,007) sur
un suivi moyen de 7,8 années. Le risque de néphropathie était
diminué de 61 % (p = 0,003).
Ces résultats soulignent également l’importance d’une prise en
charge multidisciplinaire de ces patients, ainsi que la bonne com-
préhension et la motivation du patient à l’égard de son traitement
(17) d’où la nécessité d’une bonne tolérance des thérapeutiques.
Par ailleurs, compte tenu du profil à haut risque cardiovasculaire
de ces patients, les recommandations de l’Alfediam et de la SFC
préconisent systématiquement la prescription d’une faible dose
d’aspirine (9).
Blocage du SRAA
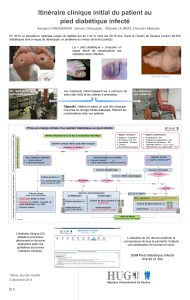
Il est logique de bloquer le SRAA dans la néphropathie diabé-
tique car l’angiotensine II a des effets délétères bien connus par
le biais du récepteur AT1 prédominant dans le rein (18). L’an-
giotensine II est à l’origine d’une vasoconstriction entraînant une
augmentation de la pression intraglomérulaire, une stimulation
locale de l’inflammation (en particulier la cytokine TGF ß), une
prolifération cellulaire et une fibrose (figure 1). Toutes ces modi-
fications aboutissent à un véritable cercle vicieux entre pression
artérielle et lésions rénales.
Il semblait logique d’évaluer les inhibiteurs du SRAA dans le cadre
de la prévention de la survenue ou de l’évolutivité de la néphropa-
thie diabétique. Il est admis selon les dernières recommandations
de l’ANAES que les antagonistes des récepteurs de l’angiotensine II
(ARA2) sont indiqués en première intention dans la néphropathie
diabétique de type 2, et les IEC dans les autres cas (4).
THÉRAPEUTIQUE
• Altération de la pression
glomérulaire
• Stress oxydatif
• Protéinurie
• Activation du facteur
nucléaire NFκB
↑ matrice extracellulaire
↑ adhésion des molécules
↑ facteurs chimiotactiques
↑ infiltration par
les macrophages
↑ TGF-ß
↑ PAI-1
↑ prolifération cellulaire
↑ du dépôt de collagène
↑ apoptose
• Hyperfiltration
• Hypertension artériolaire
glomérulaire
Insuffisance
rénale
chronique
Réduction
de la masse
néphrotique
• Sclérose glomérulaire
• Fibrose
tubulo-insterstitielle
Angiotensine II
Figure 1. Effets délétères de l’angiotensine II sur le rein.

La Lettre du Cardiologue - n° 381 - janvier 2005
37
THÉRAPEUTIQUE
En ce qui concerne les IEC, les preuves ne manquent pas et une
méta-analyse récente (19)a montré que les IEC diminuaient, chez
les patients diabétiques (de type 1 ou 2), de 40 % le temps de
doublement de la créatininémie, de 36 % l’évolution vers l’in-
suffisance rénale terminale et de 55 % la progression du stade de
microalbuminurie à celui d’albuminurie clinique.
Une autre étude, BENEDICT, a démontré l’intérêt d’un IEC (tran-
dolapril) dans le diabète de type 2 à un stade précoce en dimi-
nuant significativement l’incidence de la microalbuminurie (20).
Concernant les ARA2, les preuves ont été apportées essentielle-
ment dans le diabète de type 2 à un stade précoce (microalbu-
minurie), par les études IRMA 2 (21) avec l’irbésartan, MAR-
VAL (22) avec le valsartan et CALM (23) avec le candésartan.
À un stade plus avancé de néphropathie avérée, les preuves ont
été apportées par les études RENAAL (24) avec le losartan et
IDNT (25) avec l’irbésartan qui ont montré une baisse respecti-
vement de 16 % et de 20 % du critère composite associant temps
de doublement de la créatininémie, évolution vers l’insuffisance
rénale terminale et décès.
Seules deux études ont évalué l’intérêt d’une association IEC-
ARA2 en démontrant un bénéfice supérieur : l’étude CALM (23)
dans la néphropathie diabétique et l’étude COOPERATE (26)
dans la néphropathie non diabétique. Toutefois, les preuves ne
sont pas assez nombreuses et robustes pour recommander cette
association d’emblée d’autant qu’elle expose à un risque non
négligeable d’hyperkaliémie.
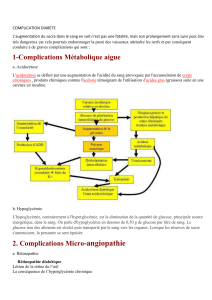
En revanche, les recommandations de l’ANAES (figure 2) (4),
non spécifiques à la néphropathie diabétique, préconisent cette
association si la protéinurie n’est pas maîtrisée (protéinurie
≥0,5 g/l) par un IEC ou un ARA2 à forte dose.
En pratique, il est recommandé de commencer un antagoniste du
SRAA (IEC ou ARA2) par une faible dose et d’augmenter pro-
gressivement les doses par paliers de quatre semaines (4). Il est
préconisé de surveiller attentivement la kaliémie et la créatini-
némie après 7 à 15 jours de traitement. En cas d’augmentation
de la créatininémie de plus de 30 %, il faut arrêter temporaire-
ment les IEC qui pourront être réintroduits après avoir écarté une
sténose de l’artère rénale.
Toutes les études sur la progression de la néphropathie diabé-
tique se sont comparées soit à un placebo soit à un antihyper-
tenseur ne bloquant pas le SRAA. Il manquait donc à l’évidence
une étude comparant directement IEC et ARA2 sur la progres-
sion à long terme de la néphropathie diabétique. C’est cette lacune
que l’étude DETAIL, qui vient d’être publiée dans le New
England Journal of Medicine,a permis de combler.
L’ÉTUDE DETAIL
(27)
Le telmisartan a été choisi pour ses propriétés pharmacolo-
giques qui associent une longue durée d’action, en particulier
sur la couverture de la PA matinale (28),et une forte lipophi-
lie assurant une bonne pénétration tissulaire et donc rénale.
Concernant la couverture du nycthémère, l’étude PRISMA II
(29) a démontré l’intérêt du telmisartan versus ramipril dans
le maintien du contrôle tensionnel sur les six dernières heures,
objectivé par MAPA au bout de 14 semaines de traitement. Ce
contrôle efficace sur la pression artérielle matinale est parti-
culièrement intéressant chez les patients diabétiques, compte
tenu de l’exigence des objectifs tensionnels. En outre, le tel-
misartan présente des caractéristiques potentiellement utiles
chez ces patients, en particulier son action agoniste des récep-
teurs PPARγimpliqués dans la physiopathologie du syndrome
métabolique (30),grand pourvoyeur de mortalité cardiovas-
culaire.
L’étude DETAIL, d’une durée de 5 ans, a inclus 250 patients hyper-
tendus diabétiques de type 2, atteints de néphropathie débutante
(albuminurie entre 11 et 999 µg/mn et DFG ≥70 ml/mn/ 1,73 m2),
qui ont été randomisés et traités en double aveugle par une dose
quotidienne de 80 mg de telmisartan ou de 20 mg d’énalapril.
Le critère principal de l’étude était la variation par rapport à la
valeur de base du DFG, largement acceptée comme la mesure la
plus précise de la fonction rénale globale, au bout de 5 ans. La
valeur précise du DFG, techniquement exigeante, a été obtenue
par la mesure de la clairance plasmatique de l’iohexol, substance
inerte dans les urines.
Insuffisance rénale chronique
DFG 30-80 ml/mn
Protéinurie < 0,5 g/j
et
PA << 130/80 mmHg
IEC ou ARA2*
+ restriction sodée (6 g/j)
Poursuite du
traitement
Poursuite du
traitement Poursuite du
traitement
Surveillance
Protéinurie < 0,5 g/l
et
PA << 130/80 mmHg
Protéinurie
> 0,5 g/l
Protéinurie
> 0,5 g/l
Augmentation des doses
d'IEC ou ARA2*
Association
IEC + ARA2
Adjonction de
bêtabloquant ou
calcium-bloquant
Adjonction
de diurétique**
PA
<< 130/80 mmHg
PA
<< 130/80 mmHg
NON
NON
NON
NON
OUI
OUI
OUI OUI
ET/OU
<< Inférieure à 130/80 mmHg
et plus basse si possible.
* ARA2 si diabétique de type 2
et IEC dans les autres cas.
** Diurétiques thiazidiques ou de l'anse
en fonction de la sévérité de l'IRG.
Figure 2. Stratégie
thérapeutique
(ANAES 2004).

La Lettre du Cardiologue - n° 381 - janvier 2005
38
Les critères secondaires étaient les variations annuelles du DFG,
l’évolution en pourcentage de l’excrétion d’albumine après 1, 2,
3, 4 et 5 ans, l’incidence des événements cliniques (IRT, IDM,
AVC, insuffisance cardiaque congestive), la mortalité toutes
causes confondues et les données issues de la pharmacovigilance.
Concernant le critère principal, le déclin du DFG a été compa-
rable sous telmisartan et sous énalapril à 5 ans (respectivement
17,9 ml/mn/1,73 m
2
versus 14,9 ml/mn/1,73 m
2
; p = NS).
L’étude DETAIL démontre ainsi pour la première fois qu’un
ARA2, le telmisartan, est aussi efficace qu’un IEC, l’énalapril,
dans la prévention de la progression de la néphropathie diabé-
tique de type 2 à un stade précoce.
Concernant les critères secondaires, il n’y pas eu de différence
significative entre les deux groupes (à noter que les patients inclus
ne devaient pas être intolérants aux IEC, ce qui explique l’ab-
sence de sortie de l’étude pour cause de toux). Dans ce contexte,
il est utile de se référer à une analyse récente de deux études com-
parant l’efficacité antihypertensive du telmisartan versus énala-
pril (31). Le telmisartan s’est avéré significativement mieux toléré
que l’énalapril avec une incidence d’événements indésirables liés
au traitement respectivement de 8,9 % dans le groupe telmisar-
tan versus 26,9 % dans le groupe énalapril.
Enfin, il est intéressant de souligner que la mortalité observée était
assez faible. On note six décès par groupe (environ 5 %) dont la
moitié d’origine cardiovasculaire. Aucune conclusion définitive ne
peut en être tirée, mais il faut simplement reconnaître que ces
chiffres ont été plus favorables que ceux attendus. Ces résultats
sont à rapprocher de ceux des études qui ont montré une amélio-
ration du pronostic cardiovasculaire, sous traitement IEC, chez des
patients atteints de néphropathie diabétique de type 2 (19, 32).
CONCLUSION
L’étude DETAIL est la première étude comparant un ARA2, le tel-
misartan, versus un IEC, l’énalapril, évaluant la protection contre
la progression de la néphropathie diabétique de type 2 à un stade
précoce. Les résultats sont comparables et confortent l’indication
de première intention des ARA2 dans la prise en charge des patients
hypertendus atteints de néphropathie diabétique de type 2.
De nouvelles études, évaluant d’autres critères de néphroprotec-
tion, sont en cours. Elles sont en général réalisées avec les ARA2,
notamment le telmisartan. Ainsi, l’étude DETAIL est la première
étude disponible parmi les cinq études de néphroprotection chez
le diabétique de type 2 prévues dans le programme PROTECTION.
TRENDY évalue l’intérêt du telmisartan versus ramipril dans la
réduction de la dysfonction endothéliale rénale ; INNOVATION
évalue l’intérêt du telmisartan (40 ou 80 mg) versus placebo dans
la réduction de la microalbuminurie, AMADEO évalue l’intérêt
du telmisartan versus losartan dans la réduction de la protéinurie
clinique ; et enfin,VIVALDI évalue l’intérêt du telmisartan versus
valsartan dans la réduction de la protéinurie clinique.
Dans ce cadre, les résultats de l’étude ONTARGET (33)seront atten-
dus avec impatience à l’horizon 2007 : cette étude a pour objet d’éva-
luer l’intérêt du telmisartan (80 mg) versus ramipril (10 mg) versus
l’association telmisartan et ramipril en termes de mortalité cardio-
vasculaire chez des patients à haut risque cardiovasculaire. O
Bibliographie
1. Molitch ME, De Fronzo RA, Franz MJ et al. Nephropathy in diabetes. ADA
recommendations. Diabetes Care 2004;27(Suppl. I):S79-S83.
2. Dussol B. HTA et diabète. Le Quotidien du médecin 2004;7593.
3. Recommandations ANAES. Suivi du patient diabétique de type 2 à l’exclusion
du suivi des complications 1999.
4. Recommandations ANAES. Moyens thérapeutiques pour ralentir la progres-
sion de l’Insufissance rénale chronique chez l’adulte 2004.
5. Coresh J, Astor BC, Mc Quillar G et al. Calibration and random variation of
the serum creatinine assay as critical elements of using equations to estimate glo-
merular filtration rate. Am J Kidney Dis 2002;39(5):920-9.
6. Rossing K, Christensen PK, Hovind P et al. Progression of nephropathy in
type 2 diabetic patients. Kydney International 2004;66(4):1596-605.
7. Adler AI, Stevens RJ, Manley SE et al. Development and progression of
nephropathy in type 2 diabetes: The United Kingdom Prospective diabetes Study
(UKPDS 64). Kidney Int 2003;63(1):225-32.
8. Cifkova R, Erdine S, Fagard R et al. Recommandations ESH pour la prise en
charge de l’hypertension artérielle. J hypertens 2003;21:1779-86.
9. Charbonnel B, Bouhanick B, Le Feuvre C et al. Recommandations SFC/Alfediam
sur la prise en charge du patient diabétique vu par le cardiologue. Arch Mal
Cœur Vaiss 2004;97(3):229-49.
10. Stephenson JM, Kenny S, Stevens LK, Fuller JH, Lee E. Proteinuria and
mortality in diabetes: the WHO Multinational Study of Vascular Disease in
Diabetes. Diabet Med 1995;12(2):149-55.
11. Miettinen H, Haffner SM, Lehto S et al. Proteinuria predicts stroke and other
atherosclerotic vascular disease events in nondiabetic and non-insulin-dependent
diabetic subjects. Stroke 1996;27(11):2033-9.
12. De Zeeuw D, Remuzzi G, Parving HH et al. Albuminuria, a therapeutic tar-
get for cardiovascular protection in type 2 diabetic patients with nephropathy
Circulation 2004;110(8):921-7.
13. Knobler H, Zornitzki T, Vered S et al. Reduced glomerular filtration rate in
asymptomatic diabetic patients: predictor of increased risk for cardiac events
independent of albuminurie. J Am Coll Cardiol 2004;44(11):2142-8.
14. Bakris GL, Williams M, Dworkin L et al. Preserving renal function in adults
with hypertension and diabetes: a consensus approach. Am J Kidney Dis 2000;
36(3):646-61.
15. Kamoi K, Migakoshi M, Soda S, Kaneko S, Nakagawa O. Usefulness of home
blood pressure measurement in the morning in type 2 diabetic patients. Diabetes
Care 2002;25(12):2218-23.
16. Gaede P, Vedel P, Larsen N et al. Multifactorial Intervention and Cardiovascular
Disease in patients with type 2 diabetes. N Engl J Med 2003;348(5):383-93.
17. Rachmani R, Levi Z, Slavachevski I, Avin M, Ravid M. Teaching patients to
monitor their risk factors retards the progression of vascular complications in
high-risk patients with type 2 diabetes mellitus – a randomized prospective study.
Diabet Med 2002;19(5):385-92.
18. Brewster UC, Perazella MA et al. The renin-angiotensin-aldosterone system
and the kidney: effects on kidney disease. Am J Med 2004;116(4):263-72.
19. Strippoli G, Craig M, Deeks JJ, Schena FP, Craig JC. Effects of ACE inhibi-
tors and Angiotensin II-receptor antagonists on mortality and renal outcomes in
diabetic nephropathy: systematic review. Br Med J 2004;329:828-39.
20. Ruggenenti P, Fassi A, Ilieva AP et al. Preventing microalbuminuria in type
2 diabetes. N Eng J Med 2004;351(19):1941-51.
21. Parving HH, Lehnert H, Brochner-Mortensen J et al. The effect of irbesartan
on the development of diabetic nephropathy in patients with type 2 diabetes. N
Engl J Med 2001;345(12):870-8.
22. Viberti G, Wheeldon NM, MARVAL Study Investigators. Microalbuminuria
reduction with valsartan in patients with type 2 diabetes mellitus: a blood pres-
sure-independent effect. Circulation 2002;106(6):672-8.
23. Mogensen CE, Neldam S, Tikkanen I et al. Randomised controlled trial of
dual blockade of renin-angiotensin system in patients with hypertension, microal-
buminuria and non-insulin dependent diabetes: the candesartan and lisinopril
microalbuminuria (CALM) study. Br Med J 2000;321(7274):1440-4.
24. Brenner BM, Cooper ME, de Zeeuw D et al. Effects of Losartan on renal and
cardiovascular outcomes in patients with type 2 diabetes and nephropathy.
N Engl J Med 2001;345(12):861-9.
THÉRAPEUTIQUE

THÉRAPEUTIQUE
25. Lewis EJ, Hunsicker LG, Clarke WR et al. Renoprotective effect of the angio-
tensin-receptor antagonist irbesartan in patients with nephropathy due to type 2
diabetes. N Engl J Med 2001;345(12):851-60.
26. Nakao N, Yoshimura A, Morita H et al. Combination treatment of angioten-
sin II-receptor blocker and ACE inhibitor in non-diabetic renal disease: a rando-
mised controlled trial. Lancet 2003;361:117-24.
27. Barnett AH, Bain SC, Bouter P et al. Angiotensin-receptor blockade versus
converting-enzyme inhibition in type 2 diabetes and nephropathy. N Engl J Med
2004;351(19):1952-61.
28. White WB, Larcourcière Y, Davidai G et al. Effects of the angiotensin II
receptor blockers telmisartan versus valsartan on the circadian variation of
blood pressure: impact on the early morning period. Am J Hypertens 2004;17(4):
347-53.
29. Lacourcière Y. A prospective randomized investigation of the safety and effi-
cacy of telmisartan versus ramipril in mild-to-moderate hypertensives using
ambulatory pressure monitoring. Hypertension 2004;44:576.
30. Yamagishi S, Takeuchi M. Telmisartan is a promising cardiometabolic sartan
due to its unique PPAR-g inducing property. Med Hypotheses 2005;64(3):476-8.
31. Smith DHG. Treatment of hypertension with an Angiotensin II-receptor anta-
gonist compared with an ACE inhibitor: a review of clinical studies of telmisartan
and enalapril. Clin Ther 2002;24:1484-501.
32. Hope Study Investigators. Effects of ramipril on cardiovascular and micro-
vascular outcomes in people with diabetes mellitus: results of the Hope study and
MICRO-HOPE substudy. Lancet 2000;355:253-9.
33. Teo K,Yusuf S, Sleight P et al., the ONTARGET/TRANSCEND investigators.
Rationale,design, and baseline characteristics of 2 large, simple, randomised
trials evaluating, telmisartan, ramipril, and their combination in high-risk
patients: the ongoing telmisartan alone and in combination with ramipril global
endpoint trial/telmisartan randomized assessment study in ace intolerant subjets
with cardiovascular disease (ONTARGET/TRANSCEND) trials. Am Heart J
2004;148(1):52-61.
Merci d’écrire nom et adresse en lettres majuscules
wCollectivité .................................................................................
à l’attention de ..............................................................................
wParticulier ou étudiant
M., Mme, Mlle ................................................................................
Prénom ..........................................................................................
Pratique : whospitalière wlibérale wautre..........................
Adresse e-mail ...............................................................................
Adresse postale .............................................................................
......................................................................................................
Code postal ........................Ville ……………………………………
Pays................................................................................................
Tél..................................................................................................
Merci de joindre votre dernière étiquette-adresse en cas de réabonnement,
changement d’adresse ou demande de renseignements.
ÉTRANGER (AUTRE QU’EUROPE)
FRANCE/DOM-TOM/EUROPE
¾140
€collectivités
¾116
€particuliers
¾80
ێtudiants*
*joindre la photocopie de la carte
¾120
€collectivités
¾96
€particuliers
¾60
ێtudiants*
*joindre la photocopie de la carte
LC 381
OUI, JE M’ABONNE AU MENSUEL La Lettre du Cardiologue
Total à régler .......... €
À remplir par le souscripteur
À remplir par le souscripteur
À découper ou à photocopier
ABONNEMENT : 1 an
+
ETPOUR 10 €DE PLUS !
10
€
, accès illimité aux 22 revues de notre groupe de presse disponibles sur notre
site vivactis-media.com (adresse e-mail gratuite)
+
R
RELIURE
ELIURE
¾10
€
avec un abonnement ou un réabonnement
MODE DE PAIEMENT
¾
carte Visa, Eurocard Mastercard
N°
Signature : Date d’expiration
¾
chèque
(à établir à l'ordre de La Lettre du Cardiologue)
¾
virement bancaire à réception de facture
(réservé aux collectivités)
EDIMARK SAS - 62-64, rue Jean-Jaurès - 92800 Puteaux
Tél. : 01 41 45 80 00 - Fax : 01 41 45 80 25 - E-mail : [email protected]
¾
1
/
5
100%