La glycémie post-prandiale

Collection Sucre et Santé
N°10
La glycémie
post-prandiale
De la physiologie
à la pathologie

sommaire
3
AVANT PROPOS
POUR MIEUX COMPRENDRE…
1 - La glycémie post prandiale :
au commencement était la physiologie…
a) Etat de jeûne, post-prandial, post absorptif
b) Par quels mécanismes l’hyperglycémie post-prandiale
est-elle maîtrisée ?
2 - De la tolérance à l’intolérance au glucose
a) L’état post-prandial, premier touché.
b) Peut-on inverser la tendance et prévenir le diabète de type 2 ?
3 - En chemin vers le diabète avéré
a) L’installation du « triumvirat » biologique :
de l’insulinosécrétion, de la sensibilité des tissus
périphériques à l’insuline, de la production hépatique
de glucose.
b) Hyperglycémie postprandiale et HbA1c chez le diabétique
de type 2
4 - Les risques liés à l’hyperglycémie post-prandiale
EN PRATIQUE
Interview de l’expert clinicien et chercheur
POUR CONCLURE
3
4
4
11
12
13
18
16
19
9
9
10
11
5
4
La glycémie post-prandiale est un sujet d’actualité dont l’enjeu
est majeur pour les patients. En effet, le lien entre le risque
cardio-vasculaire et le fait d’avoir une glycémie post-prandiale
élevée a été bien démontré, et ce lien existe bien avant l’apparition du
diabète. Pour autant, lien statistique n’a jamais signifié relation directe
de cause à effet. Il n’est toujours pas fermement établi à ce jour que le
contrôle isolé de la glycémie post-prandiale puisse prévenir les évène-
ments cardio-vasculaires. Mais, me direz-vous, dans le doute, pourquoi
ne pas le faire ? Pourquoi ne devrait-on pas appliquer le sacro-saint
« principe de précaution », et faire baisser la glycémie post-prandiale
au cas où cela puisse être bénéfique pour les patients ? La réponse est
simple : parce qu’avant le stade de diabète cela demanderait un
investissement considérable de la part des patients (des mesures répétées
de glycémies capillaires en particulier), et souvent sans succès. Et parce
qu’au stade de diabète vouloir normaliser avec des traitements
hypoglycémiants la glycémie post-prandiale au-delà d’un bon équilibre
glycémique moyen (une « bonne » HbA1c), augmente considérablement
le risque d’hypoglycémies sévères. Pour autant, connaître les mécanismes
qui concourent à augmenter la glycémie post prandiale, et les moyens
pour la faire diminuer ne sont pas inutiles ! Ces moyens avant l’appari-
tion du diabète sont la diététique et l’activité physique. Mais ils peuvent
être mis en place dans le cadre d’une prévention globale visant à
obtenir un changement profond de mode de vie, sans rendre le patient
obnubilé par ses glycémies post-prandiales. Et lorsque le diabète est
diagnostiqué, la baisse de l’HbA1c peut nécessiter la maîtrise des montées
glycémiques liées aux repas. Mais ne faisons pas d’un moyen, une fin.
Pr Agnès Hartemann-Heurtier
Service de Diabétologie
Pitié-Salpêtrière - Paris
Avant Propos

4 5
1Monnier L, Colette C. La glycémie post prandiale : du normal au pathologique. 48ème JAND, Paris, 25 janvier 2008.
2Girard et al. L’hyperglycémie post prandiale chez le diabétique de type 2. Médecine Clinique endocrinologie et diabète. 2003 ; HS N°1 :
12-16.
3American Diabetes Association. Standards of medical care in diabetes - 2007. Diabetes Care. 2007; 30(suppl. 1): S4-S41.
4Scheen AJ, Paquot N. Physiopathologie de l’hyperglycémie post prandiale. Journées de Diabétologie de l’Hôtel Dieu 2006. pp 47-65. Flammarion
Médecine-Sciences (www.medecine.flammarion.com)
Pour mieux comprendre…
1 - La glycémie post-prandiale :
au commencement était la
physiologie…
Chez l’individu sain, la glycémie est
étroitement contrôlée, tant à l’état de
jeûne que durant les périodes post-
prandiales. Cette régulation repose sur
la production de glucose par l’organis-
me, qui est modulée à la fois par l’ap-
port de glucides exogènes et par l’uti-
lisation du glucose, et la sécrétion
d’insuline qui maintient l’homéostasie
glucidique.
Les apports en glucides, s’ils sont
répétés au cours de la journée, fluc-
tuent par ailleurs d’un individu à
l’autre et chez une même personne
selon le moment et les circonstances.
De plus, certains tissus nécessitent
pour leur fonctionnement un approvi-
sionnement continu en glucose
(cerveau, globules rouges…), d’autres
ont des besoins éminemment
variables comme le muscle squelet-
tique (contraction musculaire).
Une bonne connaissance des méca-
nismes de régulation physiologique de
la glycémie au décours de la prise ali-
mentaire, permet d’appréhender plus
finement les choix thérapeutiques de
prise en charge de la glycémie post
prandiale « pathologique » du diabétique.
a) Etat de jeûne, post-prandial,
post absorptif1…
Au cours des 24h, l’organisme passe
par 3 états qui se succèdent selon le
rythme des repas, tout en se chevau-
chant notablement :
•l’état post-prandial qui suit immé-
diatement le repas et dure environ
4 heures. Durant cette phase, les
glucides alimentaires subissent une
hydrolyse enzymatique dans le tube
digestif. Les monosaccharides pro-
duits sont ensuite absorbés pour se
retrouver dans la circulation généra-
le, via le système porte. Chez le
sujet sain, la glycémie y décrit un
pic hyperglycémique puis regagne la
ligne basale. La régulation glycé-
mique est ainsi assurée par la sécré-
tion d’insuline et la réduction
concomitante de la glucagonémie2.
•l’état post absorptif, est l’interval-
le de temps qui succède à l’état
postprandial et s’étend sur les
6 heures suivantes. Pendant cette
période, chez le sujet non diabé-
tique, la glycémie se maintient dans
des valeurs normales. L’utilisation
métabolique du glucose est compen-
sée progressivement par une produc-
tion de glucose endogène par glyco-
génolyse hépatique.
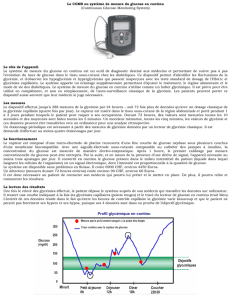
Figure 1
Durées des périodes post
prandiales post absorptives
et de jeune (Monnier L 2000).
Les périodes post-prandiales
et post absorptives se
chevauchant, l’ensemble de
l’état post absorptif correspond
à une dizaine d’heures.
•l’état de jeûne, proprement dit,
débute à la fin de la période post
absorptive, soit 10-12h après le
début du dernier repas. Au cours des
états post absorptif et de jeûne, la
glycémie demeure dans les limites
de la normale, grâce à une transition
graduelle de la production hépa-
tique du glucose, de la glycogénoly-
se vers la glyconéogenèse à partir
de lactates, d’alanine ou de glycérol.
Au final, chez une personne non dia-
bétique faisant 3 repas à heure fixe
par jour, on peut estimer la durée de
sa période post-prandiale à environ
12 heures (3 fois 4 heures), celle de sa
période de jeûne à 3-4 heures en fin
de nuit et celle de sa période post
absorptive à environ 10 heures du fait
du relatif chevauchement de ces phases
(repas rapprochés).
b) Par quels mécanismes
l’hyperglycémie post-prandiale
est-elle maîtrisée ?
Un individu normal passant la moitié
de sa vie en état post-prandial, il est
légitime de s’interroger sur les facteurs
qui permettent à la glycémie de varier,
durant ces périodes, dans un couloir
limité tant en durée qu’en amplitude. A
cet égard, on peut rappeler qu’une
glycémie post-prandiale, après une
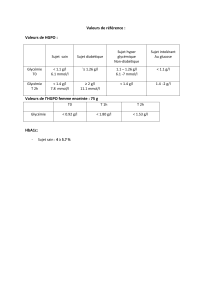
charge de 75g de glucose chez un
sujet non diabétique, est considérée
comme normale si elle reste au
dessous du seuil de 140mg/dl
(7,8mmol/l) au bout de 2 heures3.
Différents éléments concourent à
contrôler la glycémie post-prandiale
(tableau 1), faisant intervenir des
organes clés : le tractus digestif, le foie,
le pancréas endocrine et le muscle strié4.

6 7
•Facteurs nutritionnels
Les glucides, par leur nature, la quan-
tité ingérée et la composition du
repas qui les accompagne, condition-
nent la vitesse et l’amplitude du pic
glycémique post-prandial. La meilleure
connaissance de leur impact a conduit
à la formulation du concept d’index
glycémique5, paramètre permettant
de classer les aliments glucidiques
selon l’influence qu’ils exercent sur la
glycémie post-prandiale (Tab 2). Plus
un aliment possède un index glycé-
mique élevé, plus il provoquera un pic
glycémique important. Outre la com-
position en glucides, l’index glycé-
mique est lui même influencé par dif-
férents facteurs tels que le mode de
préparation de l’aliment considéré et
les autres aliments pris en même
temps (fibres et lipides notamment).
•Facteurs gastro-intestinaux
La vidange gastrique, par le biais de sa
vitesse, influence le pic hyperglycémique
post prandial. Elle est accélérée par
action neurologique vagale et modulée
par voie hormonale : la Motiline accroit
le péristaltisme contrairement au Gastric
Inhibitory Peptide (GIP), au Glucagon
Like Peptide 1(GLP-1) et à l’Amyline qui
ont un effet inverse. Outre ces régula-
tions, neurologique et endocrinienne, la
vitesse de la vidange gastrique subit des
influences multiples, qu’elles soient phy-
siologiques comme la composition du
repas, l’osmolarité du contenu gastrique
voire la glycémie elle-même, ou bien
pathologiques telles que la neuropathie
vagale avec gastroparésie du diabétique.
Comme dernier exemple citons le dum-
ping syndrome qui illustre l’accélération
de la vidange gastrique post gastrecto-
mie partielle, responsable de symptômes
5Wolever TM, Jenkins DJ, Jenkins AL, et al. The Glycemic Index : methodology and clinical implications. Am J Clin Nutr. 1991; 54: 846-854.
Tableau 1 : Facteurs influençant
la glycémie après un repas :
Facteurs nutritionnels
- Quantité des glucides ingérés
- Nature des glucides ingérés
- Présence concomitante d’autres nutriments
Facteurs gastro-intestinaux
- Vidange gastrique
- Digestion intra-luminale des glucides
- Absorption intestinale du glucose
Facteurs hormonaux
- Sécrétion des hormones intestinales
(GLP-1, GIP,…)
- Sécrétion des hormones pancréatiques
(insuline, glucagon, amyline…)
Facteurs métaboliques
- Oxydation du glucose
- Métabolisme du glucose via la glycolyse
- Stockage sous forme de glycogène
hépatique et musculaire
- Inhibition de la production hépatique
du glucose
(d’après Scheen et al. 4)
Glucides
à index
glycémique
élevé (>70)
Glucides
à index
glycémique
moyen (55-70)
Glucides
à index
glycémique
bas (<55)
Tableau 2 : Index glycémique de quelques aliments
Glucides simples Glucides complexes
Glucose (100)
Boisson gazeuse (97)
Gaufres (76)
Barre chocolatée (70)
Saccharose (sucre de table) (65)
Ananas (59), betterave (64)
Crème glacée (61)
Biscuit type petit beurre (60)
Miel (58)
Fructose (20), lactose (46)
Abricot sec (31), carotte (47)
Pamplemousse (25),
pomme (38), poire (38),
orange (42)
Soja (18), petits pois (50)
Chocolat (50)
Jus d’orange (53)
Kiwi (53), banane (52),
mangue (51), raisin (46)
Pommes de terre au four (85)
Purée (80), frites (75)
Céréales de petit déjeuner type
Corn Flakes (75)
Baguette (95), pain blanc (70)
Pain complet (77)
Riz brun (76) et riz “gluant” (98)
Vermicelle (58)
Riz basmani (58), riz blanc (60)
Porridge (58), muesli (55)
Pomme de terre chips (57),
patate douce (61)
Semoule de couscous (65)
Lentille (30), haricot sec (30),
pois chiche (28)
Haricot rouge (28),
haricot blanc (38)
All bran (33)
Pâtes aux œufs (40)
Pain aux céréales (45),
au son (44), de seigle (50)
Spaghetti (42), nouille (47)
Riz complet (41)
et potentiellement d’une hypoglycé-
mie réactionnelle.
La digestion enzymatique des glu-
cides puis leur absorption par la
muqueuse intestinale jouent un rôle
dans la régulation de la glycémie post
prandiale. Ce rôle est d’ailleurs pris en
compte dans la stratégie thérapeu-
tique du diabète, tant par l’élabora-
tion de conseils nutritionnels que dans
le mécanisme d’action d’antidiabé-
tiques oraux. Ainsi, l’acarbose limite
l’hyperglycémie post-prandiale en
inhibant la digestion des glucides ali-
mentaires par les α-glucosidases, et
la metformine parmi d’autres actions,
favoriserait la métabolisation en lac-
tate du glucose absorbé par l’entéro-
cyte, via la glycolyse anaérobie6.
6Bailey CJ. Metformin and intestinal glucose handling. Diabetes Metab Rev. 1995; 11suppl(1): S23-S32.

8 9
pancréatique et entéro-pancréatique. La
sécrétion de l’hormone est précoce et
pulsatile. L’altération de la pulsatilité,
associée à une baisse quantitative de la
production est d’ailleurs une des compo-
santes essentielles du diabète de type 2.
L’hyperglycémie post-prandiale inhi-
be, chez le sujet sain, la production
de glucagon, s’opposant ainsi à la
glycogénolyse et à la glyconéogenè-
se hépatiques. En fait l’impact du glu-
cagon sur l’homéostasie glucidique en
période post-prandiale, n’est vraiment
évident que lorsque s’installe une rela-
tive carence insulinique.
•Facteurs métaboliques
L’utilisation périphérique du glucose
absorbé concerne principalement les
muscles, le foie et plus accessoirement le
rein. Au niveau de la fibre musculaire, le
glucose peut être oxydé ou stocké sous
forme de glycogène. Le foie, lui, modifie
son métabolisme par une captation pré-
férentielle et un stockage du glucose, en
parallèle d’une inhibition de la synthèse
de glucose endogène. Le rein semble
contribuer d’une manière un peu diffé-
rente à l’homéostasie glucidique post
prandiale, en augmentant sa propre syn-
thèse de glucose après le repas11. Ce phé-
nomène pourrait faciliter la reconstitu-
tion du glycogène hépatique en phase
post prandiale, le foie ne produisant pas
de glucose durant cette période.
A l’état sain, le pic insulinique précoce
et la sécrétion pulsatile d’insuline,
associés à la sensibilité des cellules
hépatiques et musculaires à l’action de
cette hormone, permettent de limiter
l’hyperglycémie post-prandiale en
intensité et en durée12-13. Schématique-
ment, le pic glycémique ne dépasse pas 2
heures alors que le passage des glucides
au travers de la barrière intestinale dure
plus de 4 heures. En amplitude, il est
considéré comme normal s’il n’excède pas
140mg/dl (7,8 mmol/l) 2 heures après
ingestion de 75g de glucose.
2 - De la tolérance à
l’intolérance au glucose…
a) L’état post-prandial, le premier
touché…
L’hyperglycémie post prandiale survient
tôt dans le syndrome métabolique et le
diabète de type 214. Au stade de syndro-
me métabolique, s’installe une intolé-
rance au glucose qui se manifeste par
une glycémie à jeun qui reste normale
(inférieure à 1g10/l) ou modérément
7Gautier JF, Fetita S, Sobngwi E, et al. Biological actions of the incretins GIP and GLP-1 and therapeutic pertspectives in patients with type 2
diabetes. Diabetes Metab. 2005; 31: 233-242.
8Thorens B. L’axe entéro-insulaire : rôle de l’intestin et régulation glycémique. Journées de Diabétologie de l’Hôtel Dieu 2006. pp 67-73.
Flammarion Médecine-Sciences (www.medecine.flammarion.com).
9Girard J. Rôle des hormones digestives dans la régulation glycémique. 48èmes JAND, Paris, 28 janvier 2008.
10Gautier JF, Choukem SP, Girard J. Physiology of incretins (GIP and GLP-1) and abnormalities in type 2 diabetes. Diabetes Metab. 2008; 34:
S65-S72.
11Meyer C, Dostou JM, Welle SL, et al. Role of human liver, kidney and squeletal muscle in post prandial glucose homeostasis. Am J Physiol.
2002; 282: E419-E427.
12Gerich JE. Control of glycaemia. Baillière’s Clin Endocrinol Metab. 1993; 7: 551-586.
13Lefebvre PJ, Scheen AJ. Glucose metabolism and the postprandial state. Eur J Clin Invest. 1999; 29(suppl2):1-6.
14Alberti KGMM. The clinical implications of impaired glucose tolerance. Diabetes Med. 1996; 13: 927-937.
L’effet « incrétine » : un concept pas si récent…
Initialement, la notion d’une régulation de la sécrétion endocrine par des facteurs digestifs, remonte au
début du XXème siècle7. Le concept d’effet « incrétine » proprement dit, a été formulé dans les années
20. Il correspond à une action insulinosécrétrice du glucose, plus puissante si celui-ci est pris par voie
orale que s’il est administré par voie parentérale, cela grâce à des hormones peptidiques intestinales.
Les incrétines GIP et GLP-1, identifiées en 878, sont issues respectivement des cellules K du duodénum
et L de l’intestin grêle et du colon. Elles ont pour rôle de favoriser une utilisation rapide des nutriments
absorbés (glucose et triglycérides)9. Leur action directe sur les cellules βpancréatiques s’exerce après fixa-
tion sur des récepteurs transmembranaires spécifiques. Leurs effets communs sont une stimulation de l’in-
sulinosécrétion glucose-dépendante, et un contrôle de la masse fonctionnelle des cellules β. Cette derniè-
re propriété, constatée in vitro et in vivo mais uniquement chez l’animal, témoigne d’une adaptation au long
cours pouvant résulter d’une stimulation des cellules précurseurs, d’une prolifération des lignées matures
et d’une résistance à l’apoptose.
Intérêt des incrétines en thérapeutique antidiabétique
Leur intérêt repose en premier lieu sur le GLP-1 dont le taux plasmatique est abaissé chez le dia-
bétique de type 2 et l’intolérant au glucose10, contrairement à celui du GIP qui n’est pas modifié. De
surcroit, la réponse fonctionnelle à l’administration de GLP-1 (insulinosécrétion, inhibition du gluca-
gon et accélération de la vidange gastrique) est conservée alors que celle au GIP est altérée.
La médiocre stabilité in vivo du GLP-1 a mené les chercheurs sur 2 voies distinctes, l’élaboration
d’une part d’analogues de cette hormone comme l’exenatide, et d’autre part d’inhibiteurs de son
enzyme de dégradation, la dipeptidylpeptidase IV.
•Facteurs hormonaux
Outre une action sur la cinétique de la
vidange gastrique (voir précédemment),
certaines hormones gastro-intesti-
nales ont un pouvoir insulinosécré-
teur (Amyline, GIP, GLP-1) ainsi qu’un
effet inhibiteur sur différentes enzymes
digestives (Amyline) et sur la sécrétion
du glucagon (Amyline, GLP-1).
L’élément le plus connu de la régula-
tion hormonale de la glycémie post
prandiale est naturellement la réponse
insulinique. En dehors de la stimulation
liée aux hormones gastro-intestinales, et
au stimulus du glucose, la production
d’insuline résulte aussi d’efférences
vagales par le biais de la phase cépha-
lique et du réflexe vago-vagal gastro-
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%