M Diabète insipide révélateur d’une métastase pituitaire d’un adénocarcinome bronchique C

CAS CLINIQUE
192
La Lettre du Cancérologue - Volume XII - no5 - septembre-octobre 2003
M
onsieur L. M... est atteint d’un adénocarcinome
peu différencié du lobe supérieur du poumon
droit (T2 N0 M1), découvert en février 2001.
De façon synchrone, une lésion infracentimétrique cérébrale fron-
tale droite unique est diagnostiquée par IRM (figure 1).
La tomodensitométrie abdominale et la scintigraphie osseuse ne
montrent pas d’autres sites métastatiques.
Après trois cycles de chimiothérapie par carboplatine ASC 6 et
paclitaxel 175 mg/m2, une réponse objective est obtenue à la fois
sur la lésion pulmonaire et sur la lésion cérébrale. Cette réponse
étant maintenue après dix cycles de chimiothérapie, la décision
d’une radiothérapie de 19,5 Gy sur la lésion cérébrale en condi-
tion stéréotaxique est prise le 10 janvier 2002.
Cette radiothérapie est suivie d’une lobectomie supérieure droite
le 22 janvier 2002 (T1 N0 sur la pièce opératoire).
Le patient est régulièrement surveillé, avec, en mai 2002, une
IRM cérébrale de contrôle sans anomalie.
En octobre 2002, il apparaît simultanément une asthénie
majeure, des troubles visuels à type de diplopie et surtout un syn-
drome polyuro-polydypsique avec une diurèse entre 4 à 6 litres
par jour, faisant suspecter un diabète insipide. Les examens bio-
logiques confirment le diabète insipide avec une osmolalité san-
guine de 285,5 mosm/kg d’eau. Le bilan urinaire : créatinurie :
1,4 mM (N = 9,6-14), sodium urinaire : 32 mM (N = 95-310),
potassium urinaire : 20 mM (N = 9,4-14), magnésium urinaire :
0,4 (N = 2,5-8,3), phosphate urinaire : 1,9 (N = 10-33), et le
bilan endocrinien retrouve une insuffisance hypophysaire, avec :
TSH : 0,06 mUI/l (N = 0,2-4,5), T4 libre : 12 pMol/l (N = 1-5),
T3 libre : 1,9 pMol/l (N = 3-7), FSH : 0,11 UI/l (N = 1-7), LH
inf 0,1 UI/l (N = 1-5), testostérone totale : 4,7 nMol/l (N = 9,4-
37), cortisol 8 h : 45 nMol (N = 345-662).
Le syndrome polyuro-polydypsique est amélioré par l’épreuve
de restriction hydrique et sous traitement par desmopres-
sine (Minirin®0,1 mg/j). Ce traitement est associé à un
traitement substitutif par hydrocortisone et Lévothyrox®.
L’IRM du 14 octobre 2002 (figure 2) met en évidence une lésion
Diabète insipide révélateur d’une métastase pituitaire
d’un adénocarcinome bronchique
●
K. Chouahnia, V. Andriambololona, J.L. Breau*
* Service d’oncologie médicale, hôpital Avicenne, 93009 Bobigny Cedex
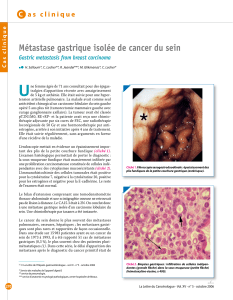
Figure 1.
Coupe axiale.
Lésion frontale
droite. IRM
de février 2001.
Figure 2.
Coupe
coronale.
Masse
suprasellaire
2,1 x 2,2 cm,
refoulement
du troisième
ventricule
sans dilatation
ventriculaire.
IRM
du 14 octobre
2002.
…/…

195
La Lettre du Cancérologue - Volume XII - no5 - septembre-octobre 2003
tumorale dans la région intra- et suprasellaire avec envahissement
du chiasma optique et de la loge pituitaire.
On note par ailleurs une absence de reprise évolutive des méta-
stases, en particulier cérébrales.
Après concertation, une exérèse chirurgicale par abord sous-fron-
tal est réalisée le 22 novembre 2002.
L’exérèse de la lésion tumorale de la région pituitaire peut être
effectuée, mais de façon incomplète en raison des adhérences
vasculaires.
L’étude histologique confirme la métastase de l’adénocarcinome
bronchique (TTF1 positif). Une radiothérapie complémentaire de
30 Gy en dix fractions est pratiquée en janvier 2003, prenant
l’ensemble de l’encéphale en incluant les citernes de la base.
Une surveillance est maintenue sans signe de reprise évolutive
tumorale en août 2003, date de la dernière consultation.
DISCUSSION
Des métastases cérébrales sont observées dans 15 à 20 % de
l’ensemble des cancers (1), et la localisation au niveau de la
glande pituitaire est observée dans 1 à 5 % des cas autopsiés (2).
Le cancer du sein et le cancer bronchique restent les sites pri-
mitifs le plus fréquemment retrouvés (3) respectivement dans 33
et 36 % des cas (4).
L’atteinte hypophysaire est retrouvée dans 8 % des cas de
cancer bronchique (8), et peut, par ailleurs, s’intégrer dans un
tableau d’atteinte cérébrale multiple (9).
Les métastases pituitaires, quelle que soit la tumeur primitive,
peuvent s’observer à tout âge (entre 19 et 84 ans chez la femme
et 23 et 83 ans chez l’homme) (10). Un cas de métastase pitui-
taire d’un cancer bronchique chez un patient de 21 ans a été
rapporté (7).
D’autres cancers primitifs peuvent être à l’origine de cette loca-
lisation métastatique, comme le cancer de l’estomac, de la pros-
tate, de la vessie et l’hépatocarcinome (3, 11, 12).
Dans 41,7 % des cas, la métastase est révélatrice d’un cancer
méconnu (6). Le diagnostic éventuel se pose essentiellement avec
l’adénome pituitaire, qui reste la tumeur la plus fréquente de la
région (6).
Les métastases diffuses à l’ensemble de la glande pituitaire ne
sont pas rares (5). Les manifestations cliniques initiales ne sont
présentes que dans 5 à 15 % des cas. Le diabète insipide peut
être la première manifestation clinique quelle que soit la tumeur
primitive (4, 6, 9, 10, 13, 15, 16). Les autres signes le plus fré-
quemment rapportés sont une paralysie de la troisième paire
crânienne et des céphalées rétro-orbitaires (3, 5).
Dans le cas clinique rapporté, le syndrome polyuro-polydypsique
a été la première manifestation clinique endocrinienne révéla-
trice de l’insuffisance pituitaire.
La rapidité de l’installation et de la progression des symptômes
endocriniens doit faire évoquer une métastase pituitaire (9).
L’apparition d’un diabète insipide est fortement évocatrice de
métastases (4, 13).
L’atteinte du lobe postérieur de la glande pituitaire est le plus sou-
vent siège de la métastase. Cela pourrait être expliqué par la vas-
cularisation propre de ce lobe (10).
L’IRM avec l’injection de gadolinium est l’examen radiologique
de référence.
Le traitement de cette localisation métastatique n’est pas
univoque (15). Il doit être discuté d’une part en fonction de
l’évolution métastatique et, d’autre part, du contrôle de la
tumeur primitive.
Il a pour objectif premier d’améliorer, outre la survie, la
qualité de cette survie par décompression des voies optiques et
prévention ou amélioration des phénomènes de compression
ventriculaire.
Le traitement chirurgical peut être proposé, comme dans ce cas
clinique, chez des patients en bon état général sans évolutivité,
avec un recul suffisant de leur pathologie cancéreuse primitive
et métastatique. Cet acte chirurgical peut être complété par une
radiothérapie de l’encéphale in toto avec prise de la région
hypophysaire dans le volume irradié.
Des médianes de survie de douze mois ont pu ainsi être
observées (3).
La radiothérapie palliative, associée à un traitement endocrinien
substitutif, demeure le traitement de première intention en cas de
pathologie tumorale par ailleurs non contrôlée.
■
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Posner JB. Management of brain metastases. Rev Neurol (Paris) 1992 ;
45 : 357-63.
2. Chiang MF, Brock M, Patt S. Pituitary metastases. Neurochirurgia 1990 ;
33 : 127-31.
3. Aung TH, Po YC, Wong WK. Hepatocellular carcinoma with metastasis to
the skull base, pituitary gland, sphenoid sinus, and cavernous sinus. Hong
Kong Med J 2002 ; 8 : 48-51.
4. Morita A, Meyer FB, Laws ER Jr. Symptomatic pituitary metastases. J Neu-
rosurg 1998 ; 89 : 69-73.
5. Robert J, Weil MD. Pituitary metastasis. Arch Neurol 2002 ; 59.
6. Ntyonga-Pono MP, Thomopoulos P, Luton JP. Les métastases hypophy-
saires. Presse Med 1999 ; 28 : 1567-71.
7. Ito I et al. Hypopituitarism due to pituitary metastasis of lung cancer : case
of a 21-year-old man. Intern Med 2001 ; 40, 5 : 414-7.
8. Halpert B, Erickson E, Fields W. Intercranial involvement from carcinoma
of the lung. Arch Pathol 1960 ; 69 : 93.
9. Arthur Skarin MD, Consultant Editor : Diabetes insipidus as the initial
manifestation of non-small-cell lung cancer. J Clin Oncol 2002 ; 20, 23 :
4597-602.
10. Teears RJ, Silverman EM. Clinicopathologic review of 88 cases of carci-
noma metastatic to the pituitary gland. Cancer 1975 ; 36 : 216-20.
11. Asa SL. Tumors of the pituitary gland. Washington DC : Armed Forces
Institute of Pathology 1998 : 187-9.
12. Thapar K, Kovacs K. Neoplasms to the sellar region. In : D.D. Bigner,
R.E. McClendon, J.M. Bruner, eds. Russell and Rubinstein’s pathology of
tumors of the nervous system. 6th ed. New York, NY : Oxford University Press
1998 : 561-677.
13. Krol TC, Wood WS. Bronchogenic carcinoma and diabetes insipidus.
Cancer 1982 ; 49 : 596-9.
14. Kimmel DW, O’Neill BP. Systemic cancer presenting as diabetes insipi-
dus. Cancer 1983 ; 52 : 2355-8.
15. Pinet C, Raholimina V, Ferri RM, Kleisbauer JP. Panhypopituitarisme
secondaire à une métastase hypophysaire. Presse Med 2000 ; 29 : 17-8.
16. Sioutos P, Yen V, Arbit E. Pituitary gland metastases. Ann Surg Oncol
1996 ; 3 : 94-9.
…/…
1
/
2
100%