AP C 2005 : I X

La Lettre du Cardiologue - n° 394 - avril 2006
11
INFORMATIONS
EXCLUSION PERCUTANÉE DE L’AURICULE
GAUCHE
(D’après la communication du Pr A. Vahanian)
L’auricule gauche est un “sac” appendu à l’oreillette gauche, sans
fonction spécifique connue, où se forment la majorité des thrombi
intracardiaques emboligènes. Dans la fibrillation auriculaire (FA)
non valvulaire, la majorité des thrombi proviennent de l’auricule
gauche.
Afin d’éviter la formation d’un thrombus emboligène chez les
patients en FA ayant des contre-indications au traitement anti-
coagulant, une thérapeutique séduisante est l’exclusion de l’au-
ricule gauche. Plusieurs techniques ont été décrites :
– la ligature au cours du remplacement valvulaire mitral,
– l’oblitération par minithoracotomie,
– la ligature systématique au cours d’un pontage aorto-corona-
rien, pour laquelle un essai randomisé est actuellement en cours,
– l’exclusion percutanée de l’auricule, technique développée au
cours de cet exposé.
L’indication clinique doit être posée conjointement par un car-
diologue et un neurologue, après élimination des contre-indica-
tions : thrombose de l’oreillette ou de l’auricule gauche, défor-
mation thoracique sévère, anomalie de l’hémostase. Le geste doit
se dérouler dans un centre médico-chirurgical, sous anesthésie
générale et sous contrôle ETO (échographie transœsophagienne)
permanent. L’implant PLAATO est le modèle d’implant majori-
tairement utilisé. Il est constitué d’une cage de nitinol recouverte
d’une membrane en PTFE (figure 1) et d’ergots permettant son
accrochage dans l’auricule gauche, évitant toute migration ulté-
rieure.
Un cathétérisme transseptal est initialement réalisé sous contrôle
ETO, et le guide est positionné dans l’oreillette gauche. L’injec-
tion de produit de contraste permet de visualiser l’auricule, de le
mesurer et de déterminer la taille de l’implant. Celui-ci est ensuite
mis en place et déployé. Une nouvelle injection de produit de
contraste permet alors de vérifier le bon positionnement du sys-
tème et l’exclusion totale de l’auricule, puis la prothèse est lar-
guée. Après la pose de ce système, le patient reçoit une double
antiagrégation plaquettaire par aspirine + clopidogrel, puis par
aspirine seule à vie. Une antibioprophylaxie de l’endocardite
infectieuse est réalisée pendant 6 mois. Le suivi comprend une
radiographie pulmonaire et une ETO à 4 semaines puis à 6 mois,
ainsi qu’un suivi clinique tous les 6 mois (figure 2).
* Service de cardiologie, hôpital Saint-Antoine, Paris.
** Service de cardiologie, hôpital Ambroise-Paré, Boulogne.
APIC 2005 : XIX
e
Journée de l’Association
pour l’information cardiologique
●
A.S. Béraud*, S. Langlois**
Membrane
en PTFE
Ergots
Cage de
nitinol
Figure 1. L’implant PLAATO.
Figure 2. Suivi radiologique, ETO et scannographique après exclusion
de l’auricule gauche par PLAATO.

La Lettre du Cardiologue - n° 394 - avril 2006
12
INFORMATIONS
Une étude de faisabilité de l’implant PLAATO (Hanna et al.
J Am Coll Cardiol 2004;43:1868-72) a été réalisée sur 111 pa-
tients présentant une fibrillation auriculaire avec un haut risque
d’accident vasculaire cérébral (AVC) embolique, et une
contre-indication aux anticoagulants (antécédent de saigne-
ment grave, international normalized ratio [INR] très instable,
chutes à répétition, problèmes de compliance thérapeutique,
etc.). Les critères d’exclusion étaient la présence d’un throm-
bus dans l’auricule gauche, une contre-indication au cathété-
risme transseptal, une chirurgie, un AVC ou un infarctus
récents, une maladie aortique, valvulaire ou carotidienne
récente. Au total, 98 % des patients ont pu être implantés. Les
complications surviennent le plus souvent lors de l’appren-
tissage de la technique : tamponnade (3,7 %), épanchement
péricardique (4,6 %), complications hémorragiques liées à la
ponction veineuse (2,7 %). Les patients ont été suivis pendant
12,5 mois en moyenne. Huit décès ont été constatés (7,4 %),
aucun n’étant en rapport avec la procédure ni la prothèse. Le
taux de récidive après implantation de PLAATO était de 2,7 %
pour les accidents ischémiques transitoires (AIT) et de 2,7 %
pour les AVC. Sur les échocardiographies transthoraciques
(ETT) de contrôle, il a été retrouvé deux thrombi sans élément
mobile (1,8 %).
Au total, chez ces patients, il a été constaté un taux de récidive
d’AVC de 2,7 %, nettement inférieur au taux attendu de 6,3 %
(selon la classification CHADS, qui stratifie le risque).
En conclusion, l’exclusion de l’auricule gauche percutanée per-
met une réduction significative du risque de récidive d’AVC chez
les patients présentant une fibrillation auriculaire avec une contre-
indication formelle aux anticoagulants. La technique d’implan-
tation nécessite un centre expérimenté de cardiologie interven-
tionnelle, expert en cathétérisme transseptal. Actuellement, les
objectifs sont la définition d’une population cible à haut risque,
une meilleure évaluation de l’anatomie de l’auricule gauche, la
poursuite des études de faisabilité et la réalisation d’études ran-
domisées.
INFARCTUS DU MYOCARDE : TIME IS MUSCLE
(D’après la communication du Pr G. Steg)
À la phase aiguë de l’infarctus du myocarde, la rapidité de revas-
cularisation est primordiale et conditionne le pronostic vital et
fonctionnel à court et à long terme.
Lorsqu’elle a lieu rapidement et dans un centre expérimenté,
l’angioplastie primaire a montré sa supériorité par rapport à la
thrombolyse hospitalière. Cependant, la majorité des patients
ne sont pas admis initialement dans les centres pouvant prati-
quer une angioplastie primaire à tout moment. Plusieurs atti-
tudes peuvent alors être envisagées : transfert immédiat pour
une angioplastie, thrombolyse sur place, ou bien thrombolyse
puis transfert.
Une méta-analyse publiée par M. Dalby dans Circulation en 2003
plaide en faveur du transfert pour angioplastie primaire plutôt
que de la thrombolyse, sauf si celle-ci peut être pratiquée en pré-
hospitalier (figure 3).
Délai douleur-traitement de reperfusion
Plus une thrombolyse est réalisée rapidement, plus elle est effi-
cace, et le gain le plus important est obtenu avant la sixième heure.
En effet, l’effet de la thrombolyse sur la taille de l’infarctus est
d’autant plus grand que celle-ci est précoce. De plus, les traite-
ments thrombolytiques sont beaucoup plus efficaces sur les
caillots frais.
Lorsqu’il est possible de réaliser une angioplastie primaire, le
temps est également un facteur essentiel, d’autant plus important
que l’artère est occluse au moment de la coronarographie
(figure 4). Le délai de reperfusion est ainsi un des facteurs pré-
dictifs de la mortalité à un an, et chaque retard de 30 minutes
augmente de 7,5 % le risque relatif de mortalité à un an.
Thrombolyse
préhospitalière
et transfert
Maastricht
PRAGUE
Air-Pami
CAPTIM
DANAMI 2
PRAGUE 2
Total 0,81 p = 0,86
Angioplastie Thrombolyse
5/75 5/75
Nombre d’événements/
nombre de patients randomisés
7/101 14/99
6/71 8/66
20/421 16/419
52/790 59/782
29/429 42/421
119/1887 144/1863
Risque relatif
0,2 342
1,00,70,50,3
Décès
Dalby M et al. Circulation 2003;108:1809-14.
Figure 3. Méta-analyse comparant le transfert pour angioplastie primaire
ou la thrombolyse (Dalby M et al. Circulation 2003).
Moins de 2 heures
2-4 heures
4-6 heures
Plus de 6 heures
p = NS
p = 0,013
16
14
12
10
8
6
4
2
0
5,3
2,7
5,9
0
4,1
5,5
9,2
12,7
Pre-PCI TIMI 2-3 Pre-PCI TIMI 0-1
De Luca G et al. J Am Coll Cardiol 2003;42:991-7.
Figure 4. Importance du délai de reperfusion sur la mortalité à un an en
fonction de la perméabilité de l’artère coupable.
Délais intrahospitaliers
Le délai de prise en charge intrahospitalière (délai écoulé entre
l’arrivée à l’hôpital et l’angioplastie) est un des facteurs prédic-
tifs de la mortalité intrahospitalière, avec un délai cible inférieur
à une heure (figure 5).
L’observation des registres a montré que le délai moyen intrahos-
pitalier pour une angioplastie était de 100 minutes, relativement
stable depuis 10 ans. Le délai moyen de transfert à partir d’un hôpi-
tal pour la réalisation d’une angioplastie primaire est de 185 minutes,

La Lettre du Cardiologue - n° 394 - avril 2006
13
INFORMATIONS
avec un temps de transport moyen de 130 minutes jusqu’à la salle
de coronarographie. Pour améliorer les délais avant reperfusion des
patients, le simple fait d’éviter les services d’urgences permet d’ac-
célérer la prise en charge spécialisée, donc de diminuer la morta-
lité à court et à moyen terme. La prise en charge des patients à leur
domicile par le Samu permet ainsi de gagner un temps précieux.
Délai douleur-présentation du patient
Le délai écoulé entre le début de la douleur et l’heure de la pre-
mière prise en charge médicalisée est primordial dans le choix de
la stratégie de revascularisation. En effet, si la première prise en
charge est précoce (< 2 heures), la réalisation d’une thrombolyse
préhospitalière permettra de gagner du temps, de diminuer la mor-
talité à un an (5,4 % pour la thrombolyse préhospitalière versus
7,3 % pour l’angioplastie primaire) et la mortalité globale (6,7
versus 8,8 %). Si le patient est pris en charge plus de 2 heures
après le début de la douleur, l’angioplastie primaire est supérieure.
L’impact des délais de prise en charge est différent
selon le moment
Il existe deux périodes pendant lesquelles la rapidité d’interven-
tion est capitale : très précocement jusqu’à 2 h 30, où la quantité
de myocarde nécrosé est directement proportionnelle au temps
écoulé, et entre les sixième et douzième heures, où apparaît le
bénéfice, notamment rythmique, de l’artère perméable (figure 6).
En conclusion, le temps est le facteur essentiel dans la prise en
charge de l’infarctus du myocarde à la phase aiguë. Le délai
entre le début des symptômes et la reperfusion peut être décom-
posé en plusieurs temps : le délai entre la douleur et la première
prise en charge, les délais de prise en charge spécialisée intra-
hospitalière et le délai de reperfusion. De plus, l’importance du
délai d’action dépend du délai écoulé depuis l’appparition de la
douleur. Enfin, plusieurs facteurs influent sur le choix initial de
la stratégie de reperfusion : le risque hémorragique, le délai
écoulé depuis le début des symptômes, la gravité hémodyna-
mique et le délai de mise en œuvre d’une éventuelle angioplas-
tie dans un centre expérimenté.
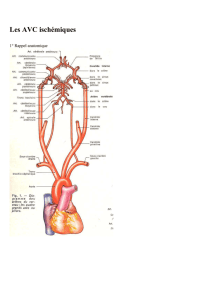
INFARCTUS CÉRÉBRAL : TIME IS BRAIN
(D’après la communication du Dr J.M. Olivot)
Pourquoi et comment effectuer une recanalisation artérielle au
cours d’un infarctus cérébral (IC) ? Lorsqu’une artériographie
est réalisée dans les 6 heures après un AVC, une occlusion vas-
culaire est mise en évidence dans 81 % des cas. Cette occlusion
entraîne une baisse du débit sanguin cérébral (DSC) responsable
d’une ischémie cérébrale. Schématiquement, la zone d’ischémie
peut se diviser en deux parties :
– une zone de nécrose définitive,
– une zone de pénombre ischémique où la baisse du DSC pro-
voque une perte des fonctions cellulaires responsable d’un défi-
cit neurologique.
Cette zone de pénombre peut évoluer soit vers la récupération
en cas de restauration d’un DSC normal par la recanalisation
de l’artère occluse soit vers la nécrose en cas de baisse persis-
tante du DSC. Plusieurs facteurs peuvent précipiter l’évolution
de la pénombre vers la nécrose : l’hypoxie, l’hypotension, la
fièvre et l’hyperglycémie. Pour améliorer la perfusion cérébrale,
le patient doit être maintenu à plat et la pression artérielle ini-
tiale doit être respectée, mais contrôlée pour éviter un surrisque
hémorragique.
Le traitement permettant la reperfusion a plusieurs objectifs : la
recanalisation de l’artère occluse et la reperfusion du territoire
en état de pénombre. Ces traitements doivent permettre la régres-
sion du déficit neurologique et la diminution de la mortalité sans
entraîner de transformation hémorragique symptomatique ni d’ef-
fet neurotoxique.
Deux types de thrombolyse sont validés et utilisés :
●Thrombolyse i.v. par rtPA (Actilyse
®
) i.v. à la dose de
0,9 mg/kg dans les 3 heures,
qui permet 40 % de recanalisa-
tion contre 20 % par le placebo, et réduit significativement le
handicap, le déficit et la dépendance à 3 mois. En revanche, elle
possède les effets indésirables précités et n’a pas d’effet sur la
mortalité. Comme pour l’infarctus du myocarde, la thrombo-
lyse par rtPA est d’autant plus efficace qu’elle est précoce
(figure 7).
●Thrombolyse intra-artérielle par r-ProUK (Prolyse
®
)
au
cours d’une artériographie cérébrale (figure 8). Ce traitement a
l’avantage de contrôler la reperméabilisation de l’artère en temps
réel et la possibilité d’associer un geste de revascularisation méca-
nique (dilatation et stenting). Malheureusement, le r-ProUK a été
retiré du marché par le fabricant.
p < 0,05
8
6,7
1,8
7
6
5
4
3
2
0
1
< 1 h
9/394 > 1 h
7/105
Pourcentage de mortalité
intrahospitalière
Juliard JM et al. Am J Cardiol 2003.
Figure 5. Importance du délai de la prise en charge intrahospitalière sur
la mortalité hospitalière.
Évolution du devenir
selon la stratégie de traitement
A à B
A à C
B à C
D à B
D à C
Pas de bénéfice
Bénéfice
Bénéfice
Dommage
Dommage
D
C
BA
100
80
60
40
20
0
0481216 2420
Temps entre le début des symptômes et la reperfusion
Importance du sauvetage myocardique
Période critique dépendant du temps
But : sauvetage myocardique Période indépendante du temps
But : ouvrir l’artère responsable de l’infarctus
Pourcentage de réduction
de la mortalité
Gersh BJ et al. JAMA 2006;293:979-86.
Figure 6. Importance des délais selon le temps.

La Lettre du Cardiologue - n° 394 - avril 2006
14
INFORMATIONS
Le doppler transcrânien permet le monitoring de la recanalisa-
tion artérielle au cours de la thrombolyse, mais il a également un
rôle actif de renforcement du traitement thrombolytique
(figure 9).
●La transformation hémorragique symptomatique,
com-
pliquant 6 % des IC thrombolysés contre 1 % des IC non traités.
Il existe des facteurs favorisants, qui sont pour certains des contre-
indications à la thrombolyse : infarctus cérébral massif,
HTA > 185/110 mmHg, diabète, traitement anticoagulant asso-
cié, microsaignements visibles en IRM. De plus, les transforma-
tions hémorragiques sont plus fréquentes lorsque la thrombolyse
n’est pas pratiquée par un neurologue spécialiste (moins bon res-
pect des indications et des contre-indications). Une solution pour-
rait être la télémédecine, en proposant une expertise spécialisée
dans des centres généraux.
●L’occlusion persistante après thrombolyse.
Des techniques
de sauvetage peuvent être proposées, par exemple une revascula-
risation mécanique sous couverture d’antiagrégants plaquettaires
par Reopro®. Cependant, cette démarche n’a pas été validée.
●La réocclusion,
qui peut survenir après recanalisation de l’ar-
tère par thrombolyse intraveineuse ou intra-artérielle. Dans ce
cas également, des techniques, non validées, peuvent exception-
nellement être proposées : thrombolyse combinée intraveineuse
et intra-artérielle, traitement antiagrégant par Reopro®, ou revas-
cularisation mécanique.
●
No-Reflow : malgré une artère perméable à l’artériographie,
certains patients ne s’améliorent pas cliniquement, et on constate
au doppler des résistances élevées, témoignant d’une obstruction
de la microcirculation.
●La destruction définitive du tissu cérébral,
secondaire à la durée
d’occlusion et à la taille du territoire pris en charge par l’artère atteinte.
Cette destruction pourrait être prévenue par l’administration de trai-
tements neuroprotecteurs destinés à augmenter la durée de survie des
cellules cérébrales et à diminuer l’effet neurotoxique du rtPA.
Dans la prise en charge des IC à la phase aiguë, il existe deux cas
particuliers : l’occlusion du tronc basilaire et la dissection carotide.
●
L’occlusion du tronc basilaire est un événement grave : 90 %
des cas se compliquent de décès du patient ou d’un déficit majeur
(locked in syndrome) ; en revanche, le risque de transformation
hémorragique est plus faible. En conséquence, des délais de revas-
cularisation plus longs sont acceptés, jusqu’à 12 heures, et les
stratégies de revascularisation peuvent être combinées (throm-
bolyse i.v., i.a., revascularisation mécanique).
●
La dissection de l’artère carotide interne survient le plus sou-
vent chez des sujets jeunes. Elle a pour conséquence la baisse du
débit sanguin cérébral par la constitution d’un hématome de paroi
obstruant la lumière artérielle, et la formation de microthrombi
intravasculaires en regard de la dissection. On peut alors propo-
ser une angioplastie de la carotide interne avec pose d’un stent
ou une thromboaspiration du thrombus en regard.
En conclusion, le traitement thrombolytique de l’IC est validé
uniquement dans les 3 heures suivant la constitution du déficit,
et permet une amélioration fonctionnelle de 40 % à 3 mois contre
placebo. Il est important de sélectionner les patients candidats à
la thrombolyse pour éviter des effets indésirables parfois graves
(transformation hémorragique symptomatique), et cette sélection
peut être effectuée précisément par l’IRM (figure 10). Il ne faut
pas négliger le rôle du doppler transcrânien qui permet de moni-
torer et de potentialiser la thrombolyse.
50
45
40
35
30
25
20
15
10
0,5
0,0
60 90 120 150 180 210 240 270 300 330 360
Temps écoulé entre le début de l’AVC et le traitement (mm)
Odds-ratio ajusté
Figure 7. Impact du délai d’administration du rtPA sur la récupération
du handicap neurologique (score de Rankin mRS).
Figure 8. Thrombolyse intra-artérielle par Prolyse
®
.
40
30
20
10
0
Cible
Contrôle
t-PA bolus 30 60 90 120
Minutes
Pourcentage de patients
Alexandrov AV et al. N Engl J Med 2004;351:2170-8.
Figure 9. Impact du monitoring du doppler transcrânien sur la recana-
lisation artérielle après thrombolyse.
Cependant, la thrombolyse, quelle que soit la technique utilisée,
n’est pas toujours efficace en termes de recanalisation artérielle et
de récupération fonctionnelle. Il existe plusieurs causes d’échec,
et, pour chacune, des solutions spécifiques sont proposées.

La Lettre du Cardiologue - n° 394 - avril 2006
15
INFORMATIONS
Les perspectives sont l’adaptation des stratégies de revasculari-
sation aux causes des IC (causes cardio-emboliques, athérome
intracrânien, dissection) et à leur topographie. De nouvelles stra-
tégies doivent être développées en réponse aux impasses de la
thrombolyse i.v. (occlusion persistante, réocclusion, no reflow).
Actuellement, des essais sont en cours, concernant la sélection
des patients par l’IRM (rôle du mismatch, occlusion persistante,
estimation du risque hémorragique) et le développement de nou-
velles stratégies de thrombolyse i.v. (nouveaux thrombolytiques,
thrombolyses i.v. et i.a. combinées, thrombolyse et neuroprotec-
teurs, télémédecine, etc.). Il sera également nécessaire de préci-
ser le rôle de la revascularisation mécanique et des anti-
GPIIb/IIIa.
EUROPA, qui retrouvent une incidence, respectivement, de mala-
die cérébrovasculaire et de maladie coronaire plus élevée, expli-
quée par l’inclusion de patients en prévention secondaire.
Tous les antihypertenseurs sont-ils équivalents ?
Une méta-analyse publiée en 2005 dans Hypertension compare
les inhibiteurs de l’enzyme de conversion (IEC) et les inhibiteurs
calciques dans la maladie coronaire. Tout d’abord, quelle que soit
la molécule choisie, une baisse de la pression artérielle systo-
lique de 10 mmHg diminue les prévalences des AVC et des coro-
naropathies de 25 %. À baisse tensionnelle identique, on observe
une diminution de 12 % des coronaropathies en faveur des IEC
et une baisse de 14 % des AVC en faveur des inhibiteurs cal-
ciques.
Dans l’étude VALUE, en prévention primaire chez les patients
hypertendus, le valsartan est moins bénéfique que l’amlodipine en
termes de mortalité par maladie coronaire ou cérébrovasculaire.
L’étude ASCOT, publiée dans le Lancet en 2005, a comparé deux
stratégies antihypertensives (amlodipine ± IEC versus aténolol
± diurétique) chez des patients hypertendus depuis longtemps
avec un équilibre imparfait de leur pression artérielle. L’étude a
été interrompue prématurément en raison d’une différence de
mortalité cardiovasculaire (IDM, AVC, insuffisance cardiaque)
en faveur de l’amlodipine. Cependant, il existe de grandes varia-
bilités entre les deux groupes. Ainsi, dans le groupe amlodipine,
la baisse de la pression artérielle est l’unique facteur de préven-
tion des AVC, alors que le niveau de HDL-cholestérol est le prin-
cipal facteur de prévention des coronaropathies.
Le rôle de la statine a aussi été discuté. Cette classe thérapeu-
tique prévient mieux les coronaropathies que les AVC. Dans
l’étude ASCOT, à baisse tensionnelle égale, l’apport d’atorvas-
tatine 10 mg permet une diminution des coronaropathies et des
AVC, mais pas de l’insuffisance cardiaque. Les résultats selon le
type d’antihypertenseur seront présentés à l’American Heart
Association (AHA). Ainsi, dans la population à haut risque, la
diminution du taux d’événements cardiovasculaires par le trai-
tement antihypertenseur est renforcée par l’apport de l’atorvas-
tatine, avec un taux de 26 % sans traitement, de 16 % sous trai-
tement antihypertenseur et de 11 % sous l’association traitement
antihypertenseur et statine.
LES PROGRÈS EN IMAGERIE CÉRÉBRALE
DES AVC
Les progrès en imagerie cérébrale des AVC ont été développés
par le Dr C. Oppenheim (hôpital Sainte-Anne, Paris).
Devant un déficit neurologique brutal, la démarche diagnostique
initiale conduit à réaliser une imagerie pour différencier l’héma-
tome de l’ischémie artérielle aiguë. L’examen de première inten-
tion le plus souvent choisi est le scanner cérébral. Cette technique
présente des limites marquées par un taux élevé de faux négatifs
(40-50 % pendant les cinq premières heures), une absence de cri-
tères de taille validés, une absence de critères de détection des
signes précoces et une sous-estimation de la zone d’ischémie irré-
versible.
Figure 10. Sélection des patients pour les différentes stratégies de revas-
cularisation par l’IRM.
A.S.B.
PRÉVENTION PRIMAIRE DES INFARCTUS
CÉRÉBRAUX ET MYOCARDIQUES
Le Pr X. Girerd, de l’hôpital de la Pitié-Salpêtrière, pose la ques-
tion d’une prévention primaire identique dans les infarctus céré-
braux et myocardiques. Il nous rappelle tout d’abord que la pré-
valence de la maladie cardiovasculaire est élevée (28 % pour les
hommes et 37 % pour les femmes), avec une diminution de la
mortalité avant 75 ans entre 1980 et 1995.
Concernant les différents facteurs de risque, l’HTA et l’âge appa-
raissent comme les principaux facteurs communs, avec un rôle
plus important de l’HTA dans la maladie cérébrovasculaire.
En reprenant une étude publiée dans le Lancet en 2002, qui
exploitait une modélisation de la baisse de 20 mmHg de la pres-
sion artérielle systolique, le Pr Girerd nous montre le bénéfice
de la baisse tensionnelle. Celui-ci apparaît majeur dans deux
populations : chez les sujets jeunes avec une cardiopathie isché-
mique et surtout chez ceux avec une maladie cérébrovasculaire.
Les apports sont homogènes quel que soit le type d’AVC, isché-
mique ou hémorragique.
En pratique, la plupart des grands essais (PROGRESS, EUROPA,
ALLHAT, VALUE, ASCOT) étudiant l’incidence de la maladie
coronaire et cérébrovasculaire chez les patients hypertendus trai-
tés ont confirmé l’intérêt de la baisse de la pression artérielle,
avec un bénéfice plus important dans la maladie cérébrovascu-
laire. Une nuance est apportée par les études PROGRESS et
 6
6
1
/
6
100%