é d i t o r i a l

éditorial
éditorial
Directeur de la publication
Claudie Damour-Terrasson
Rédacteur en chef
C. Bauters
Rédactrice en chef adjointe (congrès)
N. Baubion
Comité de rédaction
C. Adams - J.P. Batisse - F. Bauer
B. Gallet - S. Haulon - G. Helft - S. Kownator
C. Leclercq - C. Le Feuvre - D. Logeart - D. Thomas
Directeur scientifique : Pr M. Komajda
Fondateur scientifique : Pr A. Vacheron
Conseil de rédaction
M.C. Aumont - É. Bruckert - J.P. Charliaguet - A. Cohen-Solal
N. Danchin - F. Delahaye - P. Gibelin - X. Girerd - P. Jauffrion
T. Lavergne - J.P. Metzger - G. Montalescot - R. Roudaut - C. Sebag
Comité de lecture
Prs J.P. Bassand (Besançon) - M. Bertrand (Lille)
M. Bory (Marseille) - M. Brochier (Tours) - J.C. Daubert (Rennes)
J. Delaye (Lyon) - Y. Grosgogeat (Paris)
L. Guize (Paris) - P.G. Hugenholtz (Oosterbeek - Pays-Bas)
H. Kulbertus (Liège) - R. Leighton (Savannah - États-Unis)
J. Lekieffre (Lille) - S. Levy (Marseille) - A. Maseri (Londres)
G. Nicolas (Nantes) - M. Salvador (Toulouse)
Fondateur : Alexandre Blondeau
Société éditrice : EDIMARK SAS
Président-directeur général
Claudie Damour-Terrasson
Rédaction
Secrétaire générale de rédaction : Magali Pelleau
Première secrétaire de rédaction : Laurence Ménardais
Rédactrices-réviseuses : Cécile Clerc, Sylvie Duverger,
Muriel Lejeune, Odile Prébin
Infographie
Premier rédacteur graphiste : Didier Arnoult
Responsable technique : Virginie Malicot
Rédacteurs graphistes : Mathilde Aimée,
Christine Brianchon, Rémy Tranchant
Dessinatrices d'exécution : Stéphanie Dairain,
Christelle Ochin
Commercial
Directeur du développement commercial :
Sophia Huleux-Netchevitch
Directeur des ventes : Chantal Géribi
Directeur d’unité : Nathalie Bastide
Régie publicitaire et annonces professionnelles
Valérie Glatin
Tél. : 01 46 67 62 77 – Fax : 01 46 67 63 10
Abonnements
Lorraine Figuière - Tél. : 01 46 67 62 74
2, rue Sainte-Marie, 92418 Courbevoie Cedex
Tél. : 01 46 67 63 00 - Fax : 01 46 67 63 10
E-mail : [email protected]
Site Internet : www.edimark.fr
Adhérent au SNPM
Revue indexée dans la base PASCAL
Ns s d s p ité s
r p it
Ns s d s p ité s
r p it
La Lettre du Cardiologue
La Lettre du Cardiologue - n° 408 - octobre 2007
DENOMINATION : KENZEN 4 mg, KENZEN 8 mg, KENZEN 16 mg, KENZEN 32 mg comprimés sécables.FORME, PRESENTATION ET COMPOSITION : comprimés sécables dosés à 4 mg, 8 mg, 16 mg et 32 mg, de candesartan cilexétil (DCI)
respectivement. Boite de 28. Excipient à effet notoire : lactose monohydraté. INDICATION THERAPEUTIQUE :
KENZEN 4 mg-8 mg-16 mg
: Traitement de l’hypertension artérielle essentielle
. KENZEN 4 mg-8 mg-16 mg-32 mg
: Traitement de
l’insuffisance cardiaque de classe II à III NYHA avec dysfonction systolique ventriculaire gauche (FEVG ≤40 %) en cas d’intolérance aux inhibiteurs de l’enzyme de conversion (IEC), ou en association avec un inhibiteur de l’enzyme de conversion (IEC)
chez les patients restant symptomatiques sous IEC. POSOLOGIE ET MODE D’ADMINISTRATION : HTA :
KENZEN 4 mg-8 mg-16 mg
: la posologie initiale et d’entretien recommandée est de 8 mg par jour en une seule prise. L’initiation du traitement
avec 4 mg/j pourra être envisagée particulièrement chez les sujets âgés de plus de 75 ans. Chez les patients insuffisamment contrôlés par 8 mg/j,une augmentation de la dose à 16 mg peut dans certains cas accroître l’efficacité antihypertensive,
mais l’association à un diurétique à faible dose tel que l’hydrochlorothiazide sera privilégiée (effets additifs). En cas d’insuffisance rénale sévère, y compris chez les patients hémodialysés, ou d’insuffisance hépatique légère à modérée, une
posologie à 4 mg/j est recommandée. La tolérance et l’efficacité de KENZEN n’ont pas été étudiées chez l’enfant.IC :
KENZEN 4 mg-8 mg-16 mg-32 mg
: la dose initiale habituellement recommandée est de 4 mg/jour en une prise. La posologie
sera ensuite augmentée progressivement jusqu’à la dose cible de 32 mg/jour ou la plus forte dose tolérée, en doublant la posologie à intervalles d’au moins 2 semaines. Sujet âgé, insuffisant rénal, diabétique : Risque majoré d’hyperkaliémie,
potentiellement mortel. Traitements associés : association possible aux autres traitements de l’IC : IEC, b-bloquants, diurétiques, digitaliques, ou avec une association de ces produits. La triple association de candesartan avec un IEC et un
diurétique hyperkaliémiant (ex. spironolactone ou éplérénone) est fortement déconseillée. Mode d’administration : une seule prise par jour pendant ou en dehors des repas. C.T.J : KENZEN 4 mg : 0,59 €. KENZEN 8 mg : de 0,70 à 0,78 €
(selon la présentation). KENZEN 16 mg : de 0,76 à 0,84 €(selon la présentation), KENZEN 32 mg : 1,36 €.CONTRE-INDICATIONS :
Absolues :
hypersensibilité à l’un des constituants, à partir du 2
ème
trimestre de la grossesse, dans l’IC
en cas de kaliémie > 5 mmol/L, de créatininémie > 265 micromol/l (> 30 mg/L) ou de cl. créatinine < 30 ml/min.
Relatives :
diurétiques hyperkaliémiants (spironolactone, éplérénone, amiloride, triamtérène, seul ou associés…),
potassium ( sels de), sel de lithium ; au cours de l’allaitement. MISES EN GARDE ET PRECAUTIONS PARTICULIERES D’EMPLOI : hypotension possible en cas d’hypovolémie, en particulier dans l’IC : initier le traitement avec prudence.
Dans l’IC, la fréquences des hypotensions augmente avec l’âge, en cas de diabète ou d’association à un autre traitement agissant sur le système rénine-angiotensine-aldostérone (SRAA) et peut nécessiter une réduction de la dose
ou l’arrêt du traitement. Risque accru d’hypotension sévère et d’insuffisance rénale en cas de sténose bilatérale de l’artère rénale ou de sténose artérielle rénale sur rein fonctionnel unique. Contrôle périodique du potassium et
de la créatinine sériques recommandé chez les insuffisants rénaux. Dans l’IC, altération de la fonction rénale fréquemment observée. Sa fréquence augmente avec l’âge, en cas de diabète ou d’association à un autre traitement
agissant sur le SRAA et peut nécessiter une réduction de la dose ou l’arrêt du traitement. Aucune expérience disponible chez les patients ayant eu une transplantation rénale récente. Augmenter progressivement les doses et
surveiller la pression artérielle chez les patients hémodialysés. Risque d’hyperkaliémie en cas d’insuffisance rénale et/ou d’insuffisance cardiaque : contrôle de la kaliémie recommandé. Dans l’IC, risque d’hyperkaliémie
potentiellement mortel, majoré chez les sujets âgés, les insuffisants rénaux et les diabétiques, et/ou en cas d’association de plusieurs médicaments hyperkaliémiants [sels de potassium, diurétiques hyperkaliémiants, IEC,
ARA II, AINS (y compris inhibiteurs sélectifs de la COX 2), héparines (de bas poids moléculaires ou non fractionnées), immunosuppresseurs comme la ciclosporine ou le tacrolimus, le triméthoprime], et/ou lors de la survenue
d’évènements intercurrents [déshydratation, décompensation cardiaque aiguë, acidose métabolique, altération de la fonction rénale, altération importante et soudaine de l’état général (ex. maladies infectieuses),
souffrance et lyse cellulaire (ex. ischémie aiguë d’un membre, rhabdomyolyse, traumatismes étendus). Avant d’associer plusieurs médicaments bloquant le SRAA, évaluer le rapport bénéfice/risque et considérer la
possibilité d’une alternative thérapeutique. Le suivi des patients insuffisants cardiaques devra comporter un ionogramme sanguin, avec contrôle de la kaliémie, de la natrémie, et de la fonction rénale avant instauration
du traitement et une semaine après ; et (avant et après) chaque augmentation de dose ou modification de traitement. En traitement d’entretien, réaliser les contrôles tous les mois pendant les trois premiers mois, puis
tous les trois mois la 1
ère
année et ensuite, tous les 6 mois ou lors de la survenue d’un événement intercurrent. KENZEN n’est pas indiqué dans l’insuffisance cardiaque de classe IV NYHA. Risque d’hypotension au
cours d’une anesthésie ou d’une intervention chirurgicale pouvant nécessiter le recours à un remplissage vasculaire et/ou à des substances vasopressives. Prudence particulière chez les patients souffrant de sténose
aortique ou mitrale, ou de cardiomyopathie obstructive hypertrophique. Utilisation non recommandée en cas d’hyperaldostéronisme primaire. Risque d’hypotension aiguë, d’hyperazotémie, d’oligurie ou rarement
d’insuffisance rénale aiguë chez les patients dont la tonicité vasculaire et la fonction rénale dépendent de façon prédominante de l’activité du système rénine-angiotensine-aldostérone. Risque d’infarctus du myocarde
ou d’accident vasculaire cérébral en cas de cardiopathie ischémique ou d’affection cérébrovasculaire ischémique. Présence de lactose. Généralement déconseillé pendant le 1er trimestre de la grossesse.
INTERACTIONS AVEC D’AUTRES MEDICAMENTS ET AUTRES FORMES D’INTERACTIONS : Associations déconseillées : diurétiques hyperkaliémiants (spironolactone, éplérénone, amiloride, triamtérène, seul ou
associés…), potassium (sels de), Lithium (sels de). Associations nécessitant des précautions d’emploi : diurétiques, AINS. GROSSESSE ET ALLAITEMENT : Grossesse : Par mesure de prudence, ne pas utiliser
KENZEN au cours du 1er trimestre de la grossesse. L’administration de KENZEN est contre-indiquée pendant les 2
ème
et 3
ème
trimestres de la grossesse. Allaitement : il est déconseillé d’administrer KENZEN.
EFFETS SUR L’APTITUDE A CONDUIRE DES VEHICULES ET A UTILISER DES MACHINES : Survenue occasionnelle de vertiges ou de fatigue. EFFETS INDESIRABLES : HTA : Rapportés très rarement
(< 1/10 000) après commercialisation : leucopénie, neutropénie, agranulocytose, hyperkaliémie, hyponatrémie, vertiges, céphalées, nausées, élévation des enzymes hépatiques voire hépatites,
angio-œdème, éruption, urticaire, prurit, douleurs dorsales, arthralgies, myalgies, altération de la fonction rénale incluant des cas d’insuffisance rénale chez des patients à risque. Pas de modification
cliniquement significative des données biologiques usuelles. IC : observés le plus fréquemment (≥1/100, <1/10): altération de la fonction rénale, augmentation de la créatininémie et/ou de l’urémie,
hyperkaliémie, hypotension artérielle. Ces événements, potentiellement graves, et nécessitant un suivi régulier au cours du traitement, étaient plus fréquents chez les patients > 70 ans,
diabétiques, ou ayant reçu d’autres traitements agissant sur le SRAA. SURDOSAGE : traitement symptomatique et surveiller les signes vitaux. Le candesartan n’est pas éliminé par hémodialyse.
PROPRIETES PHARMACODYNAMIQUES : médicament agissant sur le système rénine-angiotensine/antagoniste de l’angiotensine II. PROPRIETES PHARMACOCINETIQUES. DUREE DE
CONSERVATION : KENZEN 4 mg-8 mg-16 mg : 3 ans. KENZEN 32 mg : 2 ans. PRECAUTIONS PARTICULIERES DE CONSERVATION : KENZEN 4 mg-8 mg : A conserver à une température
ne dépassant pas 30°C ; KENZEN 16 mg-32 mg : A conserver à une température ne dépassant pas 25°C. PRESENTATION ET NUMERO D’IDENTIFICATION ADMINISTRATIVE :
28 comprimés sous
plaquettes thermofor-
mées (PVC / PVDC /
Aluminium) : KENZEN
4 mg : 345 694-7 (1998),
KENZEN 8 mg : 345 700-7
(1998), KENZEN 16 mg :
350 857-8 (1999), KENZEN
32 mg : 368 707-8 (2005) 30
comprimés sous plaquettes
thermoformées (PVC / PVDC /
Aluminium) : KENZEN 4 mg :
372 033-4 (2006), KENZEN
8 mg : 372 037-3 (2006),KENZEN
16 mg : 372 042-7 (2006),
KENZEN 32 mg : 369 510-3 (2006)
90 comprimés sous plaquettes ther-
moformées (PVC/PVDC/Aluminium) :
KENZEN 8 mg : 372 040-4 (2006),
KENZEN 16 mg : 372 045-6 (2006),
CONDITIONS DE PRESCRIPTION ET DE
DELIVRANCE : LISTE I. PRIX PUBLIC
TTC : KENZEN 4 mg : 28 comprimés :
16,72 €, 30 comprimés : 17,88 €
KENZEN 8 mg : 28 comprimés :
21,96 €, 30 comprimés 23,49 €, 90
comprimés : 63,87 €KENZEN
16 mg : 28 comprimés : 23,63 €, 30
comprimés : 25,27 €, 90 comprimés :
68,41 €,
KENZEN 32 mg :
28
comprimés : 38,47 €, 30 comprimés :
40,84 €. Spécialités remboursées
S.S à 65 % et agréées Collec.
TITULAIRE DE L’AUTORISATION
DE MISE SUR LE MARCHE :
Laboratoires TAKEDA, 11-15, quai
de Dion Bouton, 92816 PUTEAUX
cedex. Tél : 01 46 25 16 16 - Fax :
01 46 97 00 11 - Information médicale
et pharmacovigilance : 01 46 25 12 00.
- Décembre 2006.
DÉCOUVREUR DU CANDESARTAN
KEN-010/03-07
candesartan cilexetil
®
HTA ESSENTIELLE
4 mg - 8 mg - 16 mg
INSUFFISANCE CARDIAQUE
4 mg - 8 mg - 16 mg - 32 mg
Classe II à III NYHA avec dysfonction systolique ventriculaire gauche (FEVG ≤40 %)
• en cas d’intolérance aux IEC
• ou en association avec un IEC chez les patients restant symptomatiques sous IEC
En cas d’intolérance aux IEC, le candésartan a montré une réduction
de la morbimortalité cardiovasculaire chez les patients avec
insuffisance cardiaque de classe Il à Ill NYHA et dysfonction
systolique ventriculaire gauche. Le candésartan apporte
une amelioration du service médical rendu importante
(ASMR 2) dans la prise en charge de ces patients.
Avis de la commission de la transparence du 2 novembre 2005.
En association avec un IEC chez les patients restant
symptomatiques sous IEC, le candésartan a montré
une réduction de la morbimortalité cardiovasculaire
en cas d'insuffisance cardiaque de classe Il à Ill
NYHA et dysfonction systolique ventriculaire gauche.
Chez ces patients, le risque d'hyperkaliémie est
augmenté. Le candésartan apporte une amélioration
du service médical rendu modérée (ASMR 3) dans la prise
en charge de ces patients.
Avis de la commission de la transparence du 2 novembre 2005.
kenzen 210x270 29/05/07 18:00 Page 1
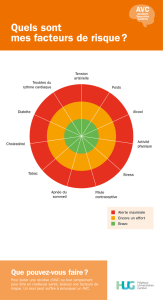
Figure 1. Exemples d’enregistrements en doppler transcrânien de micro-emboles
cérébraux au niveau de la cérébrale moyenne.
1A : pendant la manipulation d’un cathéter lors d’une coronarographie.
1B : série de micro-emboles lors de l’injection de contraste laissant supposer qu’il s’agit de
microbulles.
1A 1b
3
Risque d’accident vasculaire
cérébral et cathétérisme cardiaque
Risk of stroke in cardiac catheterization
M. Hamon*
* Service de cardiologie, CHU de Caen.
Le risque d’accident vasculaire cérébral (AVC) lors d’un cathétérisme
cardiaque ou d’un geste d’angioplastie coronaire est relativement
faible, estimé actuellement entre 0,2 et 0,4 % (1, 2). Cependant, il consti-
tue toujours une complication dramatique pour le patient et laisse souvent
l’opérateur désarmé face à une situation clinique à haut risque de mortalité.
Le mécanisme essentiel responsable de ces AVC est lié au risque d’embolisation
de matériel athéro-thrombotique mobilisé par la manipulation des cathéters lors
du trajet rétrograde artériel et intra-aortique (3-5). L’AVC hémorragique, quant à
lui, peut se rencontrer au décours de la prise en charge des syndromes coronaires
aigus où les traitements antithrombotiques utilisés sont particulièrement
agressifs. Il reste, cependant, très minoritaire par rapport à l’AVC embolique.
L’utilisation du doppler transcrânien au cours de procédures de cathétérisme
cardiaque a permis d’identifier l’existence de multiples embolies cérébrales
(6, 7). Ainsi, comme on le voit dans la figure 1, lors de la manipulation d’un
cathéter intra-aortique pour la réalisation d’une coronarographie par exemple,
on peut observer, au niveau des artères cérébrales moyennes, l’embolisation
cérébrale de multiples particules au cours de la procédure. Le caractère quasi
systématique de ces embolies cérébrales au cours d’un cathétérisme cardiaque
contraste évidemment avec la faible incidence des accidents cliniques.
Cependant, l’utilisation récente de l’IRM cérébrale de diffusion a permis d’identifier
des lésions insoupçonnées correspondant à des infarctus cérébraux, avec une
fréquence pouvant atteindre 15 à 22 % (8-10). Ces infarctus silencieux (en rapport

éditorial
éditorial
Les Temps Forts
de l’AHA2007
Le jeudi 15 novembre 2007
à partir de 20h00
Une émission télévisée en direct
Merci de vous inscrire par fax
au 01 41 17 26 85
ou sur :
www.actu-aha2007.com
Préciser vos nom, prénom, adresse professionnelle
et la ville choisie pour participer à cette soirée unique.
Un partenariat
08CO01P/09.07
UNE EMISSION COORDONNEE PAR :
le Pr Nicolas DANCHIN (SFC),
le Dr Dominique GUEDJ-MEYNIER (CNCF),
et le Dr Claude BARNAY (CNCHG).
UN PANEL D'EXPERTS
pour commenter les avancées les plus
importantes en cardiologie.
Sur un site
proche de
chez vous.
AHA-ap 210X270:Mise en page 1 19/09/07 15:20 Page 1
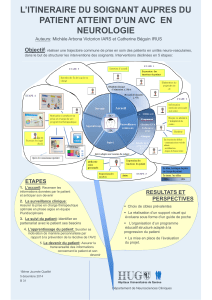
Figure 2. Exemple en IRM de diff usion d’un infarctus cérébral
récent asymptomatique.
La Lettre du Cardiologue - n° 408 - octobre 2007
4
avec les micro-embolies induites par le cathétérisme cardiaque)
pourraient expliquer les altérations cognitives observées
par certains auteurs (10) et bien connues, notamment des
chirurgiens cardiovasculaires, après manipulation aortique
des sujets très athéromateux (11). Les données actuelles sont
relativement parcellaires, mais la présence d’infarctus cérébraux,
même asymptomatiques, reste associée à un risque plus élevé
de troubles cognitifs lors du suivi clinique de ces patients (12).
Évidemment, les données sont actuellement trop fragmentées
et les tests neuropsychologiques permettant d’authentifier ces
altérations neurocognitives doivent être analysés avec prudence.
Les lésions cérébrales observées au décours d’un cathétérisme
cardiaque par l’imagerie par résonance magnétique (IRM) de
diffusion, même si elles ne s’expriment pas sur le plan clinique,
doivent amener les cardiologues interventionnels à s’interroger
sur les conséquences de telles lésions cérébrales (figure 2).
Nous avons récemment, avec l’utilisation du doppler transcrânien,
confirmé le fait que toute procédure de cardiologie interventionnelle
ou de cathétérisme cardiaque s’associe à des embolies cérébrales
dont il n’est pas possible de déterminer s’il s’agit de matériel
athéro-thrombotique ou de microbulles. Le risque d’AVC
asymptomatique mis en évidence par l’IRM de diffusion 24 heures
après le cathétérisme cardiaque était de l’ordre de 5,9 % (point
médian de l’intervalle de confiance) [13].
Des études à plus grande échelle seront nécessaires pour
préciser la fréquence exacte des AVC silencieux. Il sera aussi
intéressant d’évaluer le rôle des voies d’abord, l’influence de
la taille des cathéters et de l’environnement pharmacologique
dans le déterminisme de ces AVC silencieux. Il est en effet
possible que le risque varie très significativement en fonction
de ces différents facteurs.
La recherche dans ce domaine pourrait être facilitée par la
disponibilité de marqueurs biologiques de souffrance cérébrale.
Nous avons pu observer que certains patients au cours d’un
cathétérisme cardiaque présentaient des élévations de la
protéine S-100 B. Cela suggère que les multiples embolies
quasi systématiques au cours des procédures endovasculaires
peuvent être responsables d’une souffrance cérébrale diffuse qui
reste infraclinique et le plus souvent non détectable en IRM de
diffusion (14). Il n’en demeure pas moins que, actuellement, il
n’existe pas de marqueur suffisamment spécifique et sensible
permettant d’authentifier une souffrance cérébrale.
En conclusion, le risque d’AVC symptomatique est actuellement
faible, entre 0,2 et 0,4 %, mais des AVC silencieux totalement
insoupçonnés pourraient être présents avec une fréquence
considérable, pouvant atteindre 15 à 22 % pour certaines
équipes. Il est encore trop tôt pour juger de l’impact clinique
réel de ces accidents vasculaires silencieux observés dans
certaines séries. De nombreux travaux de recherche sont
nécessaires pour déterminer les situations à risque ainsi que
les modifications à apporter à nos techniques afin de réduire
ces embolies cérébrales potentiellement délétères. ■
RéféRences bibliogRaphiques
1. Segal AZ, Abernethy WB, Palacios IF, BeLue R, Rordorf G. Stroke as a complication
of cardiac catheterization: risk factors and clinical features. Neurology 2001;56:975-7.
2. Wong SC, Minutello R, Hong MK. Neurological complications following per-
cutaneous coronary interventions (a report from the 2000-2001 New York State
Angioplasty Registry). Am J Cardiol 2005;96:1248-50.
3. Di Tullio MR, Sacco RL, Savoia MT, Sciacca RR, Homma S. Aortic atheroma
morphology and the risk of ischemic stroke in a multiethnic population. Am
Heart J 2000;139:329-36.
4. Khoury Z, Gottlieb S, Stern S, Keren A. Frequency and distribution of athero-
sclerotic plaques in the thoracic aorta as determined by transesophageal echocar-
diography in patients with coronary artery disease. Am J Cardiol 1997;79:23-7.
5. Karalis DG, Quinn V, Victor MF et al. Risk of catheter-related emboli in patients
with atherosclerotic debris in the thoracic aorta. Am Heart J 1996;131: 1149-55.
6. Leclercq F, Kassnasrallah S, Cesari JB et al. Transcranial Doppler detection
of cerebral microemboli during left heart catheterization. Cerebrovasc Dis
2001;12:59-65.
7. Bladin CF, Bingham L, Grigg L, Yapanis AG, Gerraty R, Davis SM. Transcra-
nial doppler detection of microemboli during percutaneous transluminal coro-
nary angioplasty. Stroke 1998;29:2367-70.
8. Omran H, Schmidt H, Hackenbroch M et al. Silent and apparent cerebral
embolism after retrograde catheterization of the aortic valve in valvular stenosis:
a prospective, randomized study. Lancet 2003;361:1241-6.
9. Büsing KA, Schulte-Sasse C, Flüchter S et al. Cerebral infarction: incidence and
risk factors after diagnostic and interventional cardiac catheterization-prospec-
tive evaluation at diff usion-weighted MR imaging. Radiology 2005;235: 177-83.
10. Lund C, Nes RB, Ungelstadt TP et al. Cerebral emboli during left heart ca-
theterization may cause acute brain injury. Eur Heart J 2005;26:1269-75.
11. Lund C, Sundet K, Tennoe B et al. Cerebral ischemic injury and cognitive im-
pairment after off -pump and on-pump coronary artery bypass grafting surgery.
Ann orac Surg 2005;80:2126-31.
12. Vermeer SE, Prins ND, den Heijer T, Hofman A, Koudstaal PJ, Breteler MM.
Silent brain infarcts and the risk of dementia and cognitive decline. N Engl J Med
2003;348:1215-22.
13. Hamon M, Gomes S, Oppenheim C et al. Cerebral microembolism during
cardiac catheterization and risk of acute brain injury: a prospective diff usion-
weighted magnetic resonance imaging study. Stroke 2006;37:2035-8.
14. Hamon M, Gomes S, Clergeau MR, Fradin S, Morello R, Hamon M. Risk of
acute brain injury related to cerebral microembolism during cardiac catheteri-
zation performed by right upper limb arterial access. Stroke 2007;38:2176-9.
1
/
2
100%