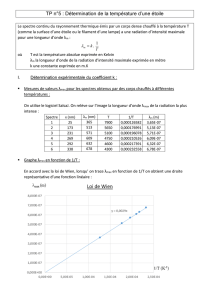
λ max = 143 nm

Classe 1ère S Nom : Prénom :Correction
Exercice n°1 : ( 6 points) diagramme des niveaux d’énergie de l’hydrogène
Données : célérité de la lumière dans le vide c = 3,00x108 m.s-1. Constante de Planck : h = 6,63x10-34 J.s. 1 eV = 1,602x10-19J.
Le diagramme d’énergie ci-contre représente les différents niveaux accessibles pour les électrons d’un atome d’hydrogène.
1. Quelle énergie ΔE faut-il apporter à l’atome d’hydrogène pour que son électron passe de la couche (K) à la
couche (M) ? Exprimer cette valeur en électronvolts puis en joules.
ΔE = E3 –E1
= 12,1 eV
ou = 1,93x10-18 J
2. Quelle est la fréquence ν de la radiation qui permet cette transition ?
fréquence ν = (E3 –E1) /h
ν = 2,92x1015 Hz
3. Quelle est l’énergie ΔE’ d’un photon d’une radiation de fréquence ν’= 2xν
ΔE’ = 2x(E3 –E1) = 24,2 eV ou 3,86 x10-18 J
4. Cette radiation peut-elle être absorbée par cet atome ?
ΔE’ = 24,2 eV est supérieure à l’énergie d’ionisation de l’atome (13,6 eV). Il ne peut
exister de transition possible pour absorber cette radiation.
4. Quelles transitions sont envisageables lorsque l’électron, initialement sur la couche (M) se désexcite ?
Sont envisageables les transitions (M)(L), puis (L )(K) ou (M)(K)
5. Déterminer la longueur d’onde λ, de la radiation correspondant à la transition entre la couche (L) et la
couche (K).
λ = hxc/(E2 – E1) λ = 122 nm
6. Cette radiation appartient-elle au visible ?
λ = 122 nm est inférieure à 400 nm donc n’appartient pas au visible.
En (en eV)
0
-0,54
-0,85
-1,51
-3,40
n = 5 (O)
-13,6
n = 6 (P)
n = 4 (N)
n = 3 (M)
n = 2 (L)
n = 1 (K)

Exercice n°2 : (2 points) Couleur d’une solution.
Lorsqu’on éclaire une solution par une lumière bleue, elle est perçue bleue. Lorsqu’on l’éclaire par une lumière
rouge, elle est perçue rouge et Lorsqu’on l’éclaire par une lumière verte, elle est perçue noire.
1. Quelle couleur sera perçue cette une solution, sous un éclairage blanc ? Justifier.
Sous un éclairage blanc (toutes les lumières colorées) la solution renverra la radiation
bleue et la radiation rouge. La solution sera perçue violette ou magenta.
2. Quelle couleur sera perçue cette solution sous l’éclairage simultané d’une lumière rouge et d’une
lumière bleu ? Justifier.
Sous l’éclairage simultané d’une lumière rouge et d’une lumière bleu la solution renverra la
radiation bleue et la radiation rouge. La solution sera perçue violette ou magenta.
3. Dessiner l’allure du profil spectral de cette solution éclairée en lumière blanche.
Exercice n°3 (2 points) Loi de Wien
La température de l’étoile Spica, dans la constellation de la Vierge, est d’environ 20 000 °C. Avec θ en
°C et λmax en nm, la loi de Wien s’écrit :
273
1089,2
max
6
1. Exprimer λmax en fonction de θ.
λmax = 2,89x106/(θ + 273)
2. Calculer la valeur de la longueur d’onde λmax émise par Spica.
λmax = 143 nm
3. A quel domaine appartient-elle ? λmax = 143 nm est inférieure à 400 nm donc
n’appartient pas au visible mais au UV.
Absorbance
λ (nm)
400 nm
800 nm
1
/
2
100%