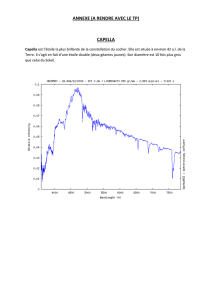
2014 - Devoir n°2

Première S www.sciencesphysiques.info
Devoir de Sciences Physiques n°2 Page 1 / 2
Devoir de Sciences Physiques nÀ2 : correction
Exercice I : éclairage routier
1/ L’état fondamental est, par définition, l’état de plus basse énergie du diagramme, donc le niveau n = 1
d’énergie – 5,14 eV.
2/ On considère une raie jaune, de longueur d’onde dans le vide λ = 589 nm, émise par une telle lampe.
D’après Planck :
ν
×
=
∆
hE or
λ
=ν c donc J 10.38,3
10.589 10.00,310.63,6ch
E
19
9
834 −
−
−
=
×
=
λ
×
=∆
soit
eV 11,2
10.60,1 10.38,3
E
19
19
==∆
−
−
Il s’agit d’une émission de photon donc
d’une perte d’énergie pour l’atome : la
flèche est donc orientée vers le bas.
Par ailleurs,
∆
E = 2,11 eV correspond à la
différence d’énergie entre le niveau n = 1 et
le niveau n = 2 de l’atome
=> flèche (rouge) partant du niveau n = 2
vers le niveau n = 1 : désexcitation.
3/ L’atome de sodium, considéré maintenant dans l’état E
2
, reçoit une radiation lumineuse dont le quantum
d’énergie E a pour valeur 1,10 eV : la radiation lumineuse peut être absorbée par l’atome de sodium à l’état
E
2
puisque 1,10 eV correspond à la différence d’énergie entre les niveaux 2 et 3 de l’atome. L’absorption de
cette radiation correspond donc à la transition du niveau n = 2 au niveau n = 3 : excitation (flèche bleue).
4/ λ
×
=∆ ch
E donc m 10.13,1
10.60,110,1 10.00,310.63,6
Ech
6
19
834 −
−
−
=
××
=
∆
×
=λ soit 1130 nm
Cette radiation appartient au domaine des infrarouges (
λ
= 1130 nm > 800 nm).
Exercice II : loi de Wien et astrophysique
Bételgeuse : nm 800
3600
10.89,2
6
max
==λ
Son maximum d’intensité est à la limite entre le rouge visible et l’infrarouge, donc il s’agit d’une étoile
de classe M : « l
eur couleur perçue est rouge mais leur maximum d’intensité est en fait dans
l’infrarouge ».
Bételgeuse est en fait une géante rouge, une énorme étoile en fin de vie.
Teide 1 : nm 1100
2600
10.89,2
6
max
==λ
Son maximum d’intensité est à largement dans l’infrarouge, donc il s’agit d’une étoile de classe T : c’est
en fait une naine brune : « e
lles émettent peu ou pas de lumière visible, mais surtout ou seulement des
infrarouges ».
Mintaka (Delta Orionis) : nm 83
35000
10.89,2
6
max
==λ
Son maximum d’intensité est largement dans l’ultraviolet, donc il s’agit d’une étoile de type O : «
ce sont
des étoiles très lumineuses et de couleur perçue bleue, mais la plupart de la lumière qu’elles émettent est
dans l’ultraviolet ».
Niveau n = 1
Niveau n = 4
Niveau n = 3
Niveau n = 2
Niveau n → ∞
E
1
= - 5,14 eV
E
2
= - 3,03 eV
E
3
= - 1,93 eV
E
4
=
-
1
,
5
1 eV
E
∞
= 0
Niveau n = 5
E
5
= - 1,38 eV
Energie (eV)

Première S www.sciencesphysiques.info
Devoir de Sciences Physiques n°2 Page 2 / 2
Exercice III : colorimétrie
1/ Le dosage effectué est un « dosage colorimétrique par étalonnage ».
2/ L’énoncé indique que la solution à analyser est orange donc il faut travailler avec un filtre bleu afin
d’avoir une absorbance maximale : filtre n°1 de 440 nm.
3/ Loi de Beer – Lambert : A = ε(λ) × l × C
Dans les conditions de l’expérience, les facteurs « ε(λ) » et « l » ne varient pas puisque les facteurs
température, nature de l’espèce dissoute, nature du solvant, longueur d’onde du filtre et largeur de la cuve
sont fixés. On a alors k = ε(λ) × l = cte et il vient A = k × C (avec k = cte).
La graphique A = f(C) doit alors être une droite passant par l’origine du repère.
4/ On trace le graphe A = f(C) et on obtient effectivement une droite passant par l’origine. Par lecture
graphique, on détermine la concentration molaire de la solution S en dichromate de potassium (traits bleus).
A
S
= 0,38 => C
S
= 3,0.10
-4
mol/L
5/ Par définition : n = C × V = 3,0.10
-4
× 50.10
-3
= 1,5.10
-5
mol
La quantité de matière de dichromate de potassium dissoute est donc de 15 µmol.
0,20
0,40
0,60
0,80
1,20
1,40
0 1,60
C en mmol/L
0
,5
1,5
1,0
2,0
A
1
/
2
100%