Lire l'article complet

DOSSIER THÉMATIQUE
La lettre de l’hépato-gastroentérologue - n° 2 - vol. V - mars-avril 2002
70
Traitement chirurgical
des tumeurs stromales digestives
●S. Bonvalot*
es tumeurs stromales digestives sont rares et représen-
tent environ 1% des néoplasmes intestinaux et 10% de
l’ensemble des sarcomes, soit environ 150 à 200 cas par
an en France. Les tumeurs stromales malignes étaient réputées
particulièrement chimio-résistantes, et la chirurgie était jusqu’à
présent la seule solution à visée curatrice, aucune chimiothéra-
pie adjuvante n’ayant montré jusqu'à présent d’efficacité. Cette
chirurgie doit être macroscopiquement complète, mais 25 à 50%
des patients ont des tumeurs localement évoluées ou d’emblée
métastatiques. L’utilisation de Glivec (STI 571) depuis l’été 2000
chez des patients atteints de tumeurs stromales évoluées va pro-
bablement modifier les indications opératoires, compte tenu de
son efficacité antitumorale.
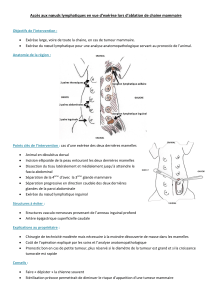
CIRCONSTANCES DE DÉCOUVERTE
La fréquence des tumeurs stromales digestives diminue de l’es-
tomac (50 à 60%) au rectum (10 à 20%) (1). La symptomatolo-
gie révélatrice varie en fonction de la localisation (hémorragie
digestive, masse palpable, douleurs abdominales, perforations).
L’hémorragie digestive est révélatrice chez 50% des patients, et
les perforations digestives dans 10% des localisations sur le grêle.
Ces circonstances amènent donc fréquemment à opérer le patient
en urgence.
Au moment du diagnostic, la taille médiane est d’environ 11 cm
pour les tumeurs du grêle et peut atteindre 14 cm suivant les séries
pour l’ensemble des localisations. Ce sont donc des tumeurs clas-
siquement volumineuses qui peuvent envahir les viscères adja-
cents. Près de la moitié des patients présentent des tumeurs loca-
lement évoluées ou sont d’emblée métastatiques avec, en
particulier, une extension péritonéale et des métastases hépa-
tiques. Cela explique que les taux de résection complète dans la
littérature varient entre 50 et 70%.
ANATOMOPATHOLOGIE ET PRONOSTIC
De nombreux travaux montrent que le CD117 est un marqueur
plus sensible que le CD34 pour le diagnostic des tumeurs stro-
males digestives (2, 3). Si l’expression du gène c-kit (CD117)
permet actuellement de faire le diagnostic de tumeur stromale, il
n’y a pas de corrélation entre son expression et l’extension tumo-
rale ou le grade de malignité. En fait, les données moléculaires
en termes de pronostic seraient plus utiles que l’immuno-histo-
chimie, car ce sont les mutations du gène c-kit qui sont signifi-
cativement corrélées à la survenue de récidive et à une mortalité
plus élevée. C-kit est un proto-oncogène qui code pour une tyro-
sine-kinase réceptrice du stem cell factor, et les mutations de la
molécule c-kit permettent une activation constitutionnelle de la
tyrosine-kinase indépendamment de la présence du ligand. Cer-
taines de ces mutations de kit sont retrouvées, d’ailleurs dans des
formes familiales de cette maladie. Les mutations de c-kit concer-
nent principalement l’exon 11 (lésions dans 52% des cas), l’exon
9 et l’exon 13. Jusqu’à la démonstration de ces anomalies molé-
culaires, le comportement biologique de ces tumeurs était sou-
vent difficile à prévoir, et il n’existait pas de critère morpholo-
gique absolu permettant de distinguer les formes malignes des
formes bénignes. Les études de survie retrouvent systématique-
ment, comme facteurs pronostiques, la taille tumorale, le nombre
L
* Département de chirurgie, comité Sarcomes,
Institut Gustave-Roussy, Villejuif.
■La chirurgie est le seul traitement à visée curatrice.
■Une résection macroscopiquement complète de la tumeur
est nécessaire. Le curage ganglionnaire n’est pas systéma-
tique.
■En cas de tumeur localement évoluée, une exérèse mono-
bloc des viscères atteints par contiguïté doit être réalisée si
elle est possible.
■L’utilisation de Glivec (STI 571) va probablement modi-
fier les indications opératoires dans les formes évoluées.
POINTS FORTS
POINTS FORTS

La lettre de l’hépato-gastroentérologue - n° 2 - vol. V - mars-avril 2002 71
de mitoses et la qualité de la chirurgie. Il a donc été retenu des
critères histologiques associés à un risque de récidive locale ou
métastatique mais le seuil de ces critères varie suivant les séries
et il n’existe pas de consensus international. Le seuil de cinq
mitoses pour 50 grands champs au grossissement 400 permettrait
de pouvoir différencier les tumeurs bénignes (moins de cinq
mitoses pour 50 grands champs) des tumeurs malignes (plus de
cinq mitoses pour 50 grands champs). La taille tumorale supé-
rieure à 5 cm est également considérée comme un facteur de mau-
vais pronostic. En l’absence de la démonstration moléculaire de
la mutation du gène c-kit, une tumeur stromale digestive maligne
est une tumeur de la paroi digestive ou du mésentère exprimant
c-kit, de plus de 5 cm de diamètre, et dont le nombre de mitoses
pour 50 grands champs est supérieur ou égal à 5.
TRAITEMENT CHIRURGICAL
DES TUMEURS STROMALES
Tumeur localisée
L’ensemble des équipes chirurgicales est en faveur d’une résec-
tion macroscopiquement complète des lésions. En effet, le carac-
tère complet de la chirurgie permet d’obtenir des survies globales
à cinq ans de l’ordre de 40% (4-6) alors qu’une chirurgie incom-
plète fait chuter cette survie globale à moins de 10%. Dans une
étude réalisée chez 55 patients opérés à l’Institut Gustave-Roussy
(7),ceux dont la tumeur était localisée à l’estomac et chez les-
quels avait été effectuée une résection cunéiforme avaient un taux
de récidive locale important. En revanche, il n’y avait pas de dif-
férence entre les patients qui avaient eu une gastrectomie totale
ou une gastrectomie partielle, car ces patients récidivaient dans
les deux cas sous forme de métastases ou de sarcomatose. Lorsque
la tumeur est localisée à l’estomac, une résection cunéiforme
apparaît donc insuffisante, mais la gastrectomie totale semble
excessive si elle n’est pas imposée par des contraintes anatomiques.
Tumeur localement évoluée
Dans la littérature, la taille moyenne de ces tumeurs oscille entre
10 et 15 cm. Il s’agit dans plus de la moitié des cas de tumeurs
étendues localement à d’autres organes de voisinage. Le caractère
complet de la chirurgie n’est souvent possible qu’en effectuant
l’exérèse des viscères adjacents envahis. Parmi 55 patients avec
une tumeur stromale du grêle (8),Yao rapporte qu’il a été néces-
saire dans 35% des cas d’élargir la chirurgie aux viscères adja-
cents. Le plus souvent, il s’agit de la rate et de la queue du pan-
créas, mais également du diaphragme, du côlon et de la vessie.
L’exérèse du viscère primitivement atteint en monobloc, avec celle
des viscères atteints par contiguïté, permet d’obtenir des médianes
de survie globale de l’ordre de 36 mois proches de celles des
patients qui avaient une tumeur localisée sans extension à un vis-
cère adjacent (9). En revanche, les médianes de survie des patients
qui ont eu une exérèse incomplète sont inférieures à deux ans. Il
est donc tout à fait justifié en cas de tumeur localement évoluée
d’effectuer une exérèse complète, même au prix de l’exérèse de
viscères adjacents, puisque c’est le caractère complet de l’exérèse
qui est le facteur pronostique thérapeutique déterminant.
Il est nécessaire d’opérer les patients en évitant toute rupture
tumorale, car celle-ci, spontanée ou liée aux manipulations opé-
ratoires, entraîne une survie équivalente à celle des patients qui
ont eu une exérèse incomplète, de l’ordre de 17 mois.
Curage ganglionnaire
La plupart des équipes observent un taux d’envahissement gan-
glionnaire inférieur à 10% sur les pièces d’exérèse, et le risque
de récidive ganglionnaire est inférieur à 5%. Le curage gan-
glionnaire n’est donc pas systématique. Lors d’une laparotomie
effectuée en urgence, l’existence d’une tumeur digestive volu-
mineuse sans adénopathie doit faire penser préférentiellement à
une tumeur stromale.
Modalités de récidives
Une récidive est observée chez 40% des patients lorsque l’exé-
rèse est macroscopiquement complète, survenant avec un délai
médian de l’ordre de 2 ans (4). La plupart des récidives sont intra-
abdominales. Sur une série de 80 patients ayant eu l’exérèse com-
plète d’une tumeur stromale digestive, De Matteo rapporte 63%
de récidives hépatiques et 21% de récidives péritonéales. Les
équipes du MSKCC et de Boston n’ont pas retrouvé de caractère
péjoratif à l’envahissement microscopique des marges de résec-
tion. Cela est probablement lié au fait que les marges correspon-
dant à la tranche de section chirurgicale et les marges corres-
pondant à la séreuse ne sont pas différenciées, que la plupart de
ces tumeurs sont des tumeurs localement évoluées dont la séreuse
est donc envahie, ce qui expose ces patients à des récidives péri-
tonéales.
Traitement des récidives péritonéales
En l’absence de chimiothérapie générale ayant montré une effi-
cacité, on pouvait proposer jusqu’à présent l’exérèse complète
des nodules de sarcomatose lorsque la tumeur primitive était
contrôlée. Afin de diminuer le risque de récidives loco-régionales,
le rôle de la chimiothérapie intrapéritonéale a été étudié dans une
étude prospective randomisée comparant son adjonction ou non
après exérèse complète d’une sarcomatose (10). Les médianes de
survie sans récidive et de survie globale étaient identiques dans
les deux groupes (12,5 et 29 mois). Ces médianes de survie sont
comparables à celles rapportées par l’équipe du MD Anderson
DOSSIER THÉMATIQUE

La lettre de l’hépato-gastroentérologue - n° 2 - vol. V - mars-avril 2002
72
dans des études de phase II y associant l’hyperthermie. L’addi-
tion de chimiothérapie intrapéritonéale n’a donc pas modifié la
survie des patients après exérèse complète de ces sarcomatoses,
le facteur pronostique déterminant pour la survie étant la qualité
de l’exérèse chirurgicale.
PERSPECTIVES CHIRURGICALES
À L’HEURE DE GLIVEC (STI 571)
Depuis août 2000, l’utilisation de Glivec (STI 571) a révolutionné
la prise en charge de ces tumeurs jusque-là particulièrement chi-
miorésistantes. Le STI 571 est un inhibiteur sélectif des tyrosines-
kinases. Il s’agit du premier exemple de traitement moléculaire
ciblé dans une néoplasie solide humaine (11). Dans une étude de
phase II multicentrique ayant inclus 148 patients depuis juillet
2000, 82% des patients ont eu une maladie contrôlée non évolu-
tive plus d’un an après l’activation de l’étude (réponses complètes
additionnées des réponses partielles et maladies stables). Il faut
rappeler que les sarcomes rétropéritonéaux en majorité n’expri-
ment pas c-kit. Quelque sarcomes rétro-péritonéaux qui l’expri-
maient ont reçu cette molécule et n’ont pas répondu. Les com-
plications chirurgicales observées chez ces patients traités par
Glivec (STI 571) ont été des perforations et des hémorragies. Les
perforations sont survenues lorsque l’exérèse de la tumeur pri-
mitive n’avait pas été effectuée. Les nodules de sarcomatose expo-
sent moins à ce risque. Des ruptures hémorragiques de volumi-
neuses masses littéralement liquéfiées sont survenues chez
certains patients dont la maladie était stabilisée.
Chez les patients ayant une tumeur localement évoluée, dont la
chirurgie nécessiterait l’exérèse de viscères adjacents, il faudra
probablement discuter l’utilisation de Glivec (STI 571) en situa-
tion néo-adjuvante de façon à faciliter et à minimiser un geste
chirurgical secondaire après réponse objective, avec cependant
un risque perforatif qui reste à évaluer.
Lors de l’exérèse d’une tumeur stromale digestive associée de
manière synchrone à une sarcomatose et/ou à des métastases
hépatiques, il paraît utile d’effectuer l’exérèse de la tumeur pri-
mitive afin d’éviter une complication à type de perforation. En
revanche, l’exérèse concomitante de la sarcomatose péritonéale
n’apparaît plus nécessaire, puisqu’elle sera accessible au traite-
ment par Glivec (STI 571). En cas de réponse objective, il fau-
dra à l’avenir discuter l’exérèse de reliquats tumoraux stables sus-
ceptibles d’entraîner une complication.
CONCLUSION
Le traitement chirurgical d’une tumeur stromale digestive loca-
lisée doit être macroscopiquement complet en privilégiant une
exérèse fonctionnelle. Comme pour les autres sarcomes, le
curage ganglionnaire n’est pas systématique. Les lésions diffuses
à type de sarcomatoses ou de métastases relèvent maintenant
d’un traitement médical par Glivec (STI 571). De nouvelles
stratégies chirurgicales devraient se dégager avec l’utilisation de
cette nouvelle molécule. ■
Mots clés. Tumeurs stromales digestives – Sarcomatose –
Glivec (STI 571).
RÉFÉRENCES BIBLIOGRAPHIQUES
1.
Miettinen M, Furlong M, Sarlomo-Rikala M et al. Gastrointestinal stromal
tumors, intramural leiomyomas, and leiomyosarcomas in the rectum and anus : a
clinicopathologic, immunohistochemical, and molecular genetic study of 144
cases. Am J Surg Pathol 2001, 25 : 1121-33.
2.
Andra-Luca A, Nahon P, Flejou JF et al. Hétérogénéité immunohistochimique
et ultrastructurale des tumeurs stromales digestives. Gastroenterol Clin Biol
2001; 25 : 664-8.
3.
Miettinen M, Lasota J. Gastrointestinal stromal tumors-definition, clinical,
histological, immunohistochemical, and molecular genetic features and differen-
tial diagnosis. Virchows Arch 2001 ; 438 :1-12.
4.
Dematteo RP, Lewis JJ, Leung D et al. Two hundred gastrointestinal stromal
tumors : recurrence patterns and prognostic factors for survival. Ann Surg 2000;
231 : 51-8.
5.
Crosby JA, Catton CN, Davis A et al. Malignant gastrointestinal stromal
tumors of the small intestine : a review of 50 cases from a prospective database.
Ann Surg Oncol 2001 ; 8 : 50-9.
6.
Pierie JP, Choudry, Muzikanski A et al. The effect of surgery and grade on out-
come of gastrointestinal stromal tumors. Arch Surg 2001 ; 136 : 383-9.
7.
Bonvalot S, Boige V, Apariccio T et al. Surgical management of gastrointesti-
nal stromal tumors (GIST). Eur J Cancer 1999 ; 35 : 1079.
8.
Yao KA, Talamonti MS, Langella RL et al. Primary gastrointestinal sarcomas :
analysis of prognostic factors and results of surgical management. Surgery 2000;
128 : 604-12.
9.
Ng EH, Pollock RE, Munsell MF et al. Prognostic factors influencing survival
in gastrointestinal leiomyosarcomas. Implications for surgical management and
staging. Ann Surg 1992 ; 215 : 68-77.
10.
Calvacanti A, Bonvalot S, Elias D et al. Intraperitoneal chemotherapy after
complete resection of peritoneal sarcomatosis: results of a monocentric rando-
mized study. Eur J Cancer 2001 37 : 309.
11.
Tuveson DA, Willis NA, Jacks T et al. STI 571 inactivation of the gastrointes-
tinal stromal tumor c-KIT oncoprotein : biological and clinical implications.
Oncogene 2001 ; 20 : 5054-8.
DOSSIER THÉMATIQUE
Abonnez-vous !
Abonnez-vous
Abonnez-vous !
!
Abonnez-vous !
Abonnez-vous !
Abonnez-vous !
Abonnez-vous !
Abonnez-vous !!
Abonnez-vous !
AAbboonnnneezz--vvoouuss!!
1
/
3
100%