Effets✓des✓traitements✓ sur✓la✓fonction✓gonadique✓masculine✓ et✓préservation✓de✓la✓fertilité Effects of treatments and male fertility preservation

Correspondances en Onco-hématologie - Vol. V - n° 4 - octobre-novembre-décembre 2010
212
dossier thématique
Risques organiques
Partie I
Effets✓des✓traitements✓
sur✓la✓fonction✓gonadique✓masculine✓
et✓préservation✓de✓la✓fertilité
Effects of treatments and male fertility preservation
I. Berthaut*, C. Ravel*
* Centre d’étude et de
conservation des œufs
et du sperme humains
(CECOS), service
d’histologie, biologie
de la reproduction,
hôpital Tenon, Paris.
Les gonades sont des organes très sensibles aux
e ets des traitements anticancéreux, qui pren-
nent pour cible les cellules en division, a ectant
ainsi la lignée germinale. Les dommages sont spéci-
ques aux molécules et sont dose-dépendants, mais
ils sont également modulés par la susceptibilité indi-
viduelle à la toxicité des traitements.
Cancer et fertilité
Le nombre d’hommes survivant à un cancer survenu
dans l’enfance a augmenté de façon spectaculaire au
cours des 20 dernières années ; cela est dû à l’amélio-
ration des thérapies anticancéreuses. La projection
dans l’avenir et l’anticipation des e ets secondaires du
traitement pouvant retentir sur la qualité de vie sont
donc devenues un enjeu important chez ces patients.
Toutefois, un processus cancéreux peut présenter des
e ets néfastes sur la fertilité masculine, avant même
le début d’un traitement cytotoxique : environ 12 %
des patients venant faire cryoconserver leurs gamètes
avant le début d’une chimiothérapie présentent une
azoospermie ou une nécrozoospermie rendant toute
cryopréservation impossible (1). Tout cancer s’associe
de fait à une réaction de l’organisme entraînant un
accroissement du catabolisme, une augmentation des
hormones du stress et une diminution des taux de gona-
dotropines, susceptibles de retentir sur la fertilité (2).
Des e ets systémiques, comme la èvre fréquente et
les sueurs nocturnes chez les patients porteurs de la
maladie de Hodgkin, ou des e ets immunologiques,
comme la présence d’agglutinines, peuvent également
être incriminés dans l’altération des paramètres sper-
matiques.
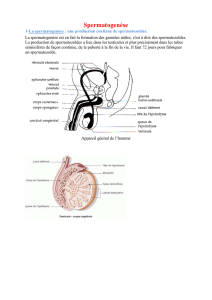
La spermatogenèse
La spermatogenèse est un processus complexe de
di érenciation cellulaire, débutant avec les cellules
germinales – ou spermatogonies – localisées à la base
R É S U M É
Summary
»
Les traitements issus du progrès de la lutte contre le cancer
permettent d’augmenter de façon significative la survie de
certains groupes de patients cancéreux. Il est donc important
pour les sujets en âge de procréer de savoir si ces traitements
peuvent avoir des conséquences sur leur spermatogenèse et
sur leur descendance. La gonadotoxicité dépend des molécules
utilisées, mais relève aussi d’une susceptibilité individuelle. Les
possibilités de préservation de la fertilité existent dans la plupart
des cas et à tous les âges, même si certaines techniques sont
encore expérimentales.
Mots-clés✓:✓Spermatogenèse✓–✓Gonadotoxicité✓–✓Préservation✓de✓
la✓fertilité.
Advances in medicine and therapy have signifi cantly increased
the rate of survival in certain types of cancers. In order to
preserve their fecundity it remains imperative to assess the
role of the treatments off ered not only on the spermatogenic
potential of the survivors, but also on the genetic and epigenetic
integrity of the sperm, since this has implications on the
progeny. Gonadotoxicity depends both on the therapeutic
agent as well as the individual susceptibility of each patient.
Irrespective of the age, several possibilities, some still in
experimental stages, exist to preserve the fertility in these men.
Keywords: Spermatogenesis – Gonadotoxicity – Fertility
preservation.

Correspondances en Onco-hématologie - Vol. V - n° 4 - octobre-novembre-décembre 2010
213
Eff ets des traitements sur la fonction gonadique masculine et préservation de la fertilité
de l’épithélium séminifère et s’achevant avec les sperma-
tozoïdes ( gure 1). Elle comprend 3 étapes distinctes :
✓✓
la prolifération et la di érenciation des spermato-
gonies diploïdes ;
✓✓la méiose dans les spermatocytes ;
✓✓
la di érenciation des spermatides rondes en sperma-
tozoïdes, cellules haploïdes hyper-spécialisées (étape
postméiotique).
La barrière hémato-testiculaire peut cependant per-
mettre le passage sélectif d’un traitement cytotoxique,
ce qui in uence la spermatogenèse au moins tempo-
rairement et, dans certains cas, de façon permanente,
se traduisant alors par une oligozoospermie, voire une
azoospermie. Cette altération dépend essentiellement
de la combinaison des médicaments utilisés et de la
dose cumulée. La restauration éventuelle d’une sper-
matogenèse après traitement anticancéreux dépend
de l’intégrité des spermatogonies et de leur capacité
à se di érencier.
Gonadotoxicité
Parmi les agents gonadotoxiques, les agents alkylants
sont connus pour entraîner une déplétion cellulaire
de l’épithélium germinal, qui se traduit par une oligo-
zoospermie très sévère, voire une azoospermie avec
faible récupération à long terme (tableau I, p. 214).
Une forte incidence d’azoospermie (85,4 %) est éga-
lement observée chez les jeunes patients après une
gre e de moelle, qui associe au conditionnement par
le cyclophosphamide une irradiation corporelle totale
(3). La majorité des patients traités par procarbazine
(traitement des lymphomes) devient également stérile
(4). Le protocole MOPP (méchloréthamine, oncovin/
vincristine, procarbazine, prednisone), utilisé dans le
traitement de la maladie de Hodgkin, entraîne une
azoospermie chez 90 % des patients.
Concernant la radiothérapie, la sensibilité du testicule
dépend du type de rayons, de la localisation de l’irra-
diation, de la dose totale, de la dose cumulée, de la
voie d’administration, de la pathologie et de l’âge du
patient. Des doses de 0,1-1,2 Gy peuvent perturber la
spermatogenèse, et des doses supérieures à 4 Gy cau-
sent des dégâts irréversibles. Les cellules somatiques
sont plus résistantes que les cellules germinales. Il faut
dépasser la dose de 20 Gy chez le garçon prépubère et
de 30 Gy chez le sujet pubère pour observer un dys-
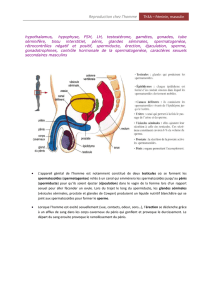
fonctionnement leydigien. L’irradiation cérébrale peut
aussi a ecter la spermatogenèse par une atteinte de
l’axe hypothalamo-hypophyso-gonadique ( gure 2,
p. 216) [5].
État des lieux des principales hémopathies
malignes
Lymphomes
S.S. Kulkarni et al. (6) ont évalué l’impact de l’association
doxorubicine, bléomycine, vinblastine et dacarbazine
(ABVD) sur les fonctions endocrine et exocrine gona-
diques de 38 patients âgés de plus de 15 ans, en rémis-
sion complète d’une maladie de Hodgkin. Un premier
groupe a reçu un traitement par ABVD, et le second
une association ABVD + COPP ou MOPP. Les analyses
des paramètres spermatiques et hormonaux, réalisées
en moyenne 3 ans après le traitement, ont montré une
toxicité gonadique moindre dans le groupe traité par
ABVD (1 seul cas avéré d’azoospermie sur 26 patients,
dont 3 patients ayant conçu spontanément) contre
10 cas d’azoospermie sur 12 patients dans le groupe
ABVD + COPP (p < 0,001). Cette toxicité du MOPP a été
con rmée par d’autres études (7).
Les patients recevant une dose cumulative de cyclo-
phosphamide supérieure à 10 g/m2 ont un très fort
risque de stérilité dé nitive (8).
Leucémie✓myéloïde✓chronique
Les e ets sur la descendance des hommes traités par
inhibiteurs de tyrosine kinases (ITK) sont rares. Dans
la littérature, plusieurs grossesses chez les conjointes
d’hommes traités par imatinib ont été récemment rap-
portées : 5 grossesses n’ont pas été menées à terme
(2 IVG, 2 fausses couches spontanées et 1 mort fœtale
in utero à la 13
e
semaine) et 22 autres ont abouti à la
naissance de 22 enfants bien portants, excepté un cas
Figure 1. Architecture testiculaire.
Flagelles
des spermatozoïdes
dans la lumière du
tube séminifère
Spermatides rondes
Cellules interstitielles
de Leydig
Spermatocytes
Barrière hémato-testiculaire
Spermatogonies
Noyau de
la cellule de Sertoli
Cellules myoïdes
Capillaire
sanguin

Correspondances en Onco-hématologie - Vol. V - n° 4 - octobre-novembre-décembre 2010
214
Risques organiques
Partie I
dossier thématique
de mauvais positionnement du grêle traité chirurgicale-
ment sans complications (9-12). Neuf grossesses chez les
partenaires d’hommes traités par dasatinib ont abouti
à la naissance de 8 enfants en bonne santé et d’une
fausse couche spontanée (13, 14). Aucune donnée n’est
publiée concernant l’impact du nilotinib chez l’homme.
Le traitement par hydroxyurée (HU) n’est plus d’actualité
dans la leucémie myéloïde chronique, même s’il peut
encore être prescrit à la phase initiale de la maladie. Le
caractère gonadotoxique de cet agent fait actuellement
l’objet d’études chez les patients drépanocytaires, pour
lesquels seules quelques publications font état des
paramètres spermatiques. Nous avons con rmé ces
résultats dans un récent article, en mettant en évidence
que 91 % des patients avaient au moins un paramètre
spermatique anormal avant le traitement (15). Les
données concernant l’e et du traitement par HU sur
la spermatogenèse sont encore plus parcellaires : un cas
d’hypogonadisme et un cas d’azoospermie survenus
après le traitement ont été décrits (16, 17) ; la littéra-
ture a rapporté une azoospermie survenue durant le
traitement, réversible quelques mois après l’arrêt du
traitement (18, 19). Dans notre étude rétrospective,
nous avons pu étudier les paramètres spermatiques de
5 patients sous HU et avons constaté que le nombre de
spermatozoïdes produits par les patients traités était
20 fois moins important pendant le traitement. Après
l’arrêt du traitement (6 mois à 5 ans), le nombre de sper-
matozoïdes produits ne retrouvait pas son niveau initial
et la production restait toujours 2 fois moins importante.
Un des patients était toujours azoospermique 4 ans
après l’arrêt du traitement. Les altérations spermatiques
pourraient donc être potentiellement exacerbées par
le traitement par HU.
Tableau I. E ets des traitements utilisés en hématologie pouvant altérer la fertilité masculine.
Type d’altération Molécule Gonadotoxicité
Atteinte de l’épithélium séminal Alkylants:
Cyclophosphamide
Chlorméthine
Ifosfamide
Busulfan
Chlorambucil
Procarbazine
Melphalan
+++
+++
+++
+++
+++
+++
+++
Altération de l’ADN Cisplatine
Carboplatine
Actinomycine D
Bléomycine
Mitoxantrone
+++
++
+
++
+
Anti-topoisomérases II Doxorubicine +
Inhibiteurs de la formation
des microtubules
Vincristine
Vinblastine
++
++
Antifoliques Méthotrexate
Mercaptopurine
+
+
Protocoles de chimiothérapie :
– entraînant une azoospermie prolongée,
voire défi nitive
MOPP
(chlorméthine, vincristine, procarbazine, prednisone)
ChiVPP
(chlorambucil, vincristine, procarbazine)
COPP
(cyclophosphamide, vincristine, procarbazine, prednisone)
+++
si > 6 cures: 90% d’azoospermie
+++
90% d’azoospermie
+++
si > 6 cures: 90% d’azoospermie
– entraînant une azoospermie transitoire CHOP
(adriamycine, cyclophosphamide, vincristine, prednisone)
++
30% d’azoospermie
Atteinte variable ABVD
(doxorubicine, bléomycine, vinblastine, dacarbazine)
BEP
(bléomycine, étoposide, cisplatine)
+
90% normospermie
++
>>>
11
111
DÉ JÀ
PRÉSENT
DANS LES SOINS
DE SUPPORT, HOSPIRA,
EXPERT EN
ONCOLOGIE-
HÉMATOLOGIE
,
S’ENGAGE DANS
LA PRISE EN CHARGE DES
MALADIES
ORPHELINES
. DÉJÀ PRÉSENT DANS LES
SOINS DE SUPPORT, HOSPIRA, EXPERT EN
MALADIES ORPHELINES
. DÉJÀ PRÉSENT DANS LES SOINS
DE SUPPORT, HOSPIRA, EXPERT EN
S’ENGAGE DANS LA PRISE EN CHARGE DES
DÉJÀ PRÉSENT DANS LES SOINS DE SUPPORT, HOSPIRA, EXPERT
EN
ONCOLOGIE-HÉMATOLOGIE
,
S’ENGAGE DANS LA PRISE EN
CHARGE DES
MALADIES ORPHELINES
MALADIES ORPHELINES
.
.
ORPHELINES
. DÉJÀ PRÉSENT DANS LES
SOINS DE SUPPORT, HOSPIRA, EXPERT EN
ONCOLOGIE-
S’ENGAGE DANS LA PRISE EN CHARGE DES
. DÉJÀ PRÉSENT DANS LES SOINS
ONCOLOGIE-HÉMATOLOGIE
,
MALADIES ORPHELINES
.
.
DÉJÀ PRÉSENT DANS LES SOINS DE SUPPORT, HOSPIRA, EXPERT
DÉJÀ PRÉSENT DANS LES SOINS DE SUPPORT, HOSPIRA, EXPERT
S’ENGAGE DANS LA PRISE EN
S’ENGAGE DANS LA PRISE EN
DÉJÀ PRÉSENT DANS LES SOINS DE SUPPORT, HOSPIRA, EXPERT
ONCOLOGIE-HÉMATOLOGIE
DÉJÀ PRÉSENT DANS LES SOINS DE SUPPORT, HOSPIRA, EXPERT
S’ENGAGE DANS LA PRISE EN CHARGE DES
MALADIES ORPHELINES
MALADIES ORPHELINES
S’ENGAGE DANS LA PRISE EN CHARGE DES
MALADIES ORPHELINES
S’ENGAGE DANS LA PRISE EN CHARGE DES
DE SUPPORT, HOSPIRA, EXPERT EN
ONCOLOGIE-HÉMATOLOGIE
ONCOLOGIE-HÉMATOLOGIE
DE SUPPORT, HOSPIRA, EXPERT EN
MALADIES ORPHELINES
. DÉJÀ PRÉSENT DANS LES SOINS
. DÉJÀ PRÉSENT DANS LES SOINS
ONCOLOGIE-HÉMATOLOGIE
HÉMATOLOGIE
,
S’ENGAGE DANS LA PRISE EN CHARGE DES
. DÉJÀ PRÉSENT DANS LES SOINS
S’ENGAGE DANS LA PRISE EN CHARGE DES
. DÉJÀ PRÉSENT DANS LES SOINS

Correspondances en Onco-hématologie - Vol. V - n° 4 - octobre-novembre-décembre 2010
216
Risques organiques
Partie I
dossier thématique
Tableau II. Indications des autoconservations (AC) avant traitement potentiellement stérilisant par an en France (source : Fédération française des CECOS).
Nb de patients ayant autoconservé
(% par rapport au total AC) Patients azoospermiques
(% par rapport au nb de patients
ayant autoconservé pour la même
indication)
Patients n’ayant pas réussi à recueillir
(% par rapport au nb de patients
ayant autoconservé pour la même
indication)
MDH 357 (12,3%) 8 (2,2%) 15 (4,2%)
LMNH 225 (7,8%) 13 (5,8%) 11 (4,9%)
Leucémies 261 (9%) 9 (3,4%) 22 (8,4%)
Total AC 2889 135 139
MDH : maladie de Hodgkin. LMNH : lymphome malin non hodgkinien.
Leucémie✓aiguë✓lymphoblastique
Les patients ayant présenté dans l’enfance une leu-
cémie aiguë lymphoblastique (LAL) et traités par
radiothérapie sont à risque d’altération de la fertilité
en cas d’irradiation corporelle totale ou testiculaire.
En revanche, N.J. van Casteren et al. (20) n’ont pas
trouvé que l’irradiation cérébrale, autrefois utilisée
en prophylaxie du système nerveux central (SNC),
avait un e et délétère à long terme sur la fonction
gonadique et sur le volume testiculaire des patients
ayant survécu à une LAL.
La chimiothérapie seule, même à dose modérée, est
également gonadotoxique : près de 1 patient sur 2
présentera des paramètres spermatiques altérés à
l’âge adulte, sans qu’il y ait d’altération hormonale
majeure (21) ; la fécondité est néanmoins préservée
chez pratiquement tous les garçons dans le cadre
des protocoles actuels. Les thérapies n’incluant pas
de cyclophosphamide à forte dose n’ont pas d’e ets
sur le nombre de spermatogonies présentes dans les
biopsies testiculaires des patients prépubères (22). Le
risque de stérilité concerne les seuls enfants présentant
une rechute pendant le traitement, auxquels on devra
prescrire une chimiothérapie intensive puis indiquer
une gre e de moelle, sans possibilité de recueillir de
sperme à ce stade.
Cryoconservation
La cryoconservation du sperme avant traitement
potentiellement stérilisant est une technique bien
établie (tableau II). Il est recommandé de cryoconser-
ver 3 éjaculats associés à une période d’abstinence de
48 heures d’intervalle entre chaque recueil. En pratique,
les patients sont souvent adressés au CECOS en urgence,
24 heures avant la mise en route de la chimiothéra-
pie, laissant de fait peu d’alternatives. La congélation
dans l’azote liquide entraîne quasi systématiquement
une altération des paramètres spermatiques, avec une
diminution d’environ 25 % des spermatozoïdes mobiles
progressifs. Néanmoins, dans la très grande majorité
des cas et même si la qualité spermatique est faible,
le sperme autoconservé est utilisable en assistance
médicale à la procréation (AMP) [23].
Cas✓de✓l’adolescent
L’autoconservation de spermatozoïdes est réalisable
chez l’adolescent. Sa faisabilité va dépendre de la matu-
rité physiologique et psychique de l’adolescent. Selon
les sources de la Fédération française des CECOS, la
congélation est possible chez 80 % des adolescents de
plus de 15 ans, mais chez seulement 61 % des moins
de 15 ans, car, dans cette tranche d’âge, il y a échec du
Figure 2. Axe hypothalamo-hypophyso-gonadique chez l’homme.
Inhibine B
Cellule de Sertoli
Rétrocontrôle
négatif
Cellule germinale
Cellule de Leydig
LH
Hypothalamus
Hypophyse
Testicule
Androgènes
FSH
GnRh
>>>

Correspondances en Onco-hématologie - Vol. V - n° 4 - octobre-novembre-décembre 2010
217
Eff ets des traitements sur la fonction gonadique masculine et préservation de la fertilité
recueil chez plus d’un quart des patients et une azoos-
permie plus fréquente. Lorsque le recueil est possible,
les prélèvements obtenus sont de qualité su sante pour
être potentiellement utilisables ultérieurement en AMP.
Cas✓de✓l’enfant
La congélation du tissu germinal testiculaire pour
l’enfant ou l’adolescent n’est pratiquée à l’heure actuelle
qu’à titre expérimental, dans le cadre du programme
hospitalier de recherche clinique (PHRC) national
dans le champ du cancer (coordonnateur : Pr Rives,
Fédération des CECOS). Il s’agit d’étudier les e ets des
traitements sur le tissu germinal testiculaire obtenu lors
des conservations réalisées chez l’enfant devant avoir
une intensi cation thérapeutique ou un traitement
de conditionnement avant autogre e ou allogre e de
cellules souches hématopoïé tiques. Les modalités de
réutilisation de ces tissus germinaux congelés restent
toutefois à développer.
Risques pour la descendance
Pour les patients en âge de procréer, il est important
de savoir si ces traitements peuvent avoir des consé-
quences sur leur descendance, en termes de muta-
tions germinales et d’augmentation du risque de
cancer. Ces mutations pourraient entraîner des mal-
formations congénitales ou des pathologies géné-
tiques. En e et, les doses utilisées chez l’homme sont
mutagènes dans les modèles animaux et plusieurs
chimiothérapies induisent des anomalies chromoso-
miques des spermatozoïdes de patients traités (24).
Les agents alky lants sont mutagènes à tous les stades
de la maturation des cellules germinales mâles mais
ne semblent pas entraîner de risque de transmission
d’anomalies chromo somiques. Il est donc préférable
de réaliser la cryoconservation avant tout traitement,
mais la question de l’indication de la cryoconservation
sous traitement peut parfois se poser. Le PHRC natio-
nal GAMATOX (coordonnateur : Dr Bujan) impliquant
10 centres CECOS français se penche actuellement sur la
question et analyse le retentissement direct de la radio-
chimiothérapie sur une grande cohorte d’hommes en
âge de procréer. En e et, certaines études semblent
montrer une augmentation du risque d’aneuploïdie par
atteinte du génome du spermatozoïde, entraînant un
risque direct sur la descendance. Les patients atteints
d’un lymphome hodgkinien auraient ainsi une augmen-
tation plus importante du taux d’aneuploïdies pour les
chromosomes X, Y, 18, 13 et 21 pendant leur traitement,
taux qui décroît progressivement au bout de 18 mois
en comparaison avec des patients atteints d’un cancer
testiculaire (25). Dans tous les cas, il est recommandé de
contrôler la spermatogenèse 6 à 12 mois après l’arrêt
de tout traitement.
Jusqu’à présent, aucune étude n’a fait état d’une aug-
mentation du taux de malformations congénitales ou
d’a ections malignes chez les enfants nés de pères
ayant eu une chimio- ou une radiothérapie (26, 27). Il
ne semble pas non plus y avoir d’augmentation des
risques obstétricaux ou périnataux ni de faible poids
de naissance (28).
Conclusion
Environ 15 % des hommes utilisent leur sperme cryo-
conservé en raison d’une azoospermie persistante après
traitement anticancéreux (29). Le sperme stocké peut
être utilisé très longtemps après la congélation. Des
grossesses ont été obtenues avec des spermatozoïdes
cryoconservés 30 ans auparavant. Cela est rassurant
pour le stockage des spermatozoïdes des jeunes ado-
lescents et des hommes jeunes qui seraient amenés à
utiliser leur sperme 15 à 20 ans après la congélation.
Avec l’avènement de l’injection intra-cytoplasmique
de spermatozoïdes (ICSI), même les spermes de qualité
très médiocre peuvent être stockés et utilisés avec des
chances de conception.
■
CECOS PARIS TENON
Centre d’étude et de Conservation des Œufs et du Sperme humains - 4, rue de la Chine - 75020 Paris
Responsable : Dr Jacqueline Mandelbaum - Tél. : 01 56 01 78 01/02 - Fax : 01 56 01 78 03
Bâtiment Le Lorier - Secteur marron - 1er sous-sol (de la maternité) - Entrées : portes 1 ou 7
Site Internet de la Fédération des CECOS : www.cecos.net
Autres contacts :
– isabelle. [email protected]
– [email protected].fr
et aussi :
– www.agence-biomedecine.fr
– www.dondespermatozoides.fr
>>>
Références
bibliographiques
page suivante
 6
6
 7
7
1
/
7
100%