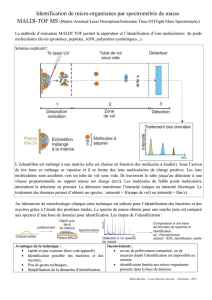
Projet Biomédical 2013-2014 : ----- Sujet d’étude :

Projet Biomédical 2013-2014 :
-----
Sujet d’étude :
“Spectrométrie de masse“
Ingé resp.: Yves Maggiore
yves.maggiore@ap-hm.fr
Titre :
“Utilisation de la spectrométrie de masse
dans les laboratoires de biologie hospitalière,
applications, principes, matériel, résultats attendus. “
Par Aurélien Gavelle et Victor Meyer

Remerciement :
Enseignants chercheurs :
Christophe FLAUDROPS
Jean LORQUIN
Maitre de projet
Yves MAGGIORE

GLOSSAIRE
Cryocoupe : Tranche de tissu congelé de l’ordre de 10 à 20 µm d’épaisseur.
UPLC : Chromatographie haute performance en phase liquide, technique de
séparation de molécules par chromatographie.
MS : Spectromètre de masse.
MS/MS : La spectrométrie de masse en tandem consiste à sélectionner un ion
par une première spectrométrie de masse, à le fragmenter, puis à effectuer
une deuxième spectrométrie de masse sur les fragments ainsi générés.
Protéomique : désigne la science qui étudie les protéomes, c'est-à-dire
l'ensemble des protéines d'une cellule, d'un organite, d'un tissu, d'un organe
ou d'un organisme.
Ionisations dures : génèrent souvent des ions moléculaires, qui se fragmentent
beaucoup et parfois même totalement avant d’avoir eu le temps de sortir de la
source.
Ions métastables : ions de durée de vie suffisamment longue pour sortir de
l’ionisateur mais pas suffisamment pour sortir de l’analyseur et arriver au
détecteur. Leurs fragments peuvent être analysés et donnent des informations
de structures.
Nébulisation : Transformer certains liquides en un nuage de particules
extrêmement fines.
Rapport m/z : rapport de la masse de la molécule sur son nombre de protons.
Peptide : Moins de 100 acides aminés (masse moléculaire moyenne).
Protéine : Plus de 100 acides aminés (grosse masse moléculaire).

Table des matières
I. Présentation du spectromètre de masse ................................................... 5
A. Principe et historique .............................................................................. 5
B. Principes physiques ................................................................................ 6
II. Principe de fonctionnement ....................................................................... 8
A. Les différents types d'ionisateur ............................................................. 8
B. Analyseur rapport masse / nombre de masse ...................................... 12
C. Détecteur et Traitement du signal ......................................................... 15
III. Utilisation dans la pratique ...................................................................... 16
A. Utilisation du spectromètre de masse en milieu médical ...................... 16
B. Aspects économique et position sur le marché du matériel Biomédical
Aspects réglementaires (normes, dangers potentiels pour utilisateur)....... 19
C. Perspective d’évolution: (imagerie par spectromètre de masse) .......... 20
IV. Conclusion ................................................................................................ 21

Introduction :
Le spectromètre de masse est un instrument très répandu dans les domaines
scientifiques. La spectrométrie de masse joue aujourd'hui un rôle important dans les
études de pollution, de l'environnement et même dans la détection du dopage grâce
à sa sensibilité, sa sélectivité et sa possibilité de faire des analyses quantitatives
rapides.
Il est aussi utilisé dans le domaine du laboratoire hospitalier. En effet, cet
instrument permet de détecter et de différencier (qualitativement et
quantitativement) la présence de différents particules ou organismes unicellulaires.
L'évolution de l'informatique (hardware/software) a également permis à la
spectrométrie de masse de connaître son plein épanouissement.
Le spectromètre de masse fonctionne par excitation d’un élément à analyser
(ionisation) puis par séparation en fonction du rapport masse/nombre de protons de
cette particule ionisée (rapport m/z) pour en déterminer la nature.
I. Présentation du spectromètre de masse
A. Principe et historique
La spectrométrie de masse est une technique analytique très puissante et très
sensible permettant d'analyser des composés organiques solides, liquides ou
gazeux. C'est Joseph John Thomson, déjà célèbre pour avoir découvert l'électron
en 1895 (prix Nobel de physique en 1906), qui en a établi le principe en mettant au
point un appareil permettant de séparer les atomes par leur masse, montrant ainsi
l'existence d'isotopes stables du néon.
Cette séparation des atomes réalisée en 1908 constitue le premier exemple de la
spectrométrie de masse.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
1
/
22
100%