Ovaires polykystiques Dossier L Physiopathologie du syndrome

Métabolismes Hormones Diabètes et Nutrition (VIII), n° 4-5, juillet/octobre 2004
Ovaires polykystiques
Dossier
153
Physiopathologie du syndrome
des ovaires polymicrokystiques (SOPMK)
Pathophysiology of polycystic ovary syndrome
S. Jonard, D. Dewailly*
L
e syndrome des ovaires poly-
microkystiques (SOPMK) est
la cause la plus fréquente
d’anovulation, d’infécondité et
d’hyperandrogénie chez la femme,
puique, en effet, 5 à 10 % des
femmes en âge de procréer en sont
affectées (1). En dépit des efforts
considérables qui ont été accomplis
pour en déterminer la cause, la phy-
siopathologie du SOPMK reste mal
comprise ; mais les preuves s’accu-
mulent pour suggérer que les ano-
malies centrales du SOPMK sont
primitivement ovariennes (2). La
connaissance des mécanismes condui-
sant au SOPMK est l’un des sujets
majeurs de la recherche clinique en
gynécologie endocrinienne et en
médecine de la reproduction.
Le phénotype du SOPMK peut être
divisé en trois composantes : l’ano-
vulation, l’hyperandrogénie et le
syndrome métabolique (dont l’hyper-
insulinisme, secondaire à l’insulino-
résistance, est l’anomalie centrale).
L’hyperandrogénie apparaît de plus
en plus comme le “cœur” du SOPMK,
dont le premier impact serait l’alté-
ration de la folliculogenèse. L’hyper-
insulinisme agirait non pas comme
un facteur causal, mais comme un
“2ehit” (deuxième événement), ni
nécessaire ni suffisant pour la cons-
titution d’un SOPMK, sauf dans les
cas d’hyperinsulinisme extrême.
* Service de gynécologie endocrinienne et méde-
cine de la reproduction, hôpital Jeanne-de-
Flandre, CHU de Lille.
▲
▲Le syndrome des ovaires polymicrokystiques (SOPMK) est la cause la
plus fréquente d’anovulation, d’infécondité et d’hyperandrogénie chez
la femme (5 à 10 % des femmes en âge de procréer).
▲
▲L’élévation de l’hormone lutéinisante (LH) est de moins en moins consi-
dérée comme un phénomène primitif. Elle serait due à l’action des
androgènes en excès sur l’axe hypothalamohypophysaire.
▲
▲L’insulinorésistance associée à une hyperinsulinémie compensatoire ne
semble pas être différente dans le SOPMK de ce qu’elle est dans le syn-
drome métabolique “commun”. Elle ne serait pas suffisante pour la cons-
titution d’un SOPMK même si elle a une action amplificatrice sur la pro-
duction stéroïdienne des cellules thécales.
▲
▲Le phénomène primitif serait donc un excès de production thécale
d’androgènes. L’augmentation de production de déhydroépiandro-
stérone, de progestérone, de 17-alpha-hydroxyprogestérone et d’andro-
stènedione constitue, en effet, un trait phénotypique persistant des cel-
lules thécales en culture provenant d’OPMK.
▲
▲Bien que l’hyperandrogénie soit l’objet d’un phénomène d’agrégation
familiale avec un mode de transmission qui paraît autosomique domi-
nant, il est peu probable qu’elle soit due à l’anomalie d’un seul gène
codant pour une enzyme stéroïdogénique bien précise.
▲
▲Les inhibines, l’hormone antimullérienne (AMH) et le
Growth Differen-
tiation Factor-
9 (GDF-9) pourraient être également impliqués dans l’hyper-
androgénie intraovarienne.
▲
▲Le trouble de la folliculogenèse dans le SOPMK est double : excès de
croissance folliculaire précoce et défaut de sélection d’un follicule do-
minant
(“follicular arrest”)
.
▲
▲Les ovaires polymicrokystiques ont un nombre de follicules en crois-
sance (jusqu’au stade 2 à 5 mm) deux à trois fois supérieur à celui des
ovaires normaux. Les androgènes intraovariens sont désignés comme
les principaux responsables de ce phénomène par leur effet trophique.
▲
▲Le
“follicular arrest”
pourrait être expliqué par un excès d’inhibition locale
de la
follicle-stimulating hormone
(FSH) qui empêcherait la sélection d’un
follicule dominant. Parmi les inhibiteurs possibles, l’
Insulin-like Growth Fac-
tor Binding Protein-4
(IGFBP-4) et surtout l’AMH seraient de bons candidats.
▲
▲L’AMH est produite par les cellules de la granulosa des follicules jusqu’au
stade préantral. L’augmentation d’AMH retrouvé dans le SOPMK, due
à l’excès des follicules en croissance, serait impliquée dans le défaut
d’activité de l’aromatase induite par la FSH.
points FORTS

Métabolismes Hormones Diabètes et Nutrition (VIII), n° 4-5, juillet/octobre 2004
L’hyperandrogénie
L’augmentation de la production ova-
rienne d’androgènes est une carac-
téristique fondamentale du SOPMK
(3). Elle témoigne d’un fonctionne-
ment excessif des cellules thécales,
dont l’explication fait de moins en
moins intervenir des facteurs extra-
ovariens et de plus en plus des fac-
teurs intraovariens.
L’élévation de la LH sérique est une
anomalie classique mais inconstante
dans le SOPMK. Elle résulte à la fois
de l’accélération de la fréquence des
pulses de LH et de l’augmentation
de l’amplitude de ces pulses (4). Elle
est de moins en moins considérée
comme un phénomène primitif. Des
données récentes suggèrent qu’elle
résulte d’un défaut de feed-back néga-
tif concernant l’estradiol ou la pro-
gestérone. Ce défaut de feed-back
pourrait être dû à l’action des andro-
gènes en excès sur l’axe hypothalamo-
hypophysaire (5). L’hyperinsuliné-
mie peut également être considérée
comme un facteur non ovarien
d’hyperandrogénie, via, entre autres,
l’amplification des effets de la LH sur
la production stéroïdienne des cel-
lules thécales. Veldhuis et al. (6) ont
rapporté une stimulation par l’insu-
line de la production d’androgènes
par les cellules thécales. In vitro,
l’insuline stimulerait directement la
sécrétion d’androgènes ovariens via
ses effets sur la 17-alpha-hydroxylase,
la 17-20 lyase et les cytochromes
P450 (7). Enfin, l’insuline stimulerait
directement la sécrétion de LH par
des cellules hypophysaires en cul-
ture et sensibiliserait les gonadotro-
phines à la stimulation par le GnRH
(8). D’autre part, le système IGF,
étroitement lié à l’insuline, pourrait
également participer à la régulation
de la fonction ovarienne. L’hyper-
insulinisme contribuerait à l’hyper-
androgénie à travers l’inhibition de la
synthèse hépatique d’IGFBP-1 ova-
rienne, ce qui conduirait à l’augmen-
tation des formes libres d’IGF. Les
IGF libres et donc actifs pourraient
contribuer à stimuler la stéroïdo-
genèse (9). Ces nombreuses démons-
trations expérimentales semblent
confirmées par l’observation plus
récente de la diminution des taux
plasmatiques d’androgènes chez les
patientes dont les concentrations
d’insuline sont abaissées par un agent
insulinosensibilisant ou par la perte
de poids (7).
En culture prolongée, Nelson et al.
(10) ont montré que l’augmentation
de production de déhydroépiandro-
stérone, de progestérone, de 17-alpha-
hydroxyprogestérone et d’androstène-
dione constitue un trait phénotypique
persistant des cellules thécales pro-
venant d’ovaires polymicrokystiques
(OPMK). Le caractère prolongé
de ces cultures, avec de nombreux
passages, élimine la responsabilité
d’influences in vivo, telles que l’aug-
mentation des taux de LH et/ou
d’insuline. Les expériences de trans-
fection indiquent que le promoteur
de CYP17 est plus actif dans les
cellules thécales d’OPMK que dans
les cellules normales, tandis que le
promoteur StAR n’est pas régulé de
façon différente (11, 12). Ces expé-
riences suggèrent que la transcription
de gènes codant pour des enzymes
stéroïdogéniques spécifiques est natu-
rellement “up-régulée” dans les cel-
lules thécales d’OPMK, mais toutes
les étapes enzymatiques ne sont pas
concernées. Cela mène à une pro-
duction accrue de produits de type
progestatif et androgénique. Dès
lors, bien que l’hyperandrogénie du
SOPMK soit l’objet d’un phénomène
d’agrégation familiale, avec un mode
de transmission qui paraît auto-
somique dominant (13), il est peu
probable qu’elle soit due à l’anoma-
lie d’un seul gène codant pour une
enzyme stéroïdogénique bien précise,
comme cela avait été suggéré par cer-
tains auteurs (14). Des études com-
plémentaires utilisant les nouvelles
techniques moléculaires (“micro-
array analysis”, analyse sériée de
l’expression des gènes, “suppression
subtractive hybridization”) et l’ana-
lyse génétique des familles SOPMK
(“affected sib pair analysis” et “trans-
mission/disequilibrium tests”) sont
actuellement en cours en vue d’iden-
tifier les gènes “OPMK” conduisant
à l’hyperandrogénie (15).
Les inhibines pourraient également
être impliquées dans l’hyperandro-
génie intraovarienne des OPMK (16),
via leur rôle paracrine par lequel
les cellules de la granulosa (CG)
modulent la synthèse des androgènes
par les cellules de la thèque interne
(CTI) (17). L’AMH, autre membre de
la famille du TGF-βproduit par les
CG, pourrait aussi intervenir dans la
dysrégulation thécale du SOPMK.
En effet, nous avons retrouvé une
relation positive et significative entre
les taux d’AMH et les taux de testo-
stérone et d’androstènedione plasma-
tiques dans le sérum de nos patientes
avec SOPMK (18). Enfin, on pourrait
supposer qu’un taux bas de GDF-9,
constaté dans les ovocytes d’OPMK
(19), soit l’un des facteurs d’augmen-
tation de la synthèse des androgènes
par les CTI. Toutefois, nos connais-
sances sur les relations CTI-CG-
ovocyte sont encore beaucoup trop
rudimentaires pour pouvoir attribuer
dès à présent aux inhibines, à l’AMH
et/ou au GDF-9, un rôle déterminant
dans la physiopathologie de l’hyper-
androgénie du SOPMK.
Le trouble
de la folliculogenèse
L’observation faite par Hughesdon
(20) d’un nombre deux à trois fois
plus important de follicules en crois-
sance jusqu’au stade 2 à 5 mm dans
les OPMK, par rapport aux ovaires
normaux, est une donnée certes déjà
ancienne, mais essentielle. Elle vient
d’ailleurs d’être confirmée tout récem-
ment sur des biopsies corticales (21).
Cette anomalie s’associe à un deu-
xième phénomène qui est l’arrêt de
croissance de ces follicules lorsqu’ils
atteignent le stade 4 à 7 mm. Cela
suggère qu’il existe dans le SOPMK
essentiellement deux anomalies tou-
chant la folliculogenèse (22) : une
croissance folliculaire excessive,
d’une part et, d’autre part, une inhi-
154
Dossier
Ovaires polykystiques

Métabolismes Hormones Diabètes et Nutrition (VIII), n° 4-5, juillet/octobre 2004
Ovaires polykystiques
Dossier
bition de l’évolution des follicules de
la cohorte excessive vers un follicule
sélectionné et un follicule dominant.
Cette deuxième anomalie est dénom-
mée “follicular arrest” par les auteurs
anglo-saxons. On ne sait toujours pas
si l’anomalie primitive siège dans les
cellules thécales et/ou les cellules
de la granulosa et/ou l’ovocyte.
L’excès de croissance
folliculaire précoce
Les ovaires polymicrokystiques sont
constitués d’un pool anormalement
riche en follicules de la classe 1 à la
classe 5, avec un nombre deux à trois
fois supérieur à celui des ovaires
normaux (21). Cette multifollicula-
rité généralisée se présente comme
la caractéristique spécifique des
OPMK, qui les distingue des autres
causes d’ovaires multifolliculaires
(OMF), que l’on observe dans l’anovu-
lation hypothalamique, l’hyperpro-
lactinémie, en fin de puberté ou lors
d’une puberté précoce centrale.
Connaissant leur importance au niveau
des petits follicules, les androgènes
intraovariens sont désignés comme
les principaux responsables de ce
phénomène d’excès folliculaire. Les
études expérimentales menées chez
les singes femelles rhésus recevant
de fortes doses de testostérone ou de
dihydrotestostérone, suggèrent que les
androgènes favorisent la croissance
des petits follicules dans l’ovaire de
primate (23). Cela est à rapprocher
de certaines observations cliniques.
L’hyperplasie congénitale des surré-
nales, les tumeurs virilisantes et
l’administration d’androgènes exo-
gènes (chez les transsexuels femme-
homme) sont associées à un nombre
plus important de follicules antraux,
du même ordre que ceux que l’on
observe dans les OPMK (24, 25).
Beaucoup de ces follicules “kys-
tiques” ont en fait une stéroïdoge-
nèse normale et des caractéristiques
de croissance normales (26, 27).
Enfin, les données échographiques
chez nos patientes avec SOPMK (28),
indiquant une corrélation positive
entre le nombre de follicules de 2 à
5 mm de diamètre et le taux sérique
de testostérone et d’androstènedione,
renforcent l’hypothèse que l’augmen-
tation du nombre des petits follicules
est due à l’effet trophique des andro-
gènes, qu’il soit accru localement
dans l’ovaire – comme c’est le cas
pour les OPMK –, ou qu’il soit d’ori-
gine extraovarienne, dans les autres
situations.
Ces études suggérant que les andro-
gènes ne sont en fait pas atrétogènes
dans l’ovaire de primate contrastent
avec les études antérieures chez la
rate, qui avaient largement contribué
au concept de l’atrétogénicité des
androgènes (29, 30), pivot de la phy-
siopathologie du SOPMK pendant
de nombreuses années...
Le “follicular arrest”
La deuxième anomalie de la follicu-
logenèse dans le SOPMK est le
défaut de sélection d’un follicule
dominant. L’inhibition de la pro-
gression de la classe 5 vers le folli-
cule dominant conduit à la stagna-
tion et à l’accumulation des follicules
sélectionnables, leur donnant leur
aspect caractéristique d’ovaires multi-
folliculaires à l’échographie (29).
Ce phénomène dénommé “follicu-
lar arrest” résulte vraisemblable-
ment du défaut d’action de la FSH
sur la cohorte folliculaire et/ou d’une
action prématurée de la LH.
• Défaut d’action de la FSH
La sécrétion de FSH est-elle insuf-
fisante dans le SOPMK ?
Les patientes en anovulation normo-
gonadotrope – situation que l’on peut
assimiler au SOPMK – ont des taux
normaux de FSH bioactive et
immunoréactive, du même niveau
que les femmes normales en début
de phase folliculaire (31, 32). Contre
l’hypothèse d’un excès de feed-back
négatif, ni les taux d’inhibine B ni
ceux d’estradiol ne sont franchement
exagérés dans le SOPMK, et nous
avons montré l’absence de corréla-
tion négative entre FSH et inhibine B
plasmatiques (17). Toutefois, l’absence
d’ovulation, et donc de corps jaune
et de lutéolyse, tendrait à perpétuer
l’absence d’élévation intercyclique
de la FSH, fondamentale pour la
sélection du follicule dominant. Il
s’agirait donc là d’un phénomène
secondaire.
Y a-t-il dans les OPMK un excès
d’inhibition locale de la FSH ?
L’hypothèse de l’excès local d’inhi-
biteur(s) de l’action de la FSH repose
sur divers arguments expérimentaux
et cliniques.
●
●Il est connu de longue date que
les doses de FSH nécessaires pour
induire l’ovulation sont en moyenne
plus élevées chez les patientes avec
SOPMK (33).
●
●In vitro, les CG provenant de fol-
licules antraux d’OPMK produisent
des quantités normales d’estradiol,
voire parfois très augmentées en
réponse à la FSH (34), ce qui indique
clairement que l’anomalie fonc-
tionnelle n’est pas due à un défaut
d’action intrinsèque de la FSH, mais
que c’est plutôt l’environnement in
vivo des CG qui exerce un effet
inhibiteur.
●
●Ces données in vitro ont été récem-
ment confortées in vivo par exposition
à des doses graduellement croissantes
de FSH recombinante, indiquant que
les patientes avec SOPMK ont un
seuil de réponse, en termes de pro-
duction d’estradiol (E2), plus élevé
que les femmes normales (35).
Parmi les inhibiteurs possibles,
l’IGFBP-4 (neutralisant l’action des
IGF) pourrait être un bon candidat car
il vient d’être montré que son expres-
sion dépend de celle du récepteur de
la LH (36), dont certains pensent
qu’elle est prématurée dans les CG
des follicules d’OPMK (voir infra).
Toutefois, pour l’instant, il n’y a pas
d’argument convaincant pour retenir
l’hypothèse d’un rôle central du
système IGF dans le “follicular
arrest” du SOPMK (37). De même,
l’hypothèse de la présence exces-
sive dans le plasma ou le liquide
folliculaire d’inhibiteur(s) naturel(s)
de la liaison de la FSH à son récep-
155

Métabolismes Hormones Diabètes et Nutrition (VIII), n° 4-5, juillet/octobre 2004
teur et/ou des effets postrécepteurs
n’est toujours pas confirmée.
D’après nos récentes données écho-
graphiques, indiquant une corré-
lation négative entre les petits (2 à
5 mm) et les plus gros (6 à 9 mm)
follicules antraux (38), il est tentant
d’évoquer un effet auto-inhibiteur
de la cohorte elle-même. Cet effet
s’exercerait via la sécrétion de fac-
teurs agissant localement. L’AMH
pourrait être l’un d’eux car l’élévation
importante de son taux plasmatique
chez nos patientes avec SOPMK (voir
supra) est en étroite relation avec
l’excès du nombre des follicules de
2 à 5 mm détectés par échographie
(19). En contrepartie, les taux plas-
matiques d’AMH chez ces mêmes
patientes sont inversement corrélés à
ceux de la FSH, de façon comparable
à nos femmes témoins. Notre hypo-
thèse est donc que cet excès d’AMH
serait impliqué dans le défaut d’acti-
vité de l’aromatase induite par la FSH,
caractérisant le “follicular arrest”
du SOPMK (39). Cela s’expliquerait
par un excès de concentration d’AMH
au sein de la cohorte plutôt qu’au sein
même des follicules car le rapport
AMH-nombre de follicules n’était
pas augmenté dans notre expérience
(19), suggérant que chaque follicule
produit en fait une quantité normale
d’AMH. L’excès d’AMH au sein de
la cohorte serait donc directement
lié au trop grand nombre de follicules
constituant celle-ci. Dès lors, ces
données font de l’AMH un candidat
valable pour expliquer l’effet auto-
inhibiteur de la cohorte, en particu-
lier sur l’aromatase, et pour rendre
compte de l’altération du processus
de sélection. La FSH, bien qu’en
concentration plasmatique normale,
ne serait pas en mesure d’induire une
diminution suffisante de l’AMH pour
permettre à l’aromatase de s’expri-
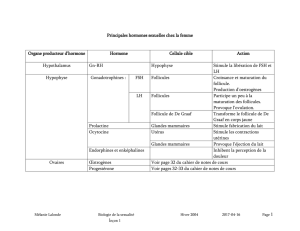
mer (figure).
Au total, l’absence d’élévation inter-
cyclique de la FSH et/ou la présence
d’inhibiteurs de la FSH au sein de la
cohorte, telles que l’AMH, condui-
sent à une insuffisance des effets de
la FSH, qui est l’un des principaux
déterminants du “follicular arrest”.
• Action prématurée de la LH
Il s’agit d’une alternative à l’hypo-
thèse précédente. Physiologiquement,
les CG n’acquièrent leurs récepteurs
LH qu’en milieu et en fin de phase
folliculaire (40). Cela permet à la LH
de prendre le contrôle de la crois-
sance folliculaire terminale, avec pour
principal effet la stimulation des sécré-
tions stéroïdiennes, tandis qu’elle
inhibe la multiplication des CG. Cer-
taines études font évoquer l’acquisi-
tion prématurée du récepteur LH chez
les patientes anovulantes (41, 42).
Ces auteurs émettent l’hypothèse
d’un état de différenciation préma-
turée des CG, responsable d’un arrêt
de leur multiplication et de la stag-
nation de la croissance folliculaire,
aboutissant à l’anovulation. Expéri-
mentalement, il avait en effet été
démontré que l’exposition prématu-
rée des CG à la LH inhibait leur
prolifération, au point d’interrompre
le développement du follicule domi-
nant (43). L’insuline et/ou les andro-
gènes pourraient expliquer cet état
de différenciation prématurée (44).
Le syndrome métabolique :
l’insulinorésistance (IR)
est-elle spécifique
au SOPMK ou s’agit-il
de l’IR “commune” ?
Un grand nombre de patientes avec
SOPMK sont insulinorésistantes et
présentent alors une hyperinsuliné-
mie compensatoire (7). En dehors
de certaines situations extrêmes ou
particulières (voir infra), l’étiologie de
l’insulinorésistance dans le SOPMK
n’est pas élucidée. Plusieurs méca-
nismes moléculaires ont été suggérés
pour expliquer l’origine de cette insu-
linorésistance : diminution des trans-
Dossier
Ovaires polykystiques
156
Figure. Interactions entre les androgènes intraovariens, l’abondance de la cohorte, la pro-
duction d’AMH et l’effet de la FSH sur l’aromatase et la sélection du follicule dominant,
dans l’ovaire normal (à gauche) et dans l’OPMK (à droite). Dans l’OPMK, la balance entre
FSH et AMH pencherait en faveur de cette dernière, ce qui expliquerait le défaut d’activité
aromatase in vivo et le “follicular arrest”. L’excès d’AMH serait la conséquence de l’excès
du nombre des follicules antraux constituant la cohorte, lui-même secondaire à l’hyper-
androgénie intraovarienne. Le feed-back négatif exercé par l’inhibine B ne serait pas en
cause. Le bon équilibre de la balance FSH-AMH peut être rétabli en augmentant pru-
demment l’apport de FSH à l’OPMK, car l’effet physiologique suppresseur de celle-ci sur
l’AMH est conservé chez les patientes avec SOPMK (d’après Jonard et Dewailly [22]).
Ovaire normal
FSH FSH
+
-
Inhibine B
Inhibine B
AMH
AMH
Aromatase Aromatase
Androgènes Androgènes
Ovaire polykystique

Métabolismes Hormones Diabètes et Nutrition (VIII), n° 4-5, juillet/octobre 2004
Ovaires polykystiques
Dossier
porteurs du glucose GLUT4, anoma-
lies dans la modulation de l’adéno-
sine de l’action de l’insuline (45),ou
phosphorylation excessive du récep-
teur de l’insuline sur ses résidus sérine.
Dunaif et al. (46) ont rapporté en effet
que beaucoup de patientes obèses
avec SOPMK auraient un défaut de
l’autophosphorylation des tyrosines
sur le récepteur de l’insuline. Le
mécanisme primaire serait l’aug-
mentation de l’autophosphorylation
basale du récepteur de l’insuline,
liée à l’augmentation de la sérine-
phosphorylation de sa sous-unité β.
En la déphosphorylant de façon
continue, elle amoindrit l’activité
tyrosine-kinase du récepteur stimulée
par sa liaison à l’insuline et diminue
ainsi les effets immédiatement post-
récepteurs (7). L’augmentation de la
sérine-phosphorylation aurait en outre
un effet amplificateur sur l’activité
17,20 desmolase du cytochrome P450
c 17α. Toutefois, la démonstration in
vitro d’une telle anomalie mixte n’a
pu être apportée (47). Cette théorie
pourtant uniciste liant l’hyperandro-
génie et l’IR semble donc devoir
être abandonnée.
Toutes les tentatives pour démontrer
une IR spécifique se sont soldées par
des résultats mitigés, voire négatifs,
et les données de la génétique vont
en ce sens. Il est vrai que la compré-
hension de cette composante est dif-
ficile car elle s’intrique avec l’obésité
et sa propre IR, ainsi qu’avec la sus-
ceptibilité vis-à-vis du diabète de
type 2.
Donc, à ce jour, rien n’indique que la
physiopathologie du syndrome méta-
bolique associé à la majorité des cas
de SOPMK soit différente de celle
du syndrome “commun”. La seule
différence réside dans le fait que, du
fait du rôle révélateur précoce des
symptômes du SOPMK, ce syndrome
est observé à un âge beaucoup plus
jeune qu’à l’âge habituel où appa-
raissent ses complications (HTA,
insuffisance coronaire, diabète de
type 2, etc.). On peut donc considé-
rer que le SOPMK offre l’occasion
unique d’analyser les tout premiers
mécanismes de ce syndrome, avant
qu’ils ne s’effacent ou ne se modi-
fient avec le temps. Dans des cas plus
rares, l’IR relève de mécanismes bien
précis et spécifiques de certaines cir-
constances (mais pas du SOPMK !) :
retard de croissance intra-utérin, ano-
malies du gène du récepteur de
l’insuline, médications, etc. Enfin,
certains ont récemment émis l’hypo-
thèse d’une “reprogrammation in
utero”, selon laquelle l’hyperandro-
génie liée à l’ovaire fœtal, programmé
génétiquement pour être hyperandro-
génique, influencerait le développe-
ment et la fonction ultérieure du tissu
adipeux et de l’hypothalamus, avec
pour conséquences, à la puberté, une
IR pathologique et une sécrétion
excessive de LH (48).
Conclusion
La physiopathologie du SOPMK ne
peut être résumée en quelques pages,
tant elle s’étend sur de nombreux
domaines de la gynécologie, de l’endo-
crinologie, de la diabétologie et de
la nutrition. L’anomalie “fondamen-
tale” reste pour l’instant méconnue,
mais existe-t-elle vraiment ? Les
OPMK ne seraient-ils pas tout bana-
lement une réaction ovarienne non
spécifique à diverses stimulations
dont le dénominateur commun serait
la création d’une hyperandrogénie
intraovarienne ? En ce cas, la
recherche frénétique du gène du
SOPMK, à laquelle on assiste actuel-
lement, risque d’en frustrer plus d’un...
Références
1.
Franks S. Polycystic ovary syndrome. N Engl J
Med 1995;333:853-61.
2.
Jacobs HS. Polycystic ovaries and polycystic
ovary syndrome. Gynecol Endocrinol 1987;1:113-31.
3.
Strauss JF, Dunaif A. Molecular mysteries of
polycystic ovary syndrome. Mol Endocrinol 1999;
13:800-5.
4.
Taylor AE, McCourt B, Martin KA et al. Deter-
minants of abnormal gonadotropin secretion in
clinically defined women with polycystic ovary syn-
drome. J Clin Endocrinol Metab 1997;82:2248-56.
5.
Eagleson CA, Gingrich MB, Pastor CL et al.
Polycystic ovary syndrome: evidence that fluta-
mide restores sensitivity of the gonadotropin-
releasing hormone pulse generator to inhibition
by estradiol and progesterone. J Clin Endocrinol
Metab 2000;85:4047-52.
6.
Veldhuis JD, Furlanetto RW. Trophic actions of
human somatomedin C/insulin-like growth factor I
on ovarian cells: in vitro studies with swine gra-
nulosa cells. Endocrinology 1985;116:1235-42.
7.
Nestler JE, Jakubowicz DJ. Decrease in ovarian
cytochrome P450c 17-alpha activity and serum
free testosterone after reduction in insulin secre-
tion in women with polycystic ovarian syndrome.
N Engl J Med 1996;335:617-23.
8.
Antilla L, Ding YQ, Ruutainen K et al. Clinical
features and circulating gonadotropin, insulin and
androgen interactions in women with polycystic
ovarian disease. Fertil Steril 1991;55:1057-61.
9.
Poresky L, Cataldo N, Rosenwaks Z et al. The
insulin-related ovarian regulatory system in health
and disease. Endoc Rev 1999;20:535-82.
10.
Nelson VL, Legro RS, Strauss JF III, McAllis-
ter JM. Augmented androgen production is a
stable steroidogenic phenotype of propagated theca
cells from polycystic ovaries. Mol Endocrinol
1999;13:946-57.
11.
Nelson VL, Qin KN, Rosenfield RL et al. The
biochemical basis for increased testosterone pro-
duction in theca cells propagated from patients
with polycystic ovary syndrome. J Clin Endocri-
nol Metab 2001;86:5925-33.
12.
Wickenheisser JK, Quinn PG, Nelson VL et al.
Differential activity of the cytochrome P450 17α-
hydroxylase and steroidogenic acute regulatory
protein gene promoters in normal and polycystic
ovary syndrome theca cells. J Clin Endocrinol
Metab 2000;85:2304-11.
13.
Legro RS, Spielman R, Urbanek M et al. Phe-
notype and genotype in polycystic ovary syndrome.
Rec Prog Horm Res 1998;53:217-56.
14.
Gharani N, Waterworth D, Batty S et al. Asso-
ciation of the steroid synthesis gene CYP11a with
polycystic ovary syndrome and hyperandroge-
nism. Hum Mol Genet 1997;3:397-402.
15.
Strauss JF III, Wood JR, Christenson LK,
McAllister JM. Strategies to elucidate the mecha-
nism of excessive theca cell androgen production in
PCOS. Mol Cellular Endocrinol 2002;186:183-8.
16.
Pigny P, Cortet-Rudelli C, Decanter C et al.
Serum levels of inhibins are differentially altered
in patients with PCOS: effects of being overweight
and relevance to hyperandrogenism. Fertil Steril
2000;73:972-7.
17.
Udoff LC, Adashi EY. Intraovarian regulation
of ovarian androgen secretion in PCOS. In Azziz R,
Nestler JE, Dewailly D (eds). Androgen excess
disorders in women. Philadelphia, USA : Lippin-
cott-Raven, 1997;295-301.
18.
Pigny P, Merlen E, Robert Y et al. Elevated
serum level of anti-mullerian hormone (AMH) in
polycystic ovary syndrome: relationship to the
ovarian follicle excess and to the follicular arrest.
J Clin Endocrinol Metab 2003;88:5957-62.
19.
Teixeira Filho FL, Baracat EC, Lee TH et al.
Aberrant expression of growth differentiation fac-
tor-9 in oocytes of women with polycystic ovary
syndrome. J Clin Endocrinol Metab 2002;87:
1337-44.
20.
Hughesdon PE. Morphology and morphoge-
nesis of the Stein-Leventhal ovary and of so-cal-
led “hyperthecosis”. Obstet Gynecol Surv 1982;
37:59-77.
157
 6
6
1
/
6
100%