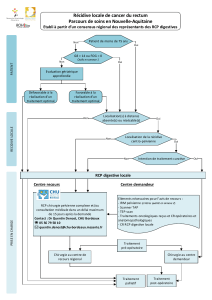
Cancer anal : épidémiologie, classification anatomopathologique, “staging”

L
e cancer anal est une pathologie rare mais qui doit être
facilement évoquée devant tout symptôme proctolo-
gique en raison des possibilités thérapeutiques
actuelles dont l’efficacité est bien établie. En 20 ans, sa prise en
charge thérapeutique s’est profondément modifiée aux dépens de
la chirurgie et au profit d’un traitement conservateur, la radio-
chimiothérapie.
Dans le cadre des cancers anaux, il faut distinguer le cancer du
canal anal, sujet principal de l’article, du cancer de la marge anale,
dont les données épidémiologiques et le traitement sont diffé-
rents. Le cancer du canal anal et de la marge anale représentent
respectivement 85 % et 15 % des cancers de l’anus.
Malgré l’accessibilité de la région anale à l’examen clinique, le
retard diagnostique est fréquent et s’explique par l’absence de
spécificité des symptômes souvent attribués à la fois par le méde-
cin et le patient, à une pathologie hémorroïdaire. Dans plus de la
moitié des cas, le diagnostic est posé deux ans après l’apparition
des premiers symptômes.
ÉPIDÉMIOLOGIE ET FACTEURS DE RISQUE
Le cancer anal représente 1,5 % des cancers digestifs et son inci-
dence augmente régulièrement depuis 30 ans. Aux États-Unis,
son incidence est évaluée à 0,6 cas pour 100 000 habitants et on
estime le nombre de nouveaux cas à 3 400 pour l’année 2000. Il
se manifeste habituellement après 60 ans et il existe une prédo-
minance féminine modérée avec un sex-ratio de 1/1,4 (1).
En 20 ans, les connaissances concernant les facteurs de risque
ont bien évolué. Le cancer anal était considéré initialement
comme la conséquence à long terme d’une pathologie procto-
logique bénigne telle que hémorroïdes, fissure ou fistule. Il est
maintenant bien établi que ce sont certains comportements et pra-
tiques sexuels et l’infection à papilloma virus humain (PVH,
types 16 et 18) qui constituent les deux principaux facteurs pré-
disposants (2). La recherche d’ADN du PVH est positive dans
près de 90 % des cas de cancers anaux (3). La pathogénie du can-
cer anal lié à PVH présente des similitudes à celle du cancer du
col utérin et repose sur le développement d’une séquence de
lésions histologiques : infection à PVH, dysplasie, néoplasie intra-
épithéliale, carcinome invasif. Les sujets atteints d’un cancer anal
associé à une infection à PVH sont en général plus jeunes de
10 ans au moment du diagnostic par rapport à des patients pré-
sentant un cancer anal non lié à une infection à PVH (4). La pré-
sence ou l’absence d’une infection à PVH n’apparaît pas influer
sur le pronostic. Souvent associés à une infection à PVH, cer-
tains comportements sexuels (homosexualité masculine, rapports
sexuels anaux, plus de 10 partenaires sexuels) et des antécédents
de maladies sexuellement transmissibles sont des facteurs de
risque bien établis. Le risque est également augmenté en cas
d’antécédents de cancers gynécologiques (vulve, vagin et col uté-
rin) liés épidémiologiquement et fréquemment à une infection à
PVH. Parmi les maladies sexuellement transmissibles, l’infec-
tion à VIH n’est pas formellement impliquée dans la genèse du
cancer anal. En revanche, selon les données scientifiques actuelles
et par comparaison à des sujets VIH négatifs, les sujets VIH posi-
tifs ont plus souvent une infection à PVH associée dont le risque
de persistance est inversement lié aux taux de lymphocytes CD4.
Même si le risque de néoplasie intraépithéliale de l’anus est plus
Cancer anal : épidémiologie, classification
anatomopathologique, “staging”
●H. Hudziak*
241
La Lettre de l’hépato-gastroentérologue - no5 - vol. III - octobre 2000
* Service d’hépato-gastroentérologie, CHU Nancy-Brabois.
POINTS FORTS
POINTS FORTS
■ Le cancer anal est rare mais son incidence augmente régu-
lièrement depuis 30 ans.
■ Il s’agit dans la majorité des cas d’un carcinome épider-
moïde dont l’extension est principalement locorégionale.
■ L’infection à papilloma virus humain (HPV), les rapports
sexuels anaux, un nombre supérieur à 10 partenaires sexuels,
des antécédents de maladies sexuellement transmissibles
et/ou de cancer gynécologique (vulve, vagin et col utérin),
l’immunodépression après transplantation d’organes et le
tabagisme constituent les principaux facteurs de risque.
■ Le retard diagnostic est fréquent et s’explique par
l’absence de spécificité des symptômes.
■ L’examen clinique doit rechercher des adénopathies ingui-
nales.
■ L’échographie anorectale permet d’évaluer l’infiltration
en profondeur et la recherche d’adénopathies périrectales.
■ Le pronostic est lié à la taille de la tumeur.

242
La Lettre de l’Hépato-gastroentérologue - no5 - vol. III - octobre 2000
DOSSIER THÉMATIQUE
élevé chez les patients VIH positifs avec un taux faible de lym-
phocytes CD4 ou à un stade avancé dans leur maladie, la res-
ponsabilité directe du VIH dans le développement du cancer anal
reste à démontrer (5).
L’immunodépression iatrogène des patients transplantés et, à un
moindre degré, l’intoxication tabagique favorisent également le
développement du cancer de l’anus. Le risque lié au tabagisme
est dose-dépendant et est limité à la femme en période de pré-
ménopause : l’hypothèse d’un effet anti-œstrogénique du tabac
est évoqué (6).
ANATOMIE PATHOLOGIQUE
ET CLASSIFICATION DES TUMEURS DE L’ANUS
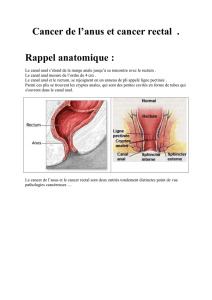
La définition anatomique du canal anal est actuellement devenue
précise et consensuelle. En effet, si la limite supérieure a toujours
été définie par la jonction anorectale, il n’en était pas de même pour
la limite inférieure localisée selon les auteurs soit au niveau de la
ligne pectinée, soit au niveau de la jonction anocutanée. Selon la
définition actuelle, le canal anal s’étend sur une longueur de 3 à
4 cm de la jonction anorectale à la marge anale, la jonction anorec-
tale étant identifiée cliniquement par un anneau musculaire composé
du bord supérieur de l’appareil sphinctérien, du muscle puborectal
et du muscle releveur de l’anus. La marge anale est définie par le
revêtement cutané périanal étendu jusqu’à 5 cm de la jonction ano-
cutanée (7). Quatre-vingt-cinq pour cent des tumeurs se développent
au niveau du canal anal et 15 % au niveau de la marge anale.
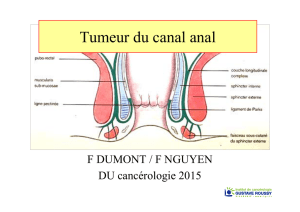
Le canal anal est revêtu par trois types d’épithélium pouvant don-
ner naissance à des tumeurs de nature différente : de haut en bas,
on décrit un épithélium de type rectal, un épithélium transition-
nel similaire à celui des voies urinaires et un épithélium malpi-
ghien non kératinisé séparé du précédent par la ligne pectinée
(schéma ). Au niveau de la marge anale, l’épithélium est de type
malpighien kératinisé.
La plupart des tumeurs malignes de l’anus sont des carcinomes
d’origine épithéliale (figures 1 et 2). Sur une série de 192 can-
cers du canal anal recensés sur une période de 10 ans, 74 % étaient
des carcinomes épidermoïdes, 19 % des adénocarcinomes, 4 %
des mélanomes et 3 % des tumeurs exceptionnelles (lymphome,
sarcome de Kaposi, léiomyosarcome, tumeur carcinoïde) (8).
Selon la classification de l’OMS, les tumeurs du canal anal se
divisent en quatre types histologiques : le carcinome épidermoïde,
l’adénocarcinome, le carcinome à petites cellules et le carcinome
indifférencié (tableau I). Pour les carcinomes épidermoïdes, le
point de départ de la prolifération néoplasique conditionne une
dénomination anatomopathologique différente. Ainsi, les tumeurs
développées aux dépens de la zone transitionnelle, au-dessus de
la ligne pectinée sont de deux types histologiques, les carcinomes
Schéma. Classification et localisation des tumeurs épithéliales de l’anus.
Figures 1 et 2. Carcinome épidermoïde.
Carcinome épidermoïde
kératinisant
(figures 1 et 2)
Carcinome cloacogénique
ou
épidermoïde non kératinisant
Tumeurs de la marge anale :
– carcinome épidermoïde
– carcinome baso-cellulaire
– condylome géant
– maladie de Paget
(figure 4)
– maladie de Bowen
(figure 5)
Adénocarcinome
type rectal
Carcinome
colloïde
Épithélium
glandulaire
Épithélium
transitionnel
Épithélium
malpighien
non kératinisé
Épithélium
malpighien
kératinisé
Ligne pectinée

transitionnels et les carcinomes basaloïdes qui sont souvent dési-
gnés sous le terme de carcinomes cloacogéniques. Cette nomen-
clature anatomopathologique basée sur des aspects histologiques
différents est ancienne et à l’origine d’une certaine confusion par
sa complexité et est aujourd’hui abandonnée. Les tumeurs épi-
théliales développées aux dépens de la zone transitionnelle et
sous la ligne pectinée sont actuellement appelées respectivement
carcinomes épidermoïdes non kératinisants et carcinomes épi-
dermoïdes kératinisants. Le pronostic et la prise en charge thé-
rapeutique de ces deux types histologiques sont identiques (9).
Les adénocarcinomes du canal anal sont rares et se divisent en
trois types. Le type rectal développé à la partie supérieure du
canal anal est impossible à différencier d’un adénocarcinome du
bas rectum. L’adénocarcinome des glandes anales de Hermann
et Desfosses, qui s’abouchent dans le canal anal au niveau de la
ligne pectinée, est rare. Appelé également cancer colloïde, il se
présente habituellement sous la forme d’une fistule récidivante
associée à une infiltration profonde et à la présence d’une sécré-
tion “en grains de tapioca”. Quant à l’adénocarcinome développé
aux dépens d’une fistule anorectale, il est exceptionnel.
Parmi les tumeurs non épithéliales, seul le mélanome malin dans
sa forme pigmentée ou achromique n’est pas exceptionnel et son
pronostic est sombre (figure 3).
BILAN PRÉTHÉRAPEUTIQUE
L’évolution naturelle du cancer anal se caractérise par une exten-
sion tumorale principalement locorégionale. L’extension tumo-
rale peut se faire par contiguïté vers les organes du pelvis, par
voie lymphatique vers les adénopathies régionales et, par voie
hématogène avec apparition de métastases viscérales à distance.
Extension locale
Au moment du diagnostic, 20 % des cancers de l’anus sont limi-
tés à la muqueuse et à la sous-muqueuse et 50 à 55 % envahis-
sent l’appareil sphinctérien ou les organes de voisinage. Chez la
femme, l’extension à la paroi rectovaginale est fréquente. En
revanche, chez l’homme, l’aponévrose de Denonvilliers limite le
risque d’extension à la prostate (2).
L’échographie endo-anale permet une évaluation précise de
243
La Lettre de l’hépato-gastroentérologue - no5 - vol. III - octobre 2000
Figure 4. Maladie de Paget.
CANAL ANAL
●Carcinome épidermoïde :
- à grandes cellules kératinisantes
- à grandes cellules non kératinisantes (transitionnel)
- basaloïde
●Adénocarcinome :
- type rectal
- des glandes anales (carcinome colloïde)
- sur fistule anorectale
●Carcinome à petites cellules
●Carcinome indifférencié
MARGE ANALE
●Carcinome épidermoïde
●Condylome géant et carcinome verruqueux
●Carcinome baso-cellulaire
●Maladie de Bowen
●Maladie de Paget
Tableau I. Classification selon l’OMS des tumeurs épithéliales de
l’anus.
Figure 3. Mélanome.

244
La Lettre de l’hépato-gastroentérologue - no5 - vol. III - octobre 2000
DOSSIER THÉMATIQUE
l’extension tumorale souvent sous-estimée par le seul examen cli-
nique. Supérieure à la tomodensitométrie, elle permet de préciser
la localisation de la tumeur, son infiltration en profondeur au sein
de l’appareil sphinctérien et son étendue par rapport à la circonfé-
rence de l’anus (figures 6 et 7) (10, 11, 12, 13). Les tumeurs sont
ainsi classées en quatre stades échographiques (tableau II). Selon
les études, le type de sonde employée diffère et il semble préfé-
rable d’utiliser une sonde rotative rigide (Brüel et Kjaer, fréquence
de 7 MHz). En effet, les échoendoscopes souples entraînent une
distorsion du canal anal par le ballonnet rempli d’eau situé à leur
extrémité. En dehors du coût et de l’accessibilité de l’IRM, l’inté-
rêt de cette technique d’imagerie reste à établir dans le cancer anal.
Extension régionale et ganglionnaire
Au moment du diagnostic, la fréquence des métastases ganglion-
naires pelviennes varie de 10 à 35 %, mais elle est difficile à éva-
luer avec certitude en raison de l’absence de confrontations radio-
anatomopathologiques, le traitement du cancer anal étant rarement
chirurgical (2). Le risque d’extension ganglionnaire est lié direc-
tement à la taille et à l’infiltration tumorale. Il est ainsi très faible
pour les tumeurs inférieures à 2 cm (7). Le territoire de drainage
lymphatique dépend de la localisation de la lésion au niveau du
canal anal. Pour les lésions situées au-dessus de la ligne pectinée,
le drainage lymphatique se fait vers les ganglions périrectaux,
hypogastriques et obturateurs le long de l’axe vasculaire hémor-
roïdal moyen et inférieur (9). Pour les lésions situées au-dessous
de la ligne pectinée, il se fait vers les ganglions inguinaux. Le
risque d’une extension aux ganglions inguinaux est de 10 % pour
les tumeurs de moins de 4 cm, augmente à 20 % lorsque la lésion
mesure plus de 4 cm et atteint 60 % lorsqu’il existe une extension
Figure 6. Cancer anal UT3 (infiltration du sphincter externe).
Figure 7. Cancer anal UT4 (extension au-delà du sphincter externe).
UT1 Tumeur limitée à la muqueuse et à la sous-muqueuse
UT2 Tumeur limitée au sphincter interne ou à la musculeuse
rectale
UT3 Tumeur infiltrant le sphincter externe ou dépassant
la musculeuse rectale
UT4 Tumeur étendue aux organes de voisinage
Tableau II. Classification échographique des tumeurs du canal anal
en fonction de l’extension en profondeur.
Figure 5. Maladie de Bowen.

extrasphinctérienne. L’échoendoscopie souple constitue l’examen
de choix pour la recherche d’adénopathies métastatiques périrec-
tales et sera complétée par un examen tomodensitométrique.
Extension à distance
La fréquence des métastases synchrones est de 10 % (2). Dans des
séries qui ont eu une prise en charge chirurgicale, le risque était
plus élevé lorsqu’il existait plus de quatre adénopathies métasta-
tiques pelviennes. Le siège des métastases est principalement le
foie, suivi par le poumon. La vascularisation du canal anal dépen-
dant à la fois du système porte et du système cave, une dissémi-
nation pulmonaire sans lésion hépatique associée est possible. Des
localisations osseuses sont également classiquement décrites.
“STAGING” ET PRONOSTIC
Au terme du bilan d’extension (examen clinique éventuellement
sous anesthésie générale, échoendoscopie anorectale, tomodensi-
tométrie abdominopelvienne et radiographie pulmonaire), la
tumeur est classée selon la classification TNM établie par l’Union
Internationale Contre le Cancer (tableau III). La taille de la tumeur
est le principal facteur déterminant le pronostic. Le taux de gué-
rison est de 80 % pour une lésion de moins de 2 cm et chute à moins
de 50 % lorsque la lésion mesure plus de 5 cm (1). En tenant compte
du stade, la survie à 5 ans varie de 100 % à 10 % : 100 % au stade 0,
80 % au stade I, 52 % au stade II, 48 % au stade III et 10 % au
stade IV (8). Le stade échographique associé à la taille de la tumeur
a également une valeur pronostique (10). Il est en effet corrélé à la
réponse au traitement par la radiothérapie. Dans une étude portant
sur 50 patients, les tumeurs classées UT1-2 de moins de 5 cm ont
régressé complètement après radiothérapie seule tandis qu’un
résidu tumoral persistait dans 36 % des cas pour les tumeurs
UT3-4 de moins de 5 cm et dans 100 % des cas lorsqu’il s’agis-
sait de tumeur UT3-4 de plus de 5 cm. L’âge, le sexe et le type his-
tologique n’ont pas d’influence sur le pronostic. Il en est de même
du SCC (squamous cell carcinoma antigen), marqueur tumoral des
carcinomes épidermoïdes, dont la sensibilité dans le cancer anal
est faible (14). Plus récemment dans une étude randomisée, il a été
démontré qu’une surexpression au niveau de la tumeur de la pro-
téine P53 était associée à un taux de survie et à un contrôle loco-
régional de la tumeur plus faibles (15). ■
Mots clés. Cancer anal – Échographie endo-anale –
Carcinome épidermoïde.
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Ryan DP, Compton CC, Mayer RJ. Carcinoma of the anal canal. N Engl J
Med 2000 ; 342 : 792-800.
2. Haddock MG, Martenson JA. Anal carcinoma. Cancer Treat Res 1998 ;
98 : 201-25.
3. Frisch M, Glimelius B, Van den Brule AJC et al. Sexually transmitted infec-
tion as a cause of anal cancer. N Engl J Med 1997 ; 337 : 1350-8.
4. Heino P, Goldman S, Lagerstedt U et al. Molecular and serologic studies of
human papilloma virus among patients with anal epidermoid carcinoma. Int J
Cancer 1993 ; 53 : 377-81.
5. Northfelt DW, Swift PS, Palefsky JM. Anal neoplasia. Pathogenis, diagno-
sis, and management. Hematol Oncol Clin North Am 1996 ; 10 : 1177-87.
6. Frisch M, Glimelius B, Wohlfahrt J et al. Tobacco smoking as a risk factor
in anal carcinoma : an anti-oestrogenis mechanism ? J Natl Cancer Inst 1999 ;
91 : 708-15.
7. Fuchshuber PR, Rodriguez-Bigas M, Weber T et al. Anal canal and peri-
anal epidermoid cancers. J Am Coll Surg 1997 ; 185 : 494-505.
8. Klas JV, Rothenberger DA, Wong WD et al. Malignant tumors of the anal
canal. Cancer 1999 ; 85 : 1686-93.
9. Ryan DP, Mayer RJ. Anal carcinoma : histology, staging, epidemiology,
treatment. Curr Opin Oncol 2000 ; 12 : 345-52.
10. Goldman S, Norming Ulf, Svensson C et al. Transrectal ultrasonography in
the staging of anal epidermoid carcinoma. Int J Colorect Dis 1991 ; 6 : 152-7.
11. Giovannini M, Seitz JF, Sfedj D et al. L’échographie endo-ano-rectale dans
le bilan d’extension et la surveillance des cancers épidermoïdes du canal anal
traités par radio-chimiothérapie. Gastroenterol Clin Biol 1992 ; 16 : 994-8.
12. Roseau G, Palazzo L, Colardelle P et al. Endoscopic ultrasonography in
the staging and follow-up of epidermoid carcinoma of the anal canal. Gas-
trointest Endosc 1994 ; 40 : 447-50.
13. Magdeburg B, Fried M, Meyenberger C. Endoscopic ultrasonography in the
diagnosis, staging, and follow-up of anal carcinoma. Endoscopy 1999 ; 31 : 359-64.
14. Fontana X, Lagrange JL, Francois E et al. Assessment of “squamous cell
carcinoma antigen” (SCC) as a marker of epidermoid carcinoma of the anal
canal. Dis Colon Rectum 1991 ; 34 : 126-31.
15. Bonin SR, Pajak TF, Russell AH et al. Overexpression of p53 protein and
outcome of patients treated with chemoradiation for carcinoma of the anal
canal. Cancer 1999 ; 85 : 1226-33.
245
La Lettre de l’hépato-gastroentérologue - no5 - vol. III - octobre 2000
T: TUMEUR
TX Tumeur primitive non évaluable
Tis Carcinome in situ
T0 Absence de tumeur primitive évidente
T1 2 < tumeur ≤5 cm
T2 Tumeur > 5 cm
T3 Tumeur envahissant les organes de voisinage (vagin,
urètre, vessie) quelles que soient ses dimensions
N: ADÉNOPATHIE
NX Extension ganglionnaire non évaluable
N0 Absence de métastases ganglionnaires régionales
N1 Adénopathies périrectales
N2 Adénopathies unilatérales iliaques internes
et/ou inguinales
N3 Adénopathies périrectales et inguinales
et/ou adénopathies bilatérales iliaques internes
et/ou inguinales
M: MÉTASTASE À DISTANCE
MX Métastases non évaluables
M0 Absence de métastases
M1 Présence de métastases
Tableau III. Classification TNM du cancer anal.
STADE STAGING
0Tis N0 M0
IT1 N0 M0
II T2 N0 M0
T3 N0 M0
IIIA T1 N1 M0
T2 N1 M0
T3 N1 M0
T4 N0 M0
IIIB T4 N1 M0
T1-4 N2 M0
T1-4 N3 M0
IV T1-4 N1-3 M1
1
/
5
100%