D o s s i e r :

250
Dossier : Génomique, recherche et thérapie en endocrinologie
Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume V, n° 6, novembre-décembre 2002
L
a thérapie génique représente une nou-
velle alternative thérapeutique qui peut
être définie comme le transfert de matériel
génétique vers une cellule cible afin d’inter-
férer avec la fonction d’un gène, de restaurer
une fonction perdue ou d’initialiser une nou-
velle fonction.
De grands efforts ont été accomplis ces dix
dernières années pour parvenir à un transfert
de gène efficace et durable, avec l’espoir de
réussir là où les thérapeutiques usuelles
avaient échoué. Cette approche novatrice sou-
lève de grands espoirs pour le traitement des
maladies monogéniques et des tumeurs endo-
criniennes.
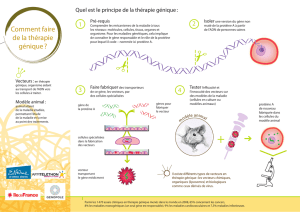
Les vecteurs de thérapie génique
(tableau)
Conceptuellement, le transfert d’ADN dans
des cellules de mammifères ne diffère pas de
l’administration de médicaments convention-
nels. Les principaux paramètres de la vecto-
rologie – l’équivalent de la galénique – sont
la nature du gène “thérapeutique”, le choix du
vecteur et le ciblage du transfert. Les vecteurs
appartiennent à deux grandes familles possé-
dant des qualités et des inconvénients diffé-
rents: les vecteurs viraux et les vecteurs syn-
thétiques.
Les vecteurs viraux
Historiquement, les vecteurs viraux ont été
les premiers utilisés pour le transfert de
gènes. En effet, les virus ont une capacité
naturelle à détourner à leur profit la machinerie
cellulaire pour survivre. Grâce à l’avancée de
la biologie moléculaire, il a été possible d’en
modifier le génome en supprimant leur capa-
cité de réplication. Ces virus recombinants
sont donc capables de véhiculer une cassette
d’expression contenant un transgène et son
promoteur, d’infecter différents types cellu-
laires et d’induire l’expression du gène d’in-
térêt par les cellules cibles. Cinq grandes
familles de virus sont utilisées en thérapie
génique : les rétrovirus, les adénovirus, les
virus associés à l’adénovirus (AAV), les herpes
virus (HSV) et les poxvirus utilisés dans des
stratégies vaccinales.
La plupart des vecteurs rétroviraux dérivent
du virus de la leucémie murine de Moloney
(MoMuLV), dont les gènes gag, pol et env
sont remplacés par une cassette d’expression
(1). La pérennisation de l’expression génique
est l’atout principal de ces vecteurs qui ont
suscité un grand nombre d’essais cliniques
chez l’homme. En revanche, ils présentent
certaines limites : le tropisme restreint aux
cellules en division, la capacité de l’insert
limitée, les titres viraux obtenus relativement
faibles, l’inactivation des rétrovirus murins
par le complément, l’apparition de particules
virales compétentes pour la réplication dans
les stocks viraux et, enfin, le risque de muta-
genèse insertionnelle. Toutefois, bien que le
lieu d’intégration de l’ADN viral dans le
génome de la cellule hôte soit aléatoire, le
risque de mutagenèse insertionnelle reste
faible, car moins de 2% du génome humain
est transcrit.
Les vecteurs adénoviraux (Ad) sont issus de
souches de virus responsables essentielle-
ment d’affections des voies respiratoires chez
l’homme (2, 3). Les régions E1 et E3 de leur
génome sont remplacées par une cassette
d’expression pour l’obtention de virus défectifs
et non réplicatifs. L’Ad constitue un vecteur
viral très efficace pour le transfert de gènes,
car il possède un large tropisme cellulaire et
une capacité d’infection à tous les stades du
cycle cellulaire. De plus, contrairement aux
rétrovirus, le génome de l’Ad ne s’intègre pas
dans le génome de l’hôte, minimisant ainsi les
risques d’oncogenèse insertionnelle. Enfin, la
production de stocks viraux est simple à
mettre en œuvre pour des titres élevés, indis-
pensables pour des essais cliniques chez
l’homme. Ces vecteurs adénoviraux ∆E1∆E3
sont cependant confrontés à trois inconvé-
nients majeurs: d’une part, la perte progres-
sive de l’expression du transgène dans les
tissus en division; d’autre part, la réaction
immunitaire induite par les protéines de la
capside et, enfin, l’émergence de particules
virales capables de se répliquer, ou RCA
Maladies endocriniennes et essais
de thérapie génique
D. Marot*
* Service d’hormonologie et biologie molé-
culaire, hôpital Bicêtre, Le Kremlin-Bicêtre.
Adénovirus Rétrovirus Lentivirus AAV ADN
nu ou complexé
Taille de l’insert < 7,5 kb < 8 kb < 8 kb < 4,5 kb > 20 kb
Expression transitoire intégration intégration transitoire
Infection cellulaire tous les stades quiescente tous les stades tous les stades tous les stades
Réponse immunitaire +++ + + + -
Production virale élevée moyenne moyenne moyenne très élevée
Sécurité virale virus réplicatifs virus réplicatifs virus réplicatifs virus helper -
Tableau. Avantages et inconvénients des principaux vecteurs utilisés en thérapie génique.

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume V, n° 6, novembre-décembre 2002
(Replication Competent Adenovirus) lors de
l’obtention du stock viral. Différentes équipes
se sont attachées, ces dernières années, à
éliminer d’autres gènes viraux pour aug-
menter la capacité de clonage de l’Ad (les Ad
de 3egénération ∆E1∆E3∆E4 [4] ou ces vec-
teurs minimaux “gutless” délétés de toutes
les régions codantes de l’Ad [5]) ainsi qu’à
diminuer les réponses immunitaires contre ce
type de vecteur par modification de la
capside. Ces nouveaux vecteurs adénoviraux
sont toutefois beaucoup plus difficiles à
produire.
Plus récemment, d’autres types de vecteurs
viraux ont été développés avec des résultats
préliminaires prometteurs: les AAV ainsi que
les lentivirus. L’AAV est un petit parvovirus,
dont six souches ont été isolées chez l’homme
(6). La principale caractéristique des AAV est
la présence obligatoire, lors de leur réplication,
d’un virus auxiliaire, ou “helper”, tel qu’un
adénovirus. Plusieurs propriétés des AAV les
rendent attractifs: un large tropisme cellulaire
et une capacité d’infection à tous les stades
du cycle, une expression du transgène à long
terme due à une intégration dans le génome
de l’hôte. Toutefois, la taille de la cassette
d’expression du transgène n’excède pas 4,5 kb
dans les vecteurs AAV. De plus, les premiers
essais cliniques montrent une expression à
court terme.
Les lentivirus recombinants possèdent les
mêmes propriétés que les rétrovirus (intégra-
tion de leur génome) mais peuvent provoquer,
contrairement aux rétrovirus, la transduction
des cellules à n’importe quel stade du cycle
cellulaire (1). Les premiers vecteurs ont été
dérivés à partir de lentivirus humains HIV-1
et de HIV-2 (7, 8). Plus récemment, d’autres
équipes ont mis au point des vecteurs capables
d’infecter les cellules humaines, dérivés de
lentivirus du singe (SIV) (9) ou de lentivirus
du chat (FIV) (10). Le caractère potentielle-
ment dangereux de ces vecteurs pour la santé
humaine rend leur maniement extrêmement
délicat. L’optimisation et la sécurisation des
systèmes de production restent des étapes
préliminaires à l’utilisation de ces vecteurs
dans des protocoles cliniques chez l’homme.
Les vecteurs non viraux
Les méthodes physicochimiques pour le
transfert de gènes (soit d’ADN nu, soit d’ADN
complexé) présentent certains avantages,
comme une toxicité et une immunogénicité
faibles, une capacité théorique de transfert de
gène illimitée ainsi qu’un faible coût à grande
échelle. Les quelques essais de thérapie
génique, principalement à visée antitumorale,
utilisant les vecteurs non viraux, tels que les
plasmides pCOR d’ADN nu (Conditional
Origin of Replication), qui ne contiennent ni
séquence de réplication d’origine bactérienne,
ni séquence de résistance aux antibiotiques,
ainsi que les vecteurs synthétiques com-
plexant l’ADN (les polymères cationiques et
les lipides cationiques) (11),sont pour le moins
décevants. Certes, la tolérance de ces nouveaux
médicaments se révèle acceptable chez les
patients traités, mais elle est malheureusement
associée à un manque d’efficacité réelle.
Actuellement, des équipes développent
l’électroperméabilisation, une technique
améliorant l’efficacité du transfert d’ADN nu
grâce à un champ électrique bref d’intensité
élevée, qui déstabilise la membrane cytoplas-
mique du tissu visé et permet ainsi le passage
facilité de l’ADN plasmidique nu (12). Les
résultats encourageants obtenus dans les
tissus musculaires permettent d’envisager
l’extension de ce procédé au traitement des
tumeurs (13, 14).
Une nouvelle stratégie, l’interférence des
ARN (RNAi), est en train d’émerger comme
un outil potentiellement utilisable pour l’in-
hibition de l’expression de gènes dans les cel-
lules de mammifères (15). Une stratégie de
régulation transcriptionnelle a été initiale-
ment développée, utilisant des ARN antisens
principalement dirigés contre des transcrits
d’oncogènes. Ces molécules d’ARN prévien-
nent l’assemblage des ribosomes par fixation
sur les séquences d’ARN messager complé-
mentaires et stoppent ainsi la translation du
codon. Cependant, le faible nombre de résultats
positifs recensés en pratique résulte principa-
lement de la difficulté d’obtention des
séquences d’ARN antisens efficaces.
En revanche, des systèmes stables d’expres-
sion de séquences courtes d’ARN double-
brin (dsRNAs), évalués dans les cellules de
mammifères, donnent des résultats prélimi-
naires très prometteurs (16). La RNAi, cette
nouvelle régulation post-transcriptionnelle,
est un mécanisme de dégradation des ARN
via un processus impliquant des séquences
d’ARN double-brin (17). Ce processus a été
mis en évidence après transfection d’ARN
double-brin dans une grande variété d’orga-
nismes (ceanorhabditis elegans,drosophila,
neurospora, plantes, zebrafish) (18).
Récemment, il a été montré que la transfection
de courtes séquences de dsRNAs (< 30 nt)
induit un silence spécifique des gènes cibles
dans les cellules mammifères (15). Bien que
cette réduction d’expression génique ne soit
que partielle et transitoire avec les systèmes
actuels, une application dans les tumeurs
mammaires surexprimant des oncogènes,
comme la tyrosine-kinase erbB2, ainsi que
dans les pathologies endocriniennes avec
hyperproduction hormonale paraît envisa-
geable dans un avenir proche.
Les applications potentielles
de la thérapie génique
en endocrinologie
De multiples mécanismes sont à l’origine de
désordres entraînant soit une hyper- soit une
hypofonction des tissus endocriniens, dont
une production anormale d’hormone, des
anomalies du métabolisme et du transport de
l’hormone ou encore une résistance à l’action
de l’hormone.
Dans un certain nombre de cas, les approches
thérapeutiques conventionnelles, notamment
la substitution hormonale, ne permettent pas
une guérison complète du patient. Tout
d’abord, lors d’un déficit en hormone ou en
récepteur, la thérapie génique corrective
représente une alternative avantageuse à
l’administration répétée de protéines (19). En
effet, plusieurs paramètres sont en faveur
d’une meilleure pharmacocinétique de cette
251
Dossier : Génomique, recherche et thérapie en endocrinologie

252
Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume V, n° 6, novembre-décembre 2002
stratégie : le contrôle transcriptionnel tissu-
spécifique de certains gènes (séquences
enhancer ou promoteur) et le ciblage des
vecteurs de transfert de gènes par des pro-
téines de surface tissu-spécifiques (comme
les récepteurs hormonaux). De plus, le coût
d’un oligonucléotide de synthèse est bien
inférieur à celui d’une protéine recombinante.
Les inconvénients sont l’absence de contrôle
physiologique de la sécrétion de la protéine
et la nécessité d’une administration répétée
du transgène. Ce dernier impératif rend pré-
férable l’utilisation de vecteurs non viraux
qui n’induisent pas de réponse immunitaire.
Par ailleurs, les pathologies liées à une
surexpression d’hormones sont de bonnes
candidates pour les stratégies de régulation
transcriptionnelle (ARN antisens,ARN inter-
férents). Enfin, la thérapie génique, initialement
envisagée comme une approche thérapeutique
des maladies héréditaires, s’est orientée vers
des visées antitumorales qui représentent, à
l’heure actuelle, plus de la majorité des essais
cliniques de thérapie génique dans le monde
(d’après www.wiley.co.uk/genetherapy/clinical).
Différentes approches de thérapie génique,
principalement médiées par des vecteurs adé-
noviraux, ont été évaluées dans les tumeurs
endocriniennes: l’utilisation d’un gène “sui-
cide” utilisant essentiellement le gène de la
thymidine-kinase du virus de l’Herpes simplex
de type 1 (HSV1-TK) dans des tumeurs pitui-
taires (20),l’immunothérapie antitumorale
via des cytokines telles que l’interleukine-2
(IL-2) dans des carcinomes thyroïdiens (21),
l’induction de l’apoptose par introduction du
gène sauvage p53 dans les lignées tumorales
thyroïdiennes (22, 23). De plus, les tumeurs
endocriniennes néovascularisées (les carci-
nomes thyroïdiens ou adrénocorticaux, les
phéochromocytomes malins) sont des cibles
potentielles pour les approches antiangiogé-
niques, via l’inhibition de l’expression de
protéines pro-angiogéniques, telles VEGF, ou
via la surexpression de molécules antiangio-
géniques, parmi lesquelles l’angiostatine qui
montre une bonne efficacité (24, 25). Enfin,
dans le cas des tumeurs de la thyroïde, le
transfert du gène du transporteur des iodures
NIS permet une efficacité accrue de la radio-
thérapie 131I en améliorant la capacité de
concentration intracellulaire de ces ions (26).
Les résultats encourageants observés lors de
ces expériences in vitro suggèrent un déve-
loppement futur de la thérapie génique des
maladies endocriniennes.
Perspectives
Le monde médical est entré dans l’ère de la
génétique moderne en rendant possible l’ex-
pression d’une protéine, d’origine endogène
ou exogène, par transfert de gène dans la cel-
lule-cible, ainsi que l’inhibition d’un gène
surexprimé. Certes, les premières études de
phase I sont décevantes, mais il est trop tôt
pour tirer des conclusions définitives sur
l’absence d’efficacité de la thérapie génique.
Des essais convaincants nécessitent l’inclu-
sion d’un nombre suffisant de malades dans
des essais multicentriques (actuellement,
quelques dizaines de patients pour la thérapie
génique, opposés à quelques centaines pour
les traitements anticancéreux, par exemple).
La délivrance d’un gène dans un corps
humain soulève encore beaucoup de pro-
blèmes techniques, mais qui ne semblent plus
insurmontables : dans le cas particulier des
maladies endocriniennes, comment respecter
le rythme circadien hormonal ainsi que les
cycles biologiques ? Comment cibler les
bonnes cellules ? Le facteur limitant de la
thérapie génique demeure le transfert de gène,
dont l’efficacité reste faible quel que soit le
type de vecteur utilisé.
L’amélioration du vecteur de transfert de
gène, le développement de nouvelles stratégies
comme les RNAi, ainsi que la combinaison
de plusieurs approches de thérapie génique
sont des voies à explorer dans l’avenir. Les
futurs essais cliniques devront prendre en
compte des critères comme la clinique et la
biologie, mais également un nouveau para-
mètre: les cartes d’expression génique issues
des puces à ADN. À chaque pathologie, il
sera possible d’associer un traitement spéci-
fique par son administration, son vecteur et
son gène d’intérêt.
Le domaine subit incontestablement une
maturation permettant de mieux recentrer les
grandes stratégies thérapeutiques potentielles.
Il ne faut pas, après une période d’euphorie
où la thérapie génique était présentée comme
la panacée à toutes les maladies, verser dans
une morosité, voire une diabolisation, de ce
concept. Certes, les incidents survenus aux
États-Unis, où un jeune homme est décédé
après avoir reçu une dose très élevée d’adéno-
virus recombinants et, plus récemment, en
France avec le diagnostic d’une leucémie
chez un enfant atteint d’un déficit immunitaire
combiné sévère (DICS) traité par thérapie
cellulaire par l’équipe du Pr A. Fisher, remet-
tent en cause le déroulement des essais cli-
niques mais certainement pas leur fondement
scientifique et médical. En effet, le rapport
américain “Varmus” du NIH prône un retour
à la recherche fondamentale en thérapie
génique après avoir établi un état des lieux
scientifique et clinique.
En dépit des deux incidents récents, la somme
des nombreuses connaissances acquises sur
les mécanismes hormonodépendants des
désordres endocriniens suggère que ceux-ci
sont de bons candidats pour cette future
médecine à la carte (27).
Références
1.
Masset M, Marty M, Cohen-Haguenauer O.
Vecteurs rétroviraux : technologie, sécurité,
applications. In : La thérapie génique. Paris :
éditions Tec & Doc, 2001 : 36-72.
2.
Benihoud K, Yeh P, Perricaudet M.
Adenovirus vectors for gene delivery. Curr
Opin Biotechnol 1999 ; 10 (5) : 440-7.
3.
Russell WC. Update on adenovirus and its
vectors. J Gen Virol 2000 ; 81 (11) : 2573-604.
4.
Yeh P et al. Efficient dual transcomplemen-
tation of adenovirus E1 and E4 regions from
a 293-derived cell line expressing a minimal E4
functional unit. J Virol 1996 ; 70 (1) : 559-65.
5.
Kochanek S. Development of high-capacity
adenoviral vectors for gene therapy. Thromb
Haemost 1999 ; 82 (2) : 547-51.
6.
Salvetti A, Nony P. Assemblage de vecteurs
AAV recombinants. In : La thérapie génique.
Paris : éditions Tec & Doc, 2001 : 155-66.
Dossier : Génomique, recherche et thérapie en endocrinologie

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume V, n° 6, novembre-décembre 2002
7.
Arya SK, Zamani M, Kundra P. Human
immunodeficiency virus type 2 lentivirus vectors
for gene transfer : expression and potential
for helper virus-free packaging. Hum Gene
Ther 1998 ; 9 (9) : 1371-80.
8.
Poeschla E et al. Identification of a human
immunodeficiency virus type 2 (HIV-2) encap-
sidation determinant and transduction of non-
dividing human cells by HIV-2-based lentivirus
vectors. J Virol 1998 ; 72 (8) : 6527-36.
9.
Schnell T et al. Development of a self-inac-
tivating, minimal lentivirus vector based on
simian immunodeficiency virus. Hum Gene Ther
2000 ; 11 (3) : 439-47.
10.
Poeschla EM, Wong-Staal F, Looney DJ.
Efficient transduction of nondividing human
cells by feline immunodeficiency virus lentiviral
vectors. Nat Med 1998 ; 4 (3) : 354-7.
11.
Vigneron JP et al. Guanidinium-cholesterol
cationic lipids : efficient vectors for the trans-
fection of eukaryotic cells. Proc Natl Acad Sci
USA 1996 ; 93 (18) : 9682-6.
12.
Mir LM. Antitumor electro-chemotherapy.
Bull Cancer 1994 ; 81 (9) : 740-8.
13.
Goto T et al. Highly efficient electro-gene
therapy of solid tumor by using an expression
plasmid for the herpes simplex virus thymidine
kinase gene. Proc Natl Acad Sci USA 2000 ;
97 (1) : 354-9.
14.
Mir LM. Therapeutic perspectives of in vivo
cell electropermeabilization. Bioelectrochem-
istry 2001 ; 53 (1) : 1-10.
15.
Caplen NJ et al. Specific inhibition of gene
expression by small double-stranded RNAs in
invertebrate and vertebrate systems. Proc Natl
Acad Sci USA 2001 ; 98 (17) : 9742-7.
16.
Xia H et al. siRNA-mediated gene silencing
in vitro and in vivo. Nat Biotechnol 2002 ; 20
(10) : 1006-10.
17.
Tuschl T. RNA interference and small
interfering RNAs. Chembiochem 2001 ; 2 (4) :
239-45.
18.
Hammond SM et al. Argonaute2, a link
between genetic and biochemical analyses of
RNAi. Science 2001 ; 293 (5532) : 1146-50.
19.
Rivera VM et al. Long-term regulated
expression of growth hormone in mice after
intramuscular gene transfer. Proc Natl Acad
Sci USA 1999 ; 96 (15) : 8657-62.
20.
Windeatt S et al. Adenovirus-mediated
herpes simplex virus type-1 thymidine kinase
gene therapy suppresses oestrogen-induced
pituitary prolactinomas. J Clin Endocrinol
Metab 2000 ; 85 (3) : 1296-305.
21.
Zhang R, Minemura K, De Groot LJ.
Immunotherapy for medullary thyroid carci-
noma by a replication-defective adenovirus
transducing murine interleukin-2. Endocrinology
1998 ; 139 (2) : 601-8.
22.
Blagosklonny MV et al. Effects of p53-
expressing adenovirus on the chemosensitivity
and differentiation of anaplastic thyroid cancer
cells. J Clin Endocrinol Metab 1998 ; 83 (7) :
2516-22.
23.
Narimatsu M et al. Therapeutic usefulness
of wild-type p53 gene introduction in a p53-
null anaplastic thyroid carcinoma cell line. J
Clin Endocrinol Metab 1998 ; 83 (10) : 3668-72.
24.
Carmeliet P. Mechanisms of angiogenesis
and arteriogenesis. Nat Med 2000 ; 6 (4) :
389-95.
25.
Hasan J, Jayson GC. VEGF antagonists.
Expert Opin Biol Ther 2001 ; 1 (4) : 703-18.
26.
Mandell RB, Mandell LZ, Link Jr CJ.
Radioisotope concentrator gene therapy
using the sodium/iodide symporter gene.
Cancer Res 1999 ; 59 (3) : 661-8.
27.
Barzon L et al. New perspectives for gene
therapy in endocrinology. Eur J Endocrinol
2000 ; 143 (4) : 447-66.
253
Dossier : Génomique, recherche et thérapie en endocrinologie
Les Lettres . Les Actualités . Les Correspondances . Les Courriers . Professions Santé . Les pages de la pratique médicale
Groupe de presse et d’édition santé
Claudie Damour -Terrasson et son équipe vous remercient de votre fidélité et vous souhaitent
Meilleurs voeux 2003
…Nous
faisons
de vos
spécialités
notre
spécialité
1
/
4
100%