Les temps forts de la SFE 2013

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XVIII - n° 3 - mars 2014
6060
Échos des congrès
© DA
Les temps forts de la SFE 2013
Anne Barlier*, **
* AP-HM, conception
hospital, molecular biology
laboratory, Aix-Marseille
Université CNRS, CRN2M,
UMR7286, Marseille.
** Vice-présidente du
comité scientifi que du
Congrès “SFE 2013”.
Le Congrès annuel de la Société française d’endocrinologie est un rendez-vous
incontournable de l’endocrinologie clinique et moléculaire. Ce congrès a réuni,
du 2 au 5 octobre 2013, à Paris 1 483 inscrits et a donné lieu à 722 abstracts. Le
prochain congrès se déroulera à Lyon du 5 au 8 novembre 2014 : nous vous y
espérons nombreux.
tissus où le gène est soumis à empreinte. Ces anomalies
sont retrouvées dans les pseudo hypoparathyroïdies de
type Ia ou Ib. Plus récemment, l’équipe d’Agnès Lingart
a mis en évidence un nouveau mécanisme d’inacti-
vation de la voie AMPc, chez des patients porteurs
d’une résistance hormonale multiple (TSH, PTH, GHRH,
gonadotropines, etc.) et d’une acrodysostose (1). Ainsi,
une mutation tronquante de la sous-unité régulatrice
R1A de la PKA a été identifi ée. Par une altération de la
liaison à l’AMPc, cette mutation rend la PKA incapable
de répondre à son second messager.
La voie de transduction dépendant de l’AMPc peut être
ainsi touchée à plusieurs niveaux, par des anomalies
génétiques ou épigénétiques, aboutissant au fi nal soit
à une activité constitutive de la voie et ainsi à un pro-
cessus prolifératif et d’hypersécrétion hormonale, soit à
l’inverse, à savoir un blocage, entraînant un syndrome
de résistance hormonale.
Krishna Chatterjee, de l’université de Cambridge, a
illustré dans sa conférence plénière la diff érence phé-
notypique de la résistance aux hormones thyroïdiennes
(RTH) selon qu’elle implique un défaut du récepteur aux
hormones thyroïdiennes TRβ ou TRα. Ces récepteurs
nucléaires sont codés par 2 gènes diff érents, THRB et
THRA, et ont une expression tissulaire spécifi que, mais
leur rôle respectif restait jusqu’à présent imprécis chez
l’homme.
Pendant longtemps, seule la RTH secondaire à des muta-
tions inactivatrices de TRβ était connue, caractérisée
par une élévation des taux plasmatiques des hormones
thyroïdiennes libres T3 et T4, une TSH non freinée et
des manifestations cliniques (tachycardie, goitre, etc.)
très variables dans leur présentation et leur intensité,
voire absentes.
La RTH secondaire à une mutation de TRα a été rap-
portée pour la première fois en 2012 par l’équipe de
L
ors de la soirée de gala, dans la magnifi que salle
de réception de l’Hôtel de Ville de Paris, la passa-
tion de fonctions, entre le comité organisateur
parisien représenté par le Pr Philippe Chanson et le
comité organisateur lyonnais représenté par le Pr Michel
Pugeat, a été magistrale. Et c’est par un “shoot” dans
un ballon rattrapé avec adresse par Michel Pugeat que
Philippe Chanson a transmis ses fonctions…
Dans ce programme scientifi que du Congrès “SFE 2013”,
orchestré par le Pr Patrice Rodien, je retiendrai en par-
ticulier 3 points, illustrant avec pertinence le fait que
l’endocrinologie est “la médecine de la transduction du
signal hormonal”, du récepteur jusqu’au noyau, chargée
de réparer les court-circuits ou les surchauff es de ces
circuits transductionnels, complexes, fi nement régulés,
permettant une sécrétion hormonale ajustée à l’orga-
nisme et aux événements intercurrents.
Au cours de sa conférence plénière, le Pr Agnès Linglart,
du CHU du Kremlin-Bicêtre, s’est intéressée à la voie
mettant en jeu l’AMP cyclique (AMPc) intracellulaire.
Après liaison de l’hormone à son récepteur, la sous-
unité α des protéines G hétérotrimériques induit la
production d’AMPc, qui active la protéine kinase (PKA).
Ainsi, l’activation constitutionnelle de cette voie par
mutation activatrice de Gs-α (oncogène gsp) ou par
mutation inactivatrice de la sous-unité régulatrice de la
PKA (R1A) est à l’origine d’un processus oncogénique
concernant en particulier les glandes endocrines et
retrouvé dans le syndrome de Carney ou les adénomes
hypophysaires. À l’inverse, une production défi ciente
d’AMPc est retrouvée dans les résistances hormonales
(TSH, PTH, PTHrp, etc.) et implique un défaut du récep-
teur ou de la sous-unité Gs-α à laquelle il est couplé.
Les défauts de Gs-α peuvent être secondaires soit à des
mutations inactivatrices soit à des pertes de l’empreinte
du gène à l’origine d’une perte d’expression dans les

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XVIII - n° 3 - mars 2014
6161
Les temps forts de la SFE 2013
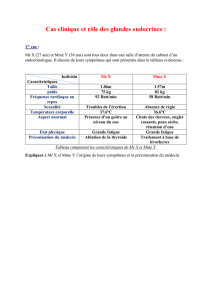
K. Chatterjee (2). Les manifestations cliniques associent
un retard de croissance, prédominant sur les jambes,
une dysgénésie fémorale épiphysaire, une discrète dys-
morphie avec macrocéphalie, une dentition retardée,
une constipation sévère, un retard mental modéré et
une diffi culté dans la coordination musculaire de la
motricité fi ne. La TSH reste normale. Un taux “normal
bas” de FT4 est associé à un taux élevé de FT3, et c’est
la combinaison du rapport T4/T3 fortement diminué,
avec des signes d’hypothyroïdie, qui peut faire évoquer
ce syndrome. L’augmentation de la FT3 est due à une
diminution de l’activité de certaines désiodases qui se
traduit par une diminution de la reverse T3, observée
chez ces patients.
Grâce à la description clinique de ces 2 RTH, le rôle d’une
isoforme par rapport à l’autre dans chaque tissu a pu
ainsi être clarifi é. Cette proportion des 2 isoformes est
déterminante dans les manifestations cliniques de la
RTH. Ainsi, ces dernières sont supérieures dans le cœur,
l’intestin, l’os, le muscle et le cerveau pour les RTH dues à
des mutations de TRα. À l’inverse, les mutations de TRβ
perturbent plus fortement la boucle de rétrocontrôle
hypothalamo-hypophyso-thyroïdienne, ce qui se traduit
par des signes davantage biologiques.
Enfi n, le Pr Hervé Lefebvre, du CHU de Rouen, a revi-
sité lors de sa conférence plénière le syndrome de
Cushing “ACTH-indépendant”. L’hyperplasie bilatérale
macronodulaire surrénalienne, indépendante de l’ACTH
circulante, est une cause rare d’hypersécrétion surréna-
lienne de cortisol. Avec son équipe, il vient de mettre
en évidence une sécrétion d’ACTH intratumorale par
des cellules “gonadique-like” (3). Le niveau d’expression
de la pro-opiomélanocortine était corrélé à celui du
récepteur de la mélanocortine de type 2 (MC2R). Cette
sécrétion intra-surrénalienne n’était pas régulée par les
classiques régulateurs du cortisol comme le cortisol, ou
la CRH, mais stimulable par des facteurs activant des
récepteurs aberrants. Cette sécrétion était retrouvée in
vivo dans les veines surrénaliennes chez les patients.
Enfin, des antagonistes de MC2R étaient capables
d’inhiber l’hypersécrétion de cortisol, ouvrant ainsi
des perspectives thérapeutiques. Dans l’hyperplasie
macronodulaire bilatérale des surrénales, la production
de cortisol serait ainsi sous le contrôle à la fois de l’ACTH
produite localement et de l’expression aberrante de
récepteurs membranaires, permettant ainsi un signal
amplifi cateur de la sécrétion de cortisol, indépendant
de l’ACTH circulante mais sous le contrôle de l’ACTH
intratumorale.
Le Congrès de la SFE 2013 a abordé plusieurs aspects de
la transduction du signal hormonal et de ses anomalies.
Le comité scientifi que du Congrès “SFE 2014”, animé par
son président, le Pr Philippe Touraine, et son vice-pré-
sident, le Pr Hubert Vidal, travaille avec enthousiasme
pour nous préparer un programme riche autour du
thème “L’endocrinologie au cœur des spécialités”.
■
1.
Linglart A, Menguy C, Couvineau A et al. Recurrent PRKAR1A
mutation in acrodysostosis with hormone resistance. N Engl
J Med 2011;9;364(23):2218-26.
2. Bochukova E, Schoenmakers N, Agostini M et al. A mutation
in the thyroid hormone receptor alpha gene. N Engl J Med
2012;366(3):243-9.
3. Louiset E, Duparc C, Young J et al. Intraadrenal corticotropin
in bilateral macronodular adrenal hyperplasia. N Engl J Med
2013;369(22):2115-25.
Références
L’auteur déclare ne pas avoir
de liens d’intérêts.
1
/
2
100%