L M

MISE AU POINT
172
La Lettre du Cancérologue - Volume XII - no5 - septembre-octobre 2003
L
e cancer colorectal (CCR) représente dans les pays
occidentaux un problème majeur de santé publique. En
France, le nombre estimé de CCR pour l’année 1995
était de 33 405. Pour la même année, le CCR était responsable
de 16 168 décès. Il se situe donc en termes d’incidence et de mor-
talité au troisième rang chez l’homme, derrière les cancers de la
prostate et du poumon, et au deuxième rang chez la femme, der-
rière le cancer du sein. La prévalence totale estimée du CCR pour
l’année 1990 était de 190 396 cas. La probabilité pour un homme
français de développer un CCR au cours de sa vie est de 5,7 %
(soit un homme sur 17) et, chez une femme, de 5 % (une femme
sur 20) (1). En termes économiques, une étude récente évaluait
le coût total du CCR pour la société en France en 1999 à 997 mil-
lions d’euros (2).
Le but du dépistage du CCR est de réduire son poids sur la santé
publique en termes de mortalité et de morbidité. Le dépistage
vise à abaisser la mortalité due au CCR par détection de tumeurs
à un stade précoce, et à diminuer son incidence par le diagnos-
tic et l’exérèse des lésions précancéreuses que sont les polypes
adénomateux.
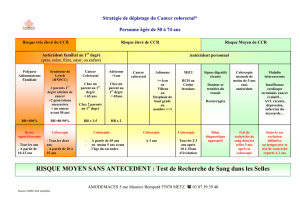
Le dépistage peut s’adresser à deux types de sujets : les sujets à
risque moyen (risque “normal”), et les sujets à risque élevé en
raison d’antécédents personnels ou familiaux.
Les patients présentant des signes d’appel comme des douleurs
abdominales inexpliquées, une modification récente du transit,
des rectorragies, une anémie ferriprive et/ou une altération de
l’état général ne relèvent pas du dépistage, mais doivent bénéfi-
cier rapidement des explorations appropriées.
DÉPISTAGE DU CCR
CHEZ LES SUJETS À RISQUE MOYEN
Les sujets à risque moyen sont les sujets de plus de 45 (ou 50) ans,
asymptomatiques et sans antécédent personnel ou familial d’adé-
nome ou de CCR, et non atteints de maladies inflammatoires
intestinales (maladie de Crohn ou rectocolite hémorragique).
Il s’agit ici d’un dépistage de masse concernant une très large
population, non demandeuse d’examens complémentaires. Il faut
donc proposer un test sans danger, de réalisation facile et bien
accepté par la population, très spécifique et peu onéreux.
Plusieurs tests sont envisageables :
●
La rectosigmoïdoscopie (rigide ou souple). Elle n’explore
que le rectum et le bas sigmoïde (environ 50 cm), mais elle a mon-
tré son efficacité à diminuer la mortalité par CCR depuis une étude
rétrospective cas témoin américaine (3). C’est un examen peu uti-
lisé en France. Dans les pays anglo-saxons, il est parfois prati-
qué par du personnel paramédical spécialement formé. Actuel-
lement, deux grands essais randomisés sont en cours, l’un en
Italie, l’autre en Grande-Bretagne, sur une population globale de
50 000 patients (4, 5).
●
La coloscopie. C’est l’examen le plus sensible. Son utilité
n’a pas encore été évaluée dans le dépistage, mais une vaste
étude randomisée est en cours aux États-Unis. Cependant, son
efficacité semble incontestable puisqu’elle permet l’ablation
de tous les polypes coliques et, par là, une diminution de l’inci-
dence du CCR (6).
Ces deux examens endoscopiques sont mal acceptés, car néces-
sitant une préparation et comportant un risque iatrogène non
négligeable. De plus, leur coût paraît incompatible à ce jour avec
un dépistage de masse, surtout pour la coloscopie, avec la néces-
sité d’une anesthésie. En France, un dépistage de masse par colo-
scopie entre 45 et 75 ans entraînerait 15 millions d’examens,
avec un risque de 9 000 perforations et de 300 décès par an !
●
Le lavement baryté à double contraste. Cet examen manque
de sensibilité et de spécificité ; il ne peut être retenu (7).
●
La recherche de saignement occulte dans les selles. Il s’agit
de la méthode potentiellement la plus adéquate et la mieux éva-
luée dans le dépistage de masse du CCR.
Le test consiste en l’application sur un papier réactif d’échantillon
de selles, généralement deux prélèvements en deux points diffé-
rents de la selle sur trois selles successives. La lecture du test doit
être centralisée et le test non réhydraté pour éviter les faux posi-
tifs, qui conduiraient à des explorations inutiles. Le test le plus
utilisé est le test Hémoccult®II dont le coût, lecture comprise, est
d’environ 15 euros.
Trois essais randomisés évaluant l’intérêt de l’Hémoccult®en
dépistage du CCR ont été publiés. Ils sont résumés dans le
tableau I (8-12).
En proposant un test Hémoccult®tous les deux ans, ces trois
études démontraient une diminution significative de la mortalité
par CCR dans le population dépistée, diminution allant de 15 à
21 %. L’étude américaine ne mettait pas en évidence de réduc-
Quel dépistage pour le cancer colorectal en l’an 2003 ?
Screening for colorectal cancer: state of the art in 2003?
●
P. Artru*
* Service de gastroentérologie, clinique Saint-Jean, 69373 Lyon Cedex 08.

173
La Lettre du Cancérologue - Volume XII - no5 - septembre-octobre 2003
tion significative après treize ans de suivi, mais une poursuite de
la surveillance a clairement montré un bénéfice après cinq années
supplémentaires de suivi (12). Une diminution de l’incidence, par
dépistage (et traitement) des gros adénomes, pourrait apparaître
dans les dix prochaines années.
Ces trois études retrouvaient également un taux plus important
de CCR limités à la paroi colique (stades A et B), mais ce résul-
tat peut être renforcé par de nombreux biais.
En revanche, l’acceptabilité du test différait notablement dans
l’étude américaine, qui n’enrôlait que des volontaires, par rap-
port aux études européennes. Par ailleurs, la méthode de lecture
avec réhydratation des tests quasi systématique aux États-Unis
conduisait à un fort taux de positivité, induisant de nombreux faux
positifs avec baisse de la valeur prédictive positive, baisse de la
spécificité du test et, surtout, provoquant un grand nombre
d’explorations endoscopiques inutiles (28 % de la population
testée a eu au moins une coloscopie) (8).
En France, un programme de dépistage du CCR par Hémoccult®
en Bourgogne a inclus 45 642 personnes de 45 à 74 ans. Cinq
campagnes successives ont été réalisées entre 1988 et 1996. Le
taux de participation à la campagne, proposée par les médecins
généralistes (avec lettre de relance), a varié entre 52,8 % et
58,3 %. Le rôle du médecin généraliste paraît fondamental, tant
pour le taux de participation que pour la pratique d’explorations
en cas de positivité du test. Le taux de positivité du test, lu sans
réhydratation, était de 2,1 % à la première campagne, puis variait
aux alentours de 1,3 %. La valeur prédictive positive du test pour
le CCR était de 11,4 % (17,1 % pour les adénomes supérieurs à
1 cm de diamètre). Ainsi, de 35,9 % à 47,3 % des sujets avec test
positif présentaient un CCR ou un adénome (13). L’impact sur
l’incidence ou la mortalité liée au CCR n’est pas encore connu,
mais, par ailleurs, ces résultats sont comparables à ceux des
grands essais européens (9, 10).
Une méta-analyse récente des différents essais contrôlés réalisés
par Hémoccult®conclut qu’il faut dépister 1 173 personnes pour
prévenir l’apparition d’un CCR sur 10 ans (14). Les performances
de ce type de test demeurent donc modestes et doivent être dis-
cutées en termes d’études coût/efficacité, mais aussi être rééva-
luées en fonction des évolutions technologiques (tests immuno-
réactifs) ou en association avec des examens endoscopiques.
Bien entendu, la valeur individuelle d’un dépistage du CCR par
Hémoccult®reste discutée, et sa réalisation n’est alors pas recom-
mandée par la conférence de consensus de 1998 (15).
En conclusion, un test Hémoccult®réalisé tous les deux ans chez
les personnes âgées de 45 à 75 ans, sans réhydratation, dans le
cadre d’un dépistage de masse, touchant plus de la moitié de la
population, peut faire reculer la mortalité par CCR. Un tel dépis-
tage se met en place actuellement en France, d’abord dans des
départements tests ; il devrait ensuite être étendu progressivement.
Il lui faudra impliquer pour sa réussite les généralistes, les gas-
troentérologues et les pouvoirs publics, qui devront assumer la
coordination et le financement d’une telle campagne.
DÉPISTAGE DU CCR CHEZ LES SUJETS
À RISQUE ÉLEVÉ OU TRÈS ÉLEVÉ
Dans ce cas de figure, le test Hémoccult®n’a pas sa place, et la
coloscopie est l’examen roi, la date du premier examen et la fré-
quence de surveillance demeurant les principaux problèmes à
résoudre.
Sujets à risque très élevé
Il s’agit des familles atteintes de CCR sur polypose ou de CCR
sur syndrome HNPCC (hereditary non polyposis colorectal can-
cer). Ces CCR représentent respectivement 1 % et de 1 à 5 % des
CCR. Le dépistage dans ces familles doit être mis en œuvre dans
le cadre d’une prise en charge globale de génétique oncologique,
qui sera traitée dans un autre exposé. On peut retenir l’importance
majeure de la coloscopie comme moyen de dépistage, cet exa-
men devant être proposé au minimum cinq ans avant l’âge de sur-
venue du cas index dans le syndrome HNPCC, et dès la puberté
dans la polypose.
Sujets à risque élevé
●
Antécédents personnels d’adénome ou de CCR. Chez un
sujet avec antécédent personnel d’adénome (> 1 cm ou avec
contingent villeux), le risque de développer un nouvel adénome
varie de 37 à 56 %. Dans le cas d’un antécédent de CCR, les
Tableau I. Résultats des trois essais randomisés de dépistage du CCR par Hémoccult
®
.
Étude
randomisée
Mandel
(1993, 1999)
Kronborg
(1996, 2002)
Hardcastle
(1996)
Population
Minnesota,
États-Unis,
volontaires
Funen,
Danemark,
population
Nottingham,
Grande-Bretagne,
population
Groupe
testé
(n)
15 587*
30 967
76 466
Groupe
contrôle
(n)
15 934
30 966
76 384
Test
Hémoccult®
biannuel
(réhydraté)
Hémoccult®
biannuel
(NR)
Hémoccult®
biannuel
(NR)
Participation
– 1 campagne
– tous tests (%)
90
60
67
46
60
38
Taux
de
positivité
9,8
0,8-1,8
1,2-2,1
VPP/
CCR
(%)
5,6
10-17,7
9,9-11,9
Dukes A
testé/contrôle
(%)
Pas de différence
23 versus 12
21 versus 12
RR
mortalité/CCR
(IC95)
0,79
(0,62-0,97)
0,82
(0,68-0,99)
0,86
(0,74-0,99)
NR : non réhydraté. IC
95
: intervalle de confiance à 95 %. * Il existait aussi un groupe dépisté annuellement de 15 570 personnes.

MISE AU POINT
174
La Lettre du Cancérologue - Volume XII - no5 - septembre-octobre 2003
risques de développer un CCR ou un polype métachrone sont res-
pectivement évalués entre 3 et 8 % et entre 25 et 40 %. Le dépis-
tage se fait par une coloscopie à trois ans, puis, si elle est néga-
tive, tous les cinq ans (15, 16).
●
Antécédents personnels de colite inflammatoire (maladie
de Crohn [RCH]). Le risque est majeur dans les RCH avec pan-
colite et durée d’évolution supérieure à dix ans. Un dépistage
par coloscopie tous les deux ans avec biopsies étagées (à la
recherche de dysplasies) est conseillé à partir de quinze années
d’évolution (15, 16).
●
Antécédent familial de CCR ou de polypes. Un tel antécé-
dent est retrouvé dans environ 15 % des CCR. En cas de CCR,
le risque est nettement augmenté en cas d’atteinte de plusieurs
parents au premier degré (risque relatif de 4) et de survenue pré-
coce du CCR (risque relatif de 4 en cas de survenue chez un
parent de moins de 45 ans). De même, il existe un risque majoré
en cas d’antécédent familial de polype supérieur à 1 cm ou
survenu avant 60 ans.
En cas d’antécédent familial de CCR survenu avant 60 ans (ou
d’atteinte de plusieurs parents au premier degré, quel que soit
leur âge), une coloscopie de dépistage doit être proposée dès
45 ans ou cinq ans avant le cas index. L’intérêt d’un dépistage
en cas d’antécédent familial de CCR unique survenu après
60 ans, ou d’antécédent familial de polypes, et ses modalités
sont discutés (15, 16).
CONCLUSION
Le dépistage du CCR doit être une priorité du praticien en ce
début du XXIesiècle, au même titre que celui du cancer du sein
et du cancer du col de l’utérus, où des stratégies de dépistage de
masse ont fait la preuve de leur efficacité. À l’échelon indivi-
duel, en cas de signes d’appel ou de facteurs de risque, la colo-
scopie s’impose comme l’examen indispensable, en attendant la
coloscopie virtuelle. Au niveau national, l’organisation d’un
dépistage par Hémoccult®ne peut être envisagée que dans le cas
de stratégies bien définies dont le médecin traitant sera le pivot.
Dans l’immédiat, on ne peut que se réjouir de voir ce dépistage
figurer dans les priorités du gouvernement concernant la
lutte contre le cancer (conférence de presse du secrétariat d’État
de janvier 2000, discours du président de la République du
14 juillet 2002). À l’heure actuelle, plusieurs départements
entament la mise en place du dépistage. Souhaitons-leur bonne
chance dans ce travail de longue haleine !
■
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Réseau FRANCIM. Cancers du côlon et du rectum. In : Réseau FRANCIM,
eds. Le cancer en France : incidence et mortalité. Situation en 1995. Évo-
lution entre 1975 et 1995. Paris : ministère de l’Emploi et de la Solidarité,
1998 : 46-51.
2. Selke B, Durand I, Marissal JP et al. Coût du cancer colorectal en France
en 1999. Gastroenterol Clin Biol 2003 ; 27 : 22-7.
3. Selby JV, Friedman DG, Quesenberry CP et al. A case-control study of
screening sigmoidoscopy and mortality from colorectal cancer. N Engl J Med
1992 ; 326 : 653-7.
4. Segnan N, Senore C, Andreoni B et al. Baseline findings of the Italian mul-
ticenter randomized controlled trial of “once-only sigmoidoscopy”- SCORE.
J Natl Cancer Inst 2002 ; 94 : 1763-72.
5. UK Flexible Sigmoidoscopy Screening Trial Investigators. Single flexible
sigmoidoscopy screening to prevent colorectal cancer: baseline findings of a
UK multicentre randomised trial. Lancet 2002 ; 359 : 1291-300.
6. Winawer SJ, Zauber AG, Nah Ho M et al. Prevention of colorectal cancer
by colonoscopic polypectomy. N Engl J Med 1993 ; 329 : 1977-81.
7. Kewenter J, Brevinge G, Engaras B et al. The yield of flexible sigmoido-
scopy and double-contrast barium enema in the diagnosis of neoplasms in the
large bowel in patients with a positive hemoccult test. Endoscopy 1995 ; 27 :
159-63.
8. Mandel JS, Bond JH, Church TR et al. Reducing mortality from colorectal
cancer by screening for fecal occult blood. N Engl J Med 1993 ; 328 : 1365-71.
9. Kronborg O, Fenger C, Olsen J et al. Randomised study of screening for
colorectal cancer with faecal-occult-blood test. Lancet 1996 ; 348 : 1467-71.
10. Jorgensen OD, Kronborg O, Fenger C. A randomised study of screening
for colorectal cancer using faecal occult blood testing : results after 13 years
and seven biennial screening rounds. Gut 2002 ; 50 : 29-32.
11. Hardcastle JD, Chamberlain JO, Robinson MHE et al. Randomised
controlled trial of faecal-occult-blood screening for colorectal cancer. Lancet
1996 ; 348 : 1472-7.
12. Mandel JS, Church TR, Ederer F et al. Colorectal cancer mortality :
effectiveness of biennial screening for fecal occult blood. J Natl Cancer Inst
1999 ; 91 : 434-7.
13. Tazi MA, Faivre J, Lejeune C et al. Performances du test Hémoccult®
dans le dépistage des cancers et adénomes colorectaux. Gastroenterol Clin
Biol 1999 ; 23 : 575-80.
14. Towler B, Irwig L, Glasziou P et al. A systematic review of the effects of
screening for colorectal cancer using the faecal occult blood test, Hemoccult®.
Br Med J 1998 ; 317 : 559-65.
15. Conférence de consensus : prévention, dépistage et prise en charge des
cancers du côlon. Paris, 1998.
16. Markowitz AJ, Winawer SJ. Screening and surveillance for colorectal
cancer. Semin Oncol 1999 ; 26 : 485-98.
Tous les articles publiés dans La Lettre du Cancérologue le sont sous la seule responsabilité de leurs auteurs.
Edimark S.A., 62-64, rue Jean-Jaurès, 92800 Puteaux
Tous droits réservés - Dépôt légal : à parution - ALJAC S.A. Locataire gérant de EDIMARK S.A.
© mai 1992 - Imprimé en France - Point 44 - 94500 Champigny-sur-Marne
Ce numéro est routé avec :
✓un guide pratique “Prise en charge de la douleur des gestes invasifs” (20 pages) ;
✓un flyer “Journal On Line”, San Antonio ;
✓un numéro supplémentaire “actualités sur la gemcitabine à l’ASCO 2003” (20 pages).
1
/
3
100%