Diabétologie - CHUPS – Jussieu

Université Pierre et Marie Curie
Diabétologie
Questions d’internat
1999 - 2000
Pr. A. Grimaldi
Mise à jour : 16 février 2000

2/142 Diabétologie - Pr. A. Grimaldi 1999 - 2000

Table des matières
1999 - 2000 Diabétologie - Pr. A. Grimaldi 3/142
Table des matières
3Table des matières
7Chapitre 1 : Diabète : épidémiologie, diagnostic, étiologie
71.1 Epidémiologie
81.2 Définition du diabète
81.2.1 Définition
81.2.2 Place de l’HGPO
91.2.3 Intolérance aux hydrates de carbone et hyperglycémie à jeun non diabétique
91.2.4 Conclusion
10 1.3 Classification, étiologies
10 1.3.1 Classification
12 1.3.2 Etiologies du diabète
13 1.4 Bibliographie
15 Chapitre 2 : Physiopathologie du diabète de type 1
15 2.1 Le terrain génétique de susceptibilité
16 2.2 Les facteurs déclenchants
17 2.3 Déroulement de la réaction auto-immune
17 2.4 Intérêt de la recherche des anticorps pancréatiques
17 2.5 Diabète de type 1
19 Chapitre 3 : Physiopathologie du diabète de type 2
19 3.1 L’insulinorésistance
19 3.1.1 Mécanisme de l’insulinorésistance
20 3.1.2 Facteurs cliniques d’insulinorésistance
21 3.1.3 L’insulino-résistance
21 3.2 Insulinodéficience
21 3.3 Remarque
22 3.4 Erreurs conceptuelles et pratiques en matière de diabète de type 2
23 Chapitre 4 : Diabète et grossesse (y compris diabète gestationnel) :
Diagnostic, Complications, Principes du traitement
23 4.1 Diabète de type I et de type II
23 4.1.1 Les complications
25 4.1.2 Facteurs de mauvais pronostic lors d’une grossesse chez une femme
diabétique

Table des matières
4/142 Diabétologie - Pr. A. Grimaldi 1999 - 2000
25 4.1.3 Prise en charge de la grossesse chez une femme diabétique (diabète de type 1
et 2)
27 4.2 Diabète gestationnel
27 4.2.1 Définition
28 4.2.2 Complications du diabète gestationnel
28 4.2.3 Diagnostic et dépistage du diabète gestationnel
29 4.2.4 Surveillance de la grossesse
31 Chapitre 5 : Recommandations de l’ANAES : suivi du patient
diabétique de type 2 à l’exclusion du suivi des
complications
31 5.1 Diagnostic
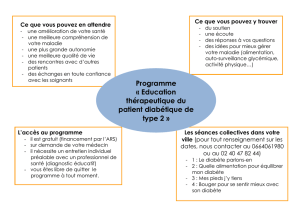
32 5.2 Education du patient
32 5.3 Suivi glycémique
33 5.4 Suivi des facteurs de risque vasculaire
35 5.5 Dépistage des complications oculaires
36 5.6 Dépistage des complications rénales
37 5.7 Dépistage des complications neurologiques et prévention de la plaie du pied
37 5.8 Dépistage des complications cardio-vasculaires
38 5.9 Divers
38 5.10 Rythme des consultations
41 5.11 Force des recommandations
43 Chapitre 6 : Complications du diabète (type 1 et 2)
43 6.1 La neuropathie diabétique
43 6.1.1 Facteurs favorisants
44 6.1.2 Formes cliniques
44 6.1.2.1 Les mononeuropathies et les mononeuropathies multiples
44 6.1.2.2 Les polyneuropathies diabétiques
45 6.1.2.3 La neuropathie végétative
49 6.1.3 Traitement de la douleur des neuropathies diabétiques douloureuses
49 6.2 La néphropathie diabétique
49 6.2.1 La glomérulopathie
49 6.2.1.1 La glomérulopathie diabétique
51 6.2.1.2 Les 5 stades de la néphropathie diabétique
52 6.2.1.3 La glomérulopathie incipiens
52 6.2.1.4 La glomérulopathie patente
53 6.2.2 Les infections urinaires
53 6.2.2.1 Les infections urinaires basses
54 6.2.2.2 Les infections aiguës du haut appareil
54 6.2.2.3 La néphropathie due aux produits de contraste iodés
56 6.3 Macroangiopathie diabétique
56 6.3.1 Epidémiologie : fréquence et gravité

Table des matières
1999 - 2000 Diabétologie - Pr. A. Grimaldi 5/142
57 6.3.2 Rôle des facteurs de risque et de l’hyperglycémie : conséquences cliniques
57 6.3.3 Particularités cliniques de la macroangiopathie diabétique
57 6.3.3.1 Tableaux cliniques à haut risque d’athérosclérose
58 6.3.3.2 Complications de l’athérosclérose
59 6.3.4 Prévention de la macroangiopathie
61 6.4 Le pied diabétique ou comment prévenir les amputations ?
61 6.4.1 Quels sont les diabètiques à risque podologique ?
62 6.4.2 Comment dépister les pieds à risque podologique ?
63 6.4.3 Que faire en cas de plaie du pied chez un diabétique ?
63 6.4.3.1 En rechercher la cause
63 6.4.3.2 Faire la part de l’artérite et de la neuropathie
64 6.4.4 Toute plaie du pied chez un diabétique nécessite-t-elle obligatoirement une
hospitalisation en urgence ?
64 6.4.5 En urgence, l’interne de garde doit
64 6.4.6 Le lendemain et les jours suivants
67 Chapitre 7 : Acidose lactique : physiopathologie, étiologie, diagnostic
67 7.1 Physiopathologie - étiologie
69 7.2 Diagnostic, clinique et biologique
69 7.3 Traitement
71 Chapitre 8 : Acidocétose diabétique : physiopathologie, étiologie,
diagnostic, traitement
71 8.1 Physiopathologie
71 8.1.1 Rôle de la carence en insuline
74 8.1.2 Rôle des hormones de « contre-régulation »
75 8.2 Etiologie
76 8.3 Diagnostic
76 8.3.1 Phase dite de pré-coma diabétique
76 8.3.2 Phase d’acidocétose sévère
77 8.3.3 Examens complémentaires
78 8.4 Diagnostic différentiel
78 8.4.1 Si le diabète n’est pas connu
78 8.4.2 Si le diabète est connu
79 8.5 Traitement
79 8.5.1 Le traitement de la cétose
80 8.5.2 La réanimation hydro-électrolytique
80 8.5.3 Les soins non spécifiques du coma
80 8.5.4 Traitement des causes déclenchantes
81 8.5.5 Complications secondaires
83 8.6 Prévention
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
1
/
142
100%