Lire l'article complet

Images en Dermatologie • Vol. VII • n
o
1 • janvier-février 2014
6
Congrès-Réunion
La deuxième édition de la Journée d’actualité
en cancérologie cutanée (JACC), du généraliste
aux spécialistes, s’est tenue le jeudi 6 février 2014
à Paris. Le Pr Marie-Thérèse Leccia, présidente du groupe
de cancérologie cutanée de la Société française
de dermatologie, a introduit cette journée en rappelant
que la prise en charge des cancers cutanés, les cancers
les plus fréquents chez l’homme, est multidisciplinaire,
et que le paysage thérapeutique des mélanomes
et des carcinomes s’est modifi é ces dernières années,
avec l’arrivée de nouvelles molécules.
La problématique du diagnostic précoce
des mélanomes
D’après le Pr Florent Grange (dermatologue, Paris) et le Dr Franck
Arnold (médecin généraliste responsable d’une structure de dépis-
tage)
Le mélanome en quelques chiffres et tendances
(encadré 1)
Ainsi, se pose la question d’un biais de “surdiagnostic” des
mélanomes fi ns, peu ou pas pourvoyeurs de mortalité, tandis
que la diffi culté persistante est de diagnostiquer précoce-
ment les mélanomes épais “tueurs”. Cela constitue un objectif
majeur pour infl échir la mortalité liée au mélanome.
Journée d’actualité en cancérologie cutanée :
compte-rendu
Paris, le 6 février 2014
S. Ly (Gradignan)
Caractéristiques des mélanomes très épais
(Breslow ≥ 3 mm)
[encadré 2]
En effet:
▶Le médecin généraliste dépiste des mélanomes plus épais
que le dermatologue: 2,05 versus 1,32 (p<0,001).
▶
Le médecin généraliste dépiste une population différente,
plus âgée, et c’est le seul interlocuteur du sujet isolé socia-
lement.
▶
La participation du médecin généraliste à des “training
sessions” :
– diminue l’incidence des mélanomes épais;
– diminue l’épaisseur des mélanomes diagnostiqués;
– diminue la proportion des mélanomes épais et augmente
celle des mélanomes fi ns.
Améliorer le diagnostic précoce des mélanomes
épais et très épais ?
▶De nouveaux messages
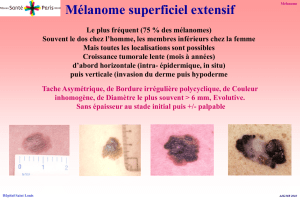
Il faut insister sur le “E” de “Évolution”: “C’est quoi ce truc qui
pousse sur ma peau?”
(fi gure)
car la règle ABCD ne s’applique
pas au diagnostic des mélanomes achromiques et à croissance
rapide.
▶De nouvelles cibles
L’homme âgé, isolé socialement, peu enclin au dépistage.
▶
Promouvoir l’éducation diagnostique du médecin géné-
raliste
Il est le seul interlocuteur du patient socialement isolé.
●Incidence triplée en 30ans
●Survie: 83,2% à 5ans en Europe, avec des disparités
selon les pays
●10 000nouveaux cas et 1 620décès en 2011 en France
●Mortalité stable voire en baisse chez la femme mais
pas chez l’homme
●Augmentation de l’incidence des mélanomes fi ns
●Stabilité de l’incidence des mélanomes épais
Encadré 1Encadré 1
●Homme âgé, célibataire, veuf ou séparé.
●Siège céphalique et membre inférieur.
●Mélanome de type acro-lentigineux ou nodulaire,
achromique.
●Diagnostic par le dermatologue mais aussi par le
médecin généraliste.
Encadré 2Encadré 2

Images en Dermatologie • Vol. VII • n
o
1 • janvier-février 2014
7
Figure. “C’est quoi ce truc qui pousse sur ma peau ?”, nouvelle
campagne de communication de dermato-info.fr, site grand public
de la Société française de dermatologie (© : DR).
Congrès-Réunion
Motiver les patients
“Demander à votre médecin d’examiner votre peau”
(fi gure)
.
Outils de dépistage du mélanome
pour le médecin généraliste
D’après le Pr Gaëlle Quéreux (dermatologue, CHU de Nantes)
Afi n de discriminer naevus et mélanome, dont les spectres
cliniques se recoupent, 2règles peuvent aider à la décision:
▶le vilain petit canard;
▶
la règle ABCDE, mais son application est liée à l’expérience
du médecin.
L’imprégnation visuelle photographique est aussi une méthode
d’apprentissage.
À qui proposer un dépistage cutané ?
Les facteurs de risque de mélanome, à l’échelle population-
nelle, sont connus. Cependant, un dépistage de masse n’est
pas envisageable dans le mélanome: peu effi cace et onéreux,
il ne serait pas “rentable”. Le risque individuel reste diffi cile à
évaluer, d’où l’idée d’établir des scores de risque afi n de cibler
la population à dépister.
Le SAMScore
(Self Assessment of Melanoma Risk Score)
est
un autoquestionnaire français, simple et validé, comportant
7 items, et disponible sur le site du Réseau Mélanome Ouest
(tableau)
.
Le pouvoir discriminant du SAMScore dans la sélection de
patients à risque de mélanome ou présentant un mélanome a été
évalué récemment dans une étude collaborative médecin géné-
raliste/dermatologue
(encadré 3)
[1]
. Parmi les 7 977patients
ayant rempli le SAMScore, 2 404 étaient considérés comme étant
“à haut risque”. Le médecin généraliste examinait alors leur
peau et les confi ait à un dermatologue. Dix mélanomes étaient
diagnostiqués, 2in situ et 8invasifs. Le SAMScore permet de
détecter un nouveau cas de mélanome en examinant 11fois
moins de patients qu’au sein d’une population non ciblée.
Tableau.
1J’ai plus de 20 grains de beauté sur l’ensemble des deux bras
(bras et avant bras)
2J’ai des taches de rousseur
3
Sachant qu’il existe 6 phototypes, je pense appartenir au
phototype I ou II
– Phototype I : peau très claire, cheveux blonds ou roux, yeux
clairs (bleus ou verts), incapacité de bronzer avec coups de
soleil constants après une exposition solaire
– Phototype II : peau claire, cheveux clairs ou châtains, yeux
clairs, coups de soleil fréquents
NB : si vous pensez être de phototype III, IV, V, ou VI, ne cochez
pas cette case.
4
Au cours de mon enfance ou de mon adolescence, j’ai déjà
pris des coups de soleil sévères (coups de soleil rouges et très
douloureux avec cloques, brûlures solaires)
5J’ai vécu plus d’un an dans un pays à fort ensoleillement (Afrique,
Moyen Orient, DOM-TOM, Sud des États-Unis, Australie…)
6
J’ai déjà eu au cours de ma vie un mélanome (également
appelé “grain de beauté cancéreux”, il s’agit d’un cancer de la
peau, qui touche les cellules responsables de la pigmentation)
7Un membre de ma famille proche (parent, enfant, frère ou
sœur) a déjà eu un mélanome
Sujet à risque = 3 facteurs de risque
●Le SAMScore est un outil français, validé et simple à
utiliser en médecine générale
(1)
.
●Il possède un haut pouvoir concentrateur, améliorant le
diagnostic de mélanome par un dépistage ciblé dans une
collaboration médecin généraliste/dermatologue.
●Un autre objectif devrait être poursuivi, celui de cibler
les mélanomes “tueurs” des hommes âgés et isolés.
Encadré 3
Encadré 3

Images en Dermatologie • Vol. VII • n
o
1 • janvier-février 2014
8
Congrès-Réunion
Dermoscopie et dermoscopie digitale:
pratiques, intérêts et limites
D’après le Pr Luc Thomas (dermatologue, CH Lyon-Sud)
Dermoscopie
De nombreuses études de niveau de preuve A ont été publiées
et plusieurs méta-analyses confi rment son intérêt :
▶sur l’acuité diagnostique;
▶sur la diminution du nombre d’exérèses inutiles.
Dermoscopie digitale
Les lésions bénignes n’évoluent pas, contrairement au méla-
nome (MM) ; la dermoscopie digitale donne une seconde chance
de diagnostiquer un MM, avec 2modalités de surveillance :
▶
surveillance à intervalles “longs” (6 à 12mois): modifi ca-
tions asymétriques; régression; nouvelles couleurs.
▶
Surveillance à intervalle “courts” (à 2 ou 3mois): ici, tous
les changements sont signifi catifs.
▶
Combinaison des 2: M0 puis M2-3 puis M12 (soit 9mois
après).
Les limites de la dermoscopie sont :
▶sa complexité, nécessitant un réel apprentissage;
▶ses exceptions: le visage, les paumes…
▶
mais, contrairement aux idées reçues, elle n’est pas chrono-
phage!
Une question demeure, celle de son impact en termes de santé
publique. En effet, cette technique permet une étude appro-
fondie des mélanomes à croissance lente, mais qu’en est-il
des mélanomes à croissance rapide ?
Et la dermoscopie en France ?
Quatre-vingt quatorze pour cent des dermatologues libéraux
l’utilisent. En centre hospitalier, la dermoscopie est plus uti-
lisée en centre général qu’en centre hyperspécialisé et ce,
d’autant plus que le praticien est jeune et en position hiérar-
chique basse !
En Australie, la dermoscopie est entre les mains de médecins
généralistes hyperspécialisés dans le diagnostic des tumeurs
cutanées.
Principes de la chirurgie carcinologique
cutanée et cas cliniques
D’après le Dr Jean-Michel Amici (dermatologue, Bordeaux)
Légitimité
La dermatologie chirurgicale est aujourd’hui offi ciellement
enseignée dans le cadre du DES. Sa pratique est encadrée
par la Haute Autorité de santé et par différentes recomman-
dations de bonne pratique. Le dermatologue a à sa disposition
différents moyens de se former (DIU, ouvrages, CDrom, etc.)
[encadré 5]
.
Biopsier avant d’enlever ?
La biopsie a bien sûr un intérêt diagnostique et médico-légal.
Elle est obligatoire sur le visage, si une reconstruction est
envisagée.
La biopsie, cependant, a ses limites : elle peut enlever en totalité
une lésion de petite taille, elle complique le repérage des limites
tumorales et peut être source d’erreur du site de reprise.
Cela incite à photographier la lésion avant de la biopsier,
surtout si on délègue l’acte chirurgical.
Selon le type tumoral
▶Carcinome basocellulaire
Le respect des symétries horizontales du visage est fonda-
mental pour obtenir un bon résultat fonctionnel (absence de
distorsion des orifi ces) et esthétique dans le cadre médian du
visage. Ce cadre se défi nit par 5lignes horizontales: tarso-
palpébrale inférieure, narinaire, commissurale, sourcilière,
implantation capillaire et 2lignes verticales passant à l’aplomb
des queues des sourcils
(3)
.
Un des principaux objectifs est de ne pas “rater” l’exérèse
initiale d’un carcinome basocellulaire (CBC), car la récidive
est souvent plus agressive. C’est alors la place des chirurgies
micrographiques (de 3 à 4% des tumeurs)
[4]
.
●Les lésions en relief ne doivent jamais être surveil-
lées mais enlevées.
●Chez un patient “à risque”, présentant plus d’une
centaine de naevi, il faut TOUT enregistrer, en particulier
ce qui est PETIT et réticulaire, afi n de dépister, au cours
de son évolution, un mélanome méconnu initialement.
Encadré 4Encadré 4
●Le dermatologue chirurgien est plus performant que
les autres spécialistes dans l’exérèse complète d’une
tumeur cutanée, car il sait “lire” une tumeur avant de
l’enlever
(2)
.
Encadré 5Encadré 5

Images en Dermatologie • Vol. VII • n
o
1 • janvier-février 2014
9
Congrès-Réunion
▶Carcinome épidermoïde cutané
Au visage, le carcinome épidermoïde cutané a un tropisme
particulier pour l’oreille et la lèvre; ses localisations sur le dos
de la main et des doigts, l’avant-bras ou la face antérieure des
jambes nécessitent des réparations particulières.
▶Mélanome
Le choix des réparations se simplifi e ici : exérèse suture simple
ou greffe, afi n de ne pas modifi er les repères et permettre la
surveillance ultérieure.
Le mélanome de Dubreuilh est plus problématique, le respect
d’une marge de 1 cm n’étant pas toujours possible sur le
visage; un examen exhaustif des marges est alors indiqué,
selon la technique du spaghetti, par exemple.
De nouveaux horizons thérapeutiques
pour les carcinomes basocellulaires
D’après le Pr Brigitte Dréno (dermatologue, CHU de Nantes)
Les CBC avancés ont une faible mortalité mais une morbidité
très élevée. Le vismodégib est indiqué dans les CBC avancés,
après discussion obligatoire en réunion de concertation pluri-
disciplinaire, ou dans les CBC métastatiques très rares et de
très mauvais pronostic.
La voie de signalisation hedgehog dite “hérisson” (PTCH1 et
SMO) est activée pendant la période embryonnaire, jouant un
rôle crucial dans le développement de l’individu, et elle est
normalement inhibée chez l’adulte. PTCH1, gène suppresseur,
inhibe l’activation de SMO, ce qui inhibe les gènes impliqués
dans la prolifération et la différenciation.
Dans le syndrome de Gorlin, PTCH1 est muté et SMO reste
activé avec :
▶des CBC chez l’adolescent;
▶des tumeurs bénignes associées;
▶des “pits” palmoplantaires;
▶
une dysmorphie faciale et des anomalies neurologiques
(médulloblastome).
Dans plus de 90% des CBC, il existe des anomalies génétiques
de PTCH1 ou SMO induisant une activation permanente de
la voie hedgehog. Il n’est donc pas nécessaire de rechercher
la mutation avant d’instaurer le traitement, contrairement au
mélanome, pour la mutation de BRAF.
Le vismodégib est le premier inhibiteur de SMO. Son effi cacité
(150mg/j per os) a été évaluée à 57% de réponses complètes
et partielles
(5)
.
Les effets indésirables sont nombreux, à type de crampes
(70%), alopécie (64%), dysgueusie (55%), perte de poids,
fatigue, nausée, perte d’appétit et diarrhée pouvant conduire
à l’arrêt du traitement.
L’équipe de B. Dréno a montré l’intérêt d’une prise en charge
nutritionnelle spécifi que comportant une évaluation de l’état
nutritionnel préthérapeutique, ainsi qu’une supplémentation
orale ou parentérale nocturne adaptée à l’intensité de la perte
de poids, avec une diminution des arrêts prématurés de trai-
tement.
Une alerte récente concerne l’émergence rapide de carcinomes
épidermoïdes cutanés chez un patient traité par vismodégib
(6)
.
Conclusion
Cette deuxième édition de la JACC s’est terminée par une
discussion autour de cas cliniques de :
▶
tumeurs rares à ne pas méconnaître (tumeur de Merckel,
angiosarcome de la tête et du cou, syndrome de Gorlin)
–DrT.Jouary, Pr B.Guillot et Pr L.Mortier;
▶
mélanomes métastatiques : choix des traitements de
1
re
et de 2
e
ligne en 2014 – Dr T. Lesimple, Pr C. Lebbé,
DrS.Dalac. ❙❙
L’auteur déclare ne pas avoir de liens d’intérêts.
Références bibliographiques
1.
Quéreux G, Nguyen JM, Cary M, Jumbou O, Lequeux Y, Dréno B. Valida-
tion of the self-assessment of melanoma risk Score for a melanoma-targeted
screening. Eur J Cancer Prev 2012;21(6):588-95.
2.
Bassas P, Hilari H, Bodet D, Serra M, Kennedy FE, García-Patos V. Evalua-
tion of surgical margins in basal cell carcinoma by surgical specialty. Actas
Dermosifi liogr 2013;104(2):133-40.
3.
Amici JM, Bailly JY, Taieb A. Horizontal stretching concept in oncologic
dermatologic surgery of the face. J Eur Acad Dermatol Venereol 2010;
24(3):308-16.
4.
Boulinguez S, Grison-Tabone C, Lamant L. Histological evolution of recur-
rent basal cell carcinoma and therapeutic implications for incompletely
excised lesions. Br J Dermatol 2004;151(3):623-6.
5.
Sekulic A, Migden MR, Oro AE et al. Effi cacy and safety of vismodegib in
advanced basal-cell carcinoma. N Engl J Med 2012;366(23):2171-9.
6.
Orouji A, Goerdt S, Utikal J, Leverkus M. Multiple highly and moderately
differentiated squamous cell carcinomas of the skin during vismodegib treat-
ment of inoperable basal cell carcinoma. Br J Dermatol 2014 Jan 21 [Epub
ahead of print].
1
/
4
100%