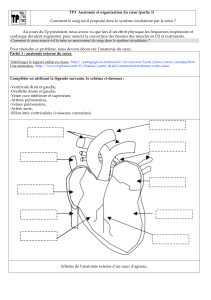
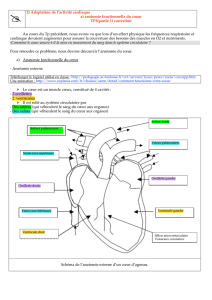
VOCABULAIRE

VOCABULAIREVOCABULAIRE
Correspondances en Onco-Hématologie - Vol. VII - n° 3 juillet-août-septembre 2012
VOCABULAIRE
Vocabulaire
Tasigna est indiqué chez l’adulte dans le traitement:
• de la leucémie myéloïde chronique (LMC) chromosome Philadelphie positive (Ph+) en phase chronique
nouvellement diagnostiquée,
• de la LMC chromosome Philadelphie positive (Ph+) en phase chronique et en phase accélérée,
résistants ou intolérants à un traitement antérieur incluant l’imatinib (uniquement pour lagélule à200mg).
Les données d’effi cacité chez les patients ayant une LMC en crise blastique ne sont pas disponibles.
TASIGNA
150mg– TASIGNA
200mg (nilotinib)gélule. DONNEES
CLINIQUES: Indications thérapeutiques: Tasigna
est indiqué chez l’adulte dans le traitement: -de la leucémie myéloïde
chronique (LMC) chromosome Philadelphie positive (Ph+) en phase chronique nouvellement
diagnostiquée,-de la LMC chromosome Philadelphie positive (Ph+) en phase chronique et en phase accélérée, résistants
ou intolérants à un traitement antérieur incluant l’imatinib (uniquement pour lagélule à 200mg). Les données d’effi cacité chez les patients ayant une LMC en crise blastique
ne sont pas disponibles. Posologie et mode d’administration*: Le traitement doit être instauré par un médecin expérimenté dans le diagnostic et le traitement de la LMC. La posologie recommandée de Tasigna est: -300mg 2fois
par j chez les patients atteints de LMC en PC nouvellement diagnostiquée. CTJ (4gélules à 150mg): 110,85€ (boîte de 28gélules); 106,45€ (boîte de 112gélules). -400mg 2fois par j chez les patients atteints de LMC en PC et PA.
CTJ (4gélules à 200mg) 145,84€ (boîte de 28gélules); 141,44€ (boîte de 112gélules). Le traitement doit être poursuivi aussi longtemps que le patient en tire un bénéfi ce. Adaptations ou modifi cations de la posologie: Adaptations
posologiques en cas de neutropénie et de thrombopénie cf. RCP complet. En cas de toxicité extra-hématologique modérée ou sévère cliniquement signifi cative, d’élévation des taux sériques de lipase de grade3 ou 4, d’élévation de
la bilirubine et des transaminases hépatiques de grade3 ou 4: cf. RCP complet. Utilisation en pédiatrie non recommandée. Chez les patients âgés de 65 ans et plus, aucune différence notable n’a été observée en termes de sécurité
et d’effi cacité par rapport aux adultes âgés de 18 à 65 ans. Comme le nilotinib et ses métabolites ne sont pas excrétés par voie rénale, une diminution de la clairance corporelle totale est peu probable chez les patients présentant
une insuffi sance rénale. La prudence est requise chez les patients atteints d’insuffi sance hépatique et d’affection cardiaque. ou à l’un des excipients. Mises en garde spéciales et précautions d’emploi*: Aplasie médullaire;
Allongement de l’intervalle QT; Mort subite; Interactions avec d’autres médicaments; Effets des aliments; Insuffi sance hépatique; Taux sériques de lipase; Gastrectomie totale; Syndrome de lyse tumorale; Lactosecf. RCP complet.
Interactions avec d’autres médicaments et autres formes d’interaction*: Substances susceptibles d’augmenter les concentrations plasmatiques de nilotinib; Substances susceptibles de diminuer les concentrations plasmatiques
de nilotinib; Substances dont les concentrations plasmatiques sont susceptibles d’être modifi ées par le nilotinib; Médicaments anti-arythmiques et autres substances susceptibles d’allonger l’intervalle QT; Autres interactions
susceptibles de modifi er les concentrations plasmatiques cf. RCP complet. Fécondité, grossesse et allaitement*; Effets sur l’aptitude à conduire des véhicules et à utiliser des machines*: cf. RCP complet. Effets indésirables*:
LMC nouvellement diagnostiquée en phase chronique: Effets indésirables extra-hématologiques les plus fréquents (≥ 10 %): éruption, prurit, céphalées, nausées, fatigue et myalgies. La plupart de ces effets indésirables étaient de
sévérité légère à modérée. Observation d’effets indésirables moins fréquents (<10 % et ≥ 5 %): douleurs abdominales supérieures, alopécie, constipation, diarrhées, asthénie, sécheresse cutanée, spasmes musculaires, arthralgies,
vomissements, douleurs abdominales, œdème périphérique, dyspepsie et douleurs aux extrémités, ces effets étaient de sévérité légère à modérée gérables et n’ont généralement pas nécessité une réduction de dose. 10% des
patients ont arrêté leur traitement en raison de ces effets indésirables. Les toxicités hématologiques induites par le traitement consistent en une myélosuppression: thrombopénie (18%), neutropénie (15%) et anémie (7%). Que la
relation de causalité ait été établie ou non des épanchements pleuraux et péricardiques ont été rapportés chez respectivement 1% et <1% des patients traités par Tasigna 300mg deuxfois par jour. Que la relation de causalité ait
été établie des hémorragies gastro-intestinales ont été rapportées chez 2,5% de ces patients. La variation moyennée de l’intervalle QTcF à l’état d’équilibre a été de 6ms. Aucun patient n’a présenté d’intervalle QTcF absolu >500ms
pendant le traitement à l’étude. Une augmentation de l’intervalle QTcF par rapport à l’état initial de plus de 60msec a été observée chez <1% des patients pendant le traitement à l’étude. Aucune mort subite et aucun épisode de
torsades de pointes (transitoires ou maintenues) n’a été observé. Aucune réduction de la fraction d’éjection ventriculaire gauche par rapport à l’état initial n’a été observée à aucun moment au cours du traitement. Aucun patient n’a
présenté une fraction d’éjection ventriculaire gauche <45% au cours du traitement ni de réduction en valeur absolue de la fraction d’éjection ventriculaire gauche de plus de 15%. LMC en phase chronique et en phase accélérée
en cas de résistance et d’intolérance à l’imatinib: Effets indésirables extra-hématologiques les plus fréquents (≥ 10 %)et associés au médicament: éruption, prurit, nausées, fatigue, céphalées, vomissements, myalgies, constipation
et diarrhées. La plupart de ces effets indésirables étaient de sévérité légère à modérée. Observation moins fréquente (<10 % et ≥ 5 %)des effets indésirables de sévérité légère à modérée (grade1 et 2) tels que alopécie, spasmes
musculaires, diminution de l’appétit, arthralgies, douleurs musculaires, douleurs osseuses, œdème périphérique, asthénie, douleurs abdominales supérieures, sécheresse cutanée, érythème et douleurs aux extrémités. 16% des
patients en PC et 10% des patients en PA ont arrêté leur traitement en raison de ces effets indésirables. Les toxicités hématologiques induites par le traitement consistent en une myélosuppression: thrombopénie (31%), neutropénie
(17%) et anémie (14%). Des épanchements pleuraux et péricardiques, ainsi que des complications d’une rétention hydrique, ont été rapportées chez <1% des patients traités par Tasigna. Une insuffi sance cardiaque a été observée
chez <1% des patients. Des hémorragies gastro-intestinales et du SNC ont été rapportées respectivement chez 1% et <1% des patients. Un allongement de l’intervalle QTcF >500ms a été observé chez <1% des patients.
Aucun épisode de torsades de pointe (transitoires ou persistantes) n’a été observé. Effets indésirables extra-hématologiques (à l’exception des anomalies biologiques) rapportées chez au moins 5% des patients lors d’études cliniques
menées avec Tasigna; effets indésirables rapportés à une fréquence inférieure à 5% lors des études cliniques menées avec Tasigna et effets très fréquents pour les anomalies biologiques; anomalies hématologiques ou biologiques
cliniquement pertinentes ou sévères cf. RCP complet. Mort subite: cas peu fréquents (0,1 à 1%) de mort subite rapportés chez des patients atteints de LMC en PC ou PA résistants ou intolérants à l’imatinib ayant des antécédents
de pathologie cardiaque ou des facteurs de risque cardiaques signifi catifs associés. Suivi post-commercialisation: rares cas de syndrome de lyse tumorale. Surdosage*: cf. RCP complet. PROPRIETES PHARMACOLOGIQUES*:
Propriétés pharmacodynamiques*: Groupe pharmacothérapeutique: Inhibiteurs de la protéine kinase, code ATC: L01XE08- Liste I- Médicament soumis à une prescription initiale hospitalière semestrielle. Prescription initiale
et renouvellement réservés aux spécialistes en oncologie ou en hématologie, ou aux médecins compétents en cancérologie. Médicament nécessitant une surveillance particulière pendant le traitement. Tasigna 150mg:
EU/1/07/422/005 (20.12.2010, révisée 28.06.2012); boîte de 28: CIP 34009 498158.4 5. Prix: 775,98€. Tasigna 150mg: EU/1/07/422/006 (20.12.2010, révisée 28.06.2012); boîte de 112: CIP 34009 498159.0 6. Prix:
2980,54€. Tasigna 200mg: EU/1/07/422/002 (19.11.2007, révisée 28.06.2012); boîte de 28: CIP 34009 216875 5 2. Prix: 1020,90€. Tasigna200mg: EU/1/07/422/004 (19.11.2007, révisée 28.06.2012); boîte de 112: CIP
34009 216876 1 3. Prix: 3960,25€. Remb. Séc. soc. à 100% - Agréé Collect- TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE: Novartis Europharm Limited- Royaume-Uni- Exploitant: Novartis Pharma S.A.S 2
et 4, rue Lionel Terray 92500 Rueil-Malmaison- Tél: 01.55.47.60.00- Information et Communication Médicales: Tél: 01.55.47.66.00 - [email protected]- FMI083-17
*Pour une information complète, consulter le texte intégral du résumé des caractéristiques du produit, soit sur le site internet
de l’ANSM si disponible, soit sur demande auprès du laboratoire.
- W5962 - Septembre 2012 - 12/06/63690098/PM/003
Viser la rémission moléculaire
W5962 Corresp. Onco 210x297 1 13/09/12 17:30
106
* © Le Courrier de la Transplantation 2008;1:8.
>>
ANTAGONISME* Par Alain Rey, directeur de la rédaction du Robert, Paris
C
e mot, ainsi qu’antagoniste, fait
partie du flot d’hellé nismes
passés en français au XVIe siècle,
époque durant laquelle se constitue le voca-
bulaire de l’anatomie et de la médecine.
Il exprime clairement l’opposition, par son
premier élément. Mais le second, que révèle
pourtant le mot agonie, n’était clair que pour
les connaisseurs du grec. Dans cette langue,
les composés antagônisma et antagônistês
transmettaient l’idée de lutte, de combat
entre deux éléments hostiles. Ils venaient
du verbe grec signifiant “combattre”, dont le
dérivé agônia, qui exprime à l’origine la vita-
lité des lutteurs, s’est spécialisé en français
à propos de la lutte, en général perdue, de
l’être vivant lorsqu’il résiste face à la venue
de l’“antagoniste” suprême, qui est la mort.
L’antagonisme, dans la langue ancienne, ne
retenait de l’idée originelle que celle d’op-
position dans l’espace et dans le fonction-
nement ; elle convenait à l’anatomie, où les
antagonismes d’organes, dans ce sens, sont
fréquents. On disait aussi antagonie, et les
deux formes étaient rares en français avant
le XVIIIe siècle.
Cent ans plus tard, le mot devient courant
et passe de l’anatomie à la médecine, où
il caractérise les effets contraires de deux
pathologies, puis à la chimie et à la bacté-
riologie. Il ne s’agit plus alors d’opposition
spatiale, mais fonctionnelle, et l’idée grecque
de lutte réapparaît.
Le mot n’est plus seulement scientifique,
et on peut parler d’antagonismes à propos
d’intérêts, de convictions, d’idées en oppo-
sition et en conflit.
En fait, tout ce qui est le siège d’oppositions
peut relever de l’antagonisme : les incompa-
tibilités, les rejets, les refus se manifestent
dans tout processus naturel, et en particulier
dans les processus vitaux. L’antagonisme
était conçu pour exprimer une notion fonda-
mentale, à explorer et à décrire pour pouvoir
en combattre les effets. Encore une agoniâ,
une lutte, mais, cette fois, contre la mort.
1
/
1
100%