R e c h e r c h e

Le Courrier de la Transplantation - Volume I - n o3 - oct.-nov.-déc. 2001
!Y. Hamel1, I. André-Schmutz1, 2,
D. Bonhomme1, M. Cavazzana-Calvo1, 2
Recherche
a transplantation médullaire allogé-
nique et la transplantation d’organes
solides, bien que largement utilisées, res-
tent des procédés lourds par la morbidité
et la mortalité qui leur sont associées (1).
Dans le cas particulier de la greffe de
moelle osseuse allogénique, malgré une
reconstitution hématologique relative-
ment rapide, le risque d’infections oppor-
tunistes persiste plusieurs mois jusqu’à
ce qu’un système immunitaire compétent
se mette en place (2). Les infections
opportunistes observées diffèrent selon
le type de greffe et l’âge des patients. Les
infections virales les plus fréquentes au
cours de cette période de déficit immu-
nitaire sont dues essentiellement aux
herpèsvirus (cytomégalovirus [CMV],
herpès-varicella zooster, virus d’Epstein-
Barr [EBV]) et à l’adénovirus (3, 4). Le
CMV, l’EBV et l’adénovirus humain sont
responsables d’infections bénignes mais
persistantes chez les individus immuno-
compétents, impliquant une balance
extrêmement fine entre la surveillance
immunologique et la mise en place de
stratégies virales pour y échapper. Les
cellules T cytotoxiques jouent un rôle
majeur dans la défense contre ces infec-
tions virales. Le but de cet article est
d’essayer de faire le point sur de nou-
velles stratégies thérapeutiques basées
sur l’immunothérapie adoptive. En effet,
la mise au point de ces nouvelles straté-
gies pourrait avoir un potentiel thérapeu-
tique pour tous les patients soumis à une
immunosuppression importante et de
longue durée. Si cette approche s’avérait
efficace, on pourrait imaginer, dans un
futur plus lointain, de l’utiliser également
pour les patients atteints de cancers
induits par des virus.
QUELQUES NOTIONS DE VIROLOGIE
Virus d’Epstein-Barr
Ce virus est un virus ubiquitaire apparte-
nant à la famille des Herpesviridae,
capable de transformer et d’immortaliser
in vitro les lymphocytes B d’un sujet sain.
La primo-infection par ce virus peut être
responsable d’une infection aiguë symp-
tomatique (mononucléose infectieuse),
mais elle est asymptomatique dans la plu-
part des cas. Après la primo-infection, ce
virus persiste dans les lymphocytes B sous
une forme latente non réplicative durant
toute la vie de l’individu. Au contraire,
l’infection par ce virus des cellules épi-
théliales de l’oropharynx entraîne une
production de virions responsables de la
transmission horizontale du virus par l’in-
termédiaire de la salive. Les lymphocytes
B infectés par l’EBV expriment les huit
antigènes du cycle latent : les antigènes
nucléaires EBNA (EBV nuclear antigens)
1, 2, 3A, 3B, 3C, la protéine leader (LP)
et les deux protéines LMP (latent mem-
brane proteins) (5). Chez un individu
immunocompétent, l’infection latente est
sous le contrôle des lymphocytes T cyto-
toxiques spécifiques de l’EBV, qui sont
détectables à une fréquence de l’ordre de
1/1 000 cellules T circulantes et peuvent
êtres réactivés in vitro par stimulation à
l’aide d’une lignée lymphoblastoïde B
autologue. L’activité cytotoxique (CTL)
est préférentiellement dirigée contre les
antigènes nucléaires EBNA 3A, 3B et 3C
(6). Plus récemment, il a été décrit une
activité cytotoxique mémoire contre les
antigènes du cycle réplicatif. La réponse
humorale ne joue qu’un rôle mineur dans
le contrôle de la phase latente de l’EBV,
alors que les lymphocytes T cytotoxiques,
au contraire, semblent jouer un rôle essen-
tiel. En effet, le sujet porteur d’un déficit
de l’immunité cellulaire présente un
risque élevé de développer des proliféra-
tions non contrôlées des lymphocytes B
infectés par l’EBV (7). Elles sont poly-
clonales dans un premier temps, mais peu-
vent évoluer vers une prolifération mono-
clonale de pronostic très péjoratif. Ces
lymphoproliférations induites par l’EBV
se présentent le plus souvent sous forme
de lymphomes diffus à grandes cellules B,
qui peuvent être oligoclonaux ou mono-
clonaux. Dans plus de 80 % des cas, ces
lymphoproliférations se développent à
partir des cellules B du donneur chez les
transplantés de moelle osseuse. Au
1INSERM U429, hôpital Necker-Enfants malades,
75743 Paris Cedex 15.
2Laboratoire de thérapie cellulaire et génique,
hôpital Necker-Enfants malades AP-HP, 75743 Paris
Cedex 15.
L
Immunothérapie adoptive antivirale
en transplantation
RÉSUMÉ.
La transplantation médullaire et la transplantation d’organes sont des procédures thérapeutiques largement utilisées
pour traiter des affections héréditaires ou acquises. La prévention du rejet et l’induction de la tolérance sont dépendantes de l’uti-
lisation d’une immunosuppression non spécifique et de longue durée, qui entraîne un certain nombre de complications, notam-
ment infectieuses. Les herpèsvirus et l’adénovirus sont les agents infectieux responsables des complications virales sévères,
surtout après greffe de cellules souches allogéniques. Les principales caractéristiques biologiques de ces virus seront rappelées
avant de faire le point sur de nouvelles approches thérapeutiques basées sur l’injection intraveineuse des clones T antiviraux.
Mots-clés :
Greffe de moelle - CMV - EBV - Adénovirus.
115

contraire, chez les transplantés d’organes,
elles se développent le plus souvent à par-
tir des lymphocytes B du receveur. L’EBV
sous sa forme épisomale est détecté dans
plus de 90 % des lymphoproliférations
(8). Le risque de développer ces lympho-
proliférations est directement lié à l’ab-
sence d’une réponse cellulaire T spécifi-
quement dirigée contre l’EBV. En effet,
en présence d’un défaut de l’immunité
cellulaire, la susceptibilité à développer
une lymphoprolifération EBV est extrê-
mement augmentée.
Adénovirus
Il existe environ cinquante sérotypes
d’adénovirus humains, divisés en six
familles sur la base de leurs caractéris-
tiques immunologiques, moléculaires et
fonctionnelles. Les adénovirus sont des
virus contenant un génome à double brin
d’ADN linéaire d’environ 35 Kb. L’adé-
novirus se lie à un récepteur cellulaire
dont l’identité n’est pas connue, et est
intégré après liaison avec une protéine
secondaire récemment identifiée, le
récepteur de la vitronectine. Ce virus est
intégré dans le lisosome, et le corps
viral ainsi libéré migre dans le noyau, où
la transcription de l’adénovirus peut com-
mencer (9). La plus grande partie de la
population adulte (plus de 45 %) présente
des anticorps sériques contre de nom-
breux sérotypes des adénovirus et déve-
loppe une immunité anti-adénovirus qui
perdure toute la vie (10). Ce virus reste
dans l’organisme sous forme latente. Les
infections induites par l’adénovirus sont
rarement graves chez les enfants et les
adultes sains, mais peuvent être sévères
et compromettre le pronostic vital des
individus immunodéprimés (11). Le rôle
de l’adénovirus dans les infections après
greffe est sous-estimé. L’association
entre infections sévères adénovirales et
immunodéficience de type cellulaire sug-
gère que l’adénovirus est normalement
contrôlé par la réponse immunitaire cel-
lulaire (12). Il n’existe pas à l’heure
actuelle de médicament efficace contre
les infections par adénovirus. Bien que la
réponse immunitaire cellulaire contre
l’adénovirus soit peu connue, il est pos-
sible que les transferts adoptifs d’une
réponse cellulaire puissent contrôler l’in-
fection, chez les sujets immunodéprimés
(13). Actuellement, il est acquis que les
sujets normaux séropositifs développent
une réponse mémoire contre ce virus, et
que les protéines de capside viral peuvent
stimuler la prolifération des cellules
mononucléées périphériques (14).
Les cellules natural killer ne jouent
pas un rôle déterminant dans l’élimina-
tion des cellules humaines infectées
par l’adénovirus. La reconnaissance de
l’antigène capsidique peut amener à la
cytolyse rapide des cellules infectées sans
besoin d’assemblage des virions comme
pour d’autres virus humains à ADN.
Les infections adénovirales se dévelop-
pent chez les enfants au cours des
30 premiers jours qui suivent la greffe, et
de manière plus fréquente que chez
l’adulte. La raison de cette différence est
mal comprise.
Cytomégalovirus (CMV)
L’histoire naturelle de l’infection à CMV
a fait l’objet de nombreuses études. Après
une infection primaire, le sujet immuno-
compétent développe une pathologie
modeste ou subclinique, et le virus rentre
dans une phase latente. Bien que le sujet
sain (CMV séropositif) ne présente aucun
signe d’infection active, la fréquence de
précurseurs cytotoxiques spécifiques pour
le CMV reste très élevée, entre 1/5 000 et
1/20 000 des lymphocytes T du sang péri-
phérique. Cette fréquence persiste tout au
long de la vie, suggérant ainsi que la
réponse T, et plus particulièrement CD8+,
joue un rôle actif dans la protection de
l’hôte vis-à-vis d’une réactivation virale.
Contrairement à l’adénovirus, nous dis-
posons aujourd’hui de différents médica-
ments capables de prévenir et de traiter
cette infection, mais ils présentent de nom-
breux effets néfastes sur la reconstitution
hématologique à partir du greffon médul-
laire transplanté (15),comme la résistance
médicamenteuse qui peut se développer.
Développement des immunothérapies
adoptives
La mise en évidence du contrôle de ces
infections virales par des effecteurs cellu-
laires a incité deux équipes pionnières à
développer des stratégies d’amplification
de ces cellules T in vitro pour les utiliser
spécifiquement dans la période prégreffe.
L’équipe de Greenberg (États-Unis) a mis
au point dans les années 1992-1995 (16)
une technologie qui a le mérite d’avoir
apporté la preuve de l’efficacité du trans-
fert adoptif des lymphocytes T spécifiques
contre un virus. La stratégie utilisée consis-
tait à prélever à l’aide d’une biopsie cuta-
née les fibroblastes du donneur et à les
infecter avec une souche de laboratoire du
CMV-AD169. Une coculture était ensuite
réalisée entre les fibroblastes du donneur
et les lymphocytes CD8+ du sang péri-
phérique après élimination des lympho-
cytes CD4+. Après trois semaines de
coculture, les lymphocytes T CD8 ampli-
fiés étaient capables, dans des tests de cyto-
toxicité in vitro, de tuer d’une façon spé-
cifique une cible autologue infectée par le
CMV (17). Des patients greffés avec une
moelle osseuse T déplétée ont reçu quatre
injections hebdomadaires croissantes de
3,3 à 100 x 107CTL spécifique. Ce proto-
cole a démontré que la survie des cellules
CD8 injectées était conditionnée par la pré-
sence des cellules CD4. En effet, tous les
malades inclus dans ce protocole ont mon-
tré une protection contre l’infection CMV
de durée variable selon la rapidité de déve-
loppement d’une réponse CD4. Aucune
toxicité précoce ou tardive n’a été obser-
vée. Le second essai clinique, pionnier
dans ce domaine, est l’essai développé par
Rooney et Brenner (États-Unis) dans les
années 1994-1998 (18). Leur essai avait
pour but de prévenir la survenue des lym-
phoproliférations B-EBV induites. La pro-
cédure était un peu différente de celle rap-
portée plus haut. Les lymphocytes B du
donneur étaient transformés in vitro en pré-
sence d’une souche de laboratoire d’EBV.
Une coculture était ensuite réalisée entre
les lymphocytes B transformés par l’EBV
et les cellules mononucléées du même don-
neur. Les CTL anti-EBV obtenus ont été
injectés au nombre de 2 x 107CTL/m2aux
patients présentant une PCR-EBV positive,
supérieure au seuil de 3 000 copies du
génome viral pour 150 000 cellules mono-
nucléées du sang périphérique qui avait été
fixé au préalable. Aucun des 39 patients
traités n’a développé de lymphomes
d’EBV et, pour tous, une diminution signi-
ficative de la charge virale a été documen-
tée. Pour deux patients traités au moment
Le Courrier de la Transplantation - Volume I - n o3 - oct.-nov.-déc. 2001
116
Recherche

Le Courrier de la Transplantation - Volume I - n o3 - oct.-nov.-déc. 2001
117
Recherche
où ils développaient un lymphome EBV,
une disparition complète des cellules tumo-
rales a été observée. Les limites de ces deux
stratégies résident dans le temps nécessaire
pour produire la cellule présentatrice d’an-
tigène et dans la lourdeur de ces procé-
dures. En effet, les patients immunodépri-
més développent fréquemment plusieurs
infections virales à la fois, et ce dans un
laps de temps très court. Cependant, nous
aurions besoin de techniques opération-
nelles à court terme. La caractérisation et
le développement des cellules dendritiques
à partir de monocytes du sang ont ouvert
les possibilités d’une utilisation plus large
de l’immunothérapie adoptive et de l’ob-
tention de clones polyspécifiques antivi-
raux ou antitumoraux. Le principe de cette
approche est basé sur la génération des
cellules dendritiques autologues au don-
neur et de leur infection avec des virus
recombinants non réplicatifs, capables de
coder pour les protéines immunodomi-
nantes de plusieurs virus à la fois. Les
cellules dendritiques sont ensuite cultivées,
pendant deux à trois semaines, avec les
cellules mononucléées du même donneur.
Les lymphocytes T ainsi activés sont
capables de tuer très rapidement une
cellule infectée avec le même agent
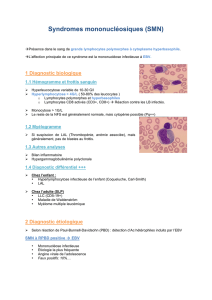
pathogène (figure 1).
Cette technique pourrait être encore sim-
plifiée grâce au tri des seules cellules acti-
vées (19), ou bien grâce à l’utilisation des
tétramères spécifiques (20). Le transfert
adoptif de ces clones T spécifiques pour-
rait demain réduire fortement les com-
plications virales après greffe. "
RÉFÉRENCES
BIBLIOGRAPHIQUES
1. Fishman JA, Rubin RH. Infection in organ-
transplant recipients. N Engl J Med 1998 ; 338, 24 :
1741-51.
2. Cavazzana-Calvo M, Durandy A, Le Deist F.
Antiviral immunodeficiency : EBV, CMV, adenovirus.
Hematol Cell Ther 1997 ; 39, 5 : 269-73.
3. Maltezou HC, Kafetzis DA, Abisaid D,
Mantzouranis EC, Chan KW, Rolston KV. Viral infec-
tions in children undergoing hematopoietic stem cell
transplant. Pediatr Infect Dis J 2000 ; 19, 4 : 307-12.
4. Hale GA, Heslop HE, Krance RA et al.
Adenovirus infection after pediatric bone marrow
transplantation. Bone Marrow Transplant 1999 ; 23,
3:277-82.
5. Rickinson AB, Moss DJ. Human cytotoxic T lym-
phocyte responses to Epstein-Barr virus infection.
Ann Rev Immunol 1997 ; 15 : 405-31.
6. Murray RJ, Kurilla MG, Brooks JM et al.
Identification of target antigens for the human cyto-
toxic T cell response to Epstein-Barr virus (EBV) :
implications for the immune control of EBV-positive
malignancies. J Exp Med 1992 ; 176, 1 : 157-68.
7. Lucas KG, Small TN, Heller G, Dupont B,
O’Reilly RJ. The development of cellular immunity to
Epstein-Barr virus after allogeneic bone marrow
transplantation. Blood 1996 ; 87, 6 : 2594-603.
8. Gross TG, Steinbuch M, DeFor T et al. B cell
lymphoproliferative disorders following hematopoietic
stem cell transplantation : risk factors, treatment and
outcome. Bone Marrow Transplant 1999 ; 23, 3 : 251-8.
9. Smith CA, Woodruff LS, Kitchingman GR, Rooney
CM. Adenovirus-pulsed dendritic cells stimulate
human virus-specific T-cell responses in vitro. J Virol
1996 ; 70, 10 : 6733-40.
10. Wold WS, Doronin K, Toth K, Kuppuswamy M,
Lichtenstein DL, Tollefson AE. Immune responses to
adenoviruses : viral evasion mechanisms and their
implications for the clinic. Curr Opin Immunol
1999 ; 11, 4 : 380-6.
11. Chakrabarti S, Collingham KE, Fegan CD,
Pillay D, Milligan DW. Adenovirus infections follo-
wing haematopoietic cell transplantation : is there a
role for adoptive immunotherapy ? Bone Marrow
Transplant 2000 ; 26, 3 : 305-7.
12.Chakrabarti S, Collingham KE, Marshall T et al.
Respiratory virus infections in adult T cell-depleted
transplant recipients : the role of cellular immunity.
Transplantation 2001 ; 72, 8 : 1460-3.
13. Hromas R, Cornetta K, Srour E, Blanke C,
Broun ER. Donor leukocyte infusion as therapy of
life-threatening adenoviral infections after T-cell-
depleted bone marrow transplantation [letter].
Blood 1994 ; 84, 5 : 1689-90.
14. Flomenberg P, Piaskowski V, Truitt RL, Casper
JT. Characterization of human proliferative T cell res-
ponses to adenovirus [see comments]. J Infect Dis
1995 ; 171, 5 : 1090-6.
15. Salzberger B, Bowden RA, Hackman RC,
Davis C, Boeckh M. Neutropenia in allogeneic mar-
row transplant recipients receiving ganciclovir for
prevention of cytomegalovirus disease : risk factors
and outcome. Blood 1997 ; 90, 6 : 2502-8.
16. Riddell SR, Watanabe KS, Goodrich JM, Li CR,
Agha ME, Greenberg PD. Restoration of viral immu-
nity in immunodeficient humans by the adoptive
transfer of T cell clones. Science 1992 ; 257, 5067 :
238-41.
17. Walter EA, Greenberg PD, Gilbert MJ et al.
Reconstitution of cellular immunity against cytome-
galovirus in recipients of allogeneic bone marrow by
transfer of T-cell clones from the donor. N Engl J
Med 1995 ; 333, 16 : 1038-44.
18. Rooney CM, Smith CA, Ng CY et al. Infusion of
cytotoxic T cells for the prevention and treatment of
Epstein-Barr virus-induced lymphoma in allogeneic
transplant recipients. Blood 1998 ; 92, 5 : 1549-55.
19. Ibisch C, Saulquin X, Gallot G et al. The T cell
repertoire selected in vitro against EBV : diversity,
specificity, and improved purification through early
IL-2 receptor alpha-chain (CD25)-positive selection.
J Immunol 2000 ; 164, 9 : 4924-32.
20.Yee C, Savage PA, Lee PP, Davis MM, Greenberg
PD. Isolation of high avidity melanoma-reactive CTL
from heterogeneous populations using peptide-MHC
tetramers. J Immunol 1999 ; 162, 4 : 2227-34.
Figure 1. Les cellules dendritiques immatures dérivées de monocytes sont infectées par
des adénovirus recombinants pour des antigènes immunodominants du CMV et de l’EBV. Les
cellules dendritiques infectées sont activées en présence de TNFαet cultivées pendant deux à
trois semaines avec les lymphocytes T autologues du donneur.
1
/
3
100%