AvanCées JUIN 2016

JUIN 2016
> myasthenia gravis
> myasthénie acquise
> myasthénie oculaire
> myasthénie généralisée
La myasthénie auto-immune est une maladie rare. Elle se
manifeste par une faiblesse musculaire d’intensité et de
durée variable pouvant toucher n’importe quel muscle.
Cette faiblesse musculaire fluctuante s’accompagne
fréquemment d’anomalies du thymus, sous forme
d’hyperplasie chez le sujet jeune ou de thymome chez le
sujet âgé.
Ce document, publié à l’occasion des Journées des
Familles 2016 de l’AFM-Téléthon, présente les actualités
de la recherche dans la myasthénie auto-immune :
colloques internationaux, études ou essais cliniques en
cours, publications scientifiques et médicales...
Il est téléchargeable sur le site internet AFM-Téléthon où
se trouvent aussi d’autres informations concernant les
domaines scientifiques, médicaux, psychologiques,
sociaux ou techniques sur la myasthénie auto-immune :
WEB www.afm-telethon.fr > Concerné par la maladie > Myasthénie
auto-immune
AvanCées
dans la
myasthénie
auto-immune

Avancées dans la myasthénie auto-immune
2 ǀ AFMTéléthon ǀ Juin 2016
Savoir & Comprendre
Sommaire
Des évènements médico-scientifiques................................................ 7
Des études cliniques ............................................................................. 7
Des bases de données .................................................................................................. 7
Étude FIGHT-MG ............................................................................................................. 8
Des essais cliniques ............................................................................... 9
Optimiser le traitement de la myasthénie auto-immune ................................ 9
Évaluer l’efficacité de la thymectomie ....................................................................... 9
Essai MYACOR ..................................................................................................................... 9
Le méthotréxate .............................................................................................................. 10
Le belimumab .................................................................................................................. 10
Le tacrolimus .................................................................................................................... 10
Essai Myastérix ................................................................................................................. 10
L’exercice ............................................................................................................................ 11
Développer des traitements dans les myasthénies réfractaires ................. 11
Le rituximab ...................................................................................................................... 11
L’eculizumab ..................................................................................................................... 12
Le bortezomib .................................................................................................................. 12
La thérapie cellulaire dans la myasthénie généralisée .................................. 13
Efficacité d’une thérapie cellulaire par greffe de cellules souches
hématopoïétique ............................................................................................................ 13
Un essai de thérapie cellulaire en cours ................................................................ 13
Développer des traitements dans la myasthénie oculaire ........................... 14
D’autres avancées médico-scientifiques ........................................... 14
Des outils pour la recherche .................................................................................... 14
Un modèle de souris pour la myasthénie à anticorps anti-MuSK ............... 14
Un modèle de myasthénie avec des anomalies du thymus .......................... 15
Sur la piste des éventuelles causes virales de la myasthénie ...................... 15
Des traces d’infection par le virus d’Epstein-Barr .............................................. 15
Des traces d’infection par le virus du Nil occidental ........................................ 16
L’hypothèse d’un rôle des hormones dans la myasthénie et les maladies
autoimmunes se confirme ........................................................................................ 16
Des méthodes de détection des auto-anticorps plus sensibles ................ 16
Facteurs prédictifs de l’évolution d’une myasthénie oculaire vers une
myasthénie généralisée ............................................................................................. 17
*
* *
Rédaction
Myoinfo,
Département d'information sur
les maladies neuromusculaires
de l'AFM-Téléthon, Évry
Validation
S. Berrih-Aknin
UPMC UM76 – INSERM U974 –
CNRS UMR 7215, Institut de
Myologie Hôpital La Pitié-
Salpêtrière, Paris

Avancées dans la myasthénie auto-immune
3 ǀ AFMTéléthon ǀ Juin 2016
Savoir & Comprendre
La myasthénie auto-immune est une maladie rare qui touche environ 10
personnes sur 100 000.
Elle apparaît souvent entre 20 et 40 ans, le plus souvent chez les femmes
(60% des cas). Après 40 ans, la répartition homme/femme tend à
s'inverser. Depuis plusieurs années, le nombre de personnes âgées de plus
de 60 ans chez qui on fait le diagnostic de myasthénie a augmenté,
surtout chez les hommes.
Elle se manifeste de façon très différente d'une personne à l'autre
(myasthénie oculaire, myasthénie généralisée, formes avec auto-anticorps
anti-récepteur de l'acétylcholine, formes avec anticorps auto-anti-
récepteur tyrosine kinase musculaire, formes avec auto-anticorps anti-
LRP4...) et peut fluctuer dans le temps pour un même individu.
▪ La myasthénie auto-immune est caractérisée par une faiblesse
musculaire fluctuante qui s'accompagne souvent d'anomalies du thymus
(hyperplasie chez le sujet jeune ou thymome chez le sujet âgé).
Le thymus est une glande située dans le thorax derrière le sternum. Son
activité et sa taille sont maximales jusqu'à la puberté, avant de diminuer à
l'âge adulte. Son rôle est de rendre certaines cellules du système
immunitaire, les lymphocytes T, aptes à distinguer ce qui appartient à
l'organisme (le "soi") de ce qui provient de l'environnement (le "non-soi")
et à reconnaître spécifiquement les différents agents pathogènes (virus,
microbes, bactéries...).
▪ La myasthénie auto-immune est une maladie neuromusculaire due à un
dysfonctionnement du système immunitaire, qui entraîne une réaction
immunitaire dirigée contre des constituants de l'interface entre le nerf et
le muscle, c’est-à-dire la jonction neuromusculaire, aboutissant à un
défaut de transmission de l'influx nerveux.
Les lymphocytes T ne reconnaissent pas comme des constituants de
l'organisme des éléments de la jonction neuromusculaire que sont les
récepteurs de l'acétylcholine (RACh), les récepteurs musculaires de la
tyrosine-kinase (MuSK), ou encore les récepteurs LRP4.
Cela déclenche une réaction auto-immune dans laquelle les lymphocytes T
provoquent la production par les lymphocytes B d'auto-anticorps anti-
récepteurs de l'acétylcholine (anti-RACh), d'auto-anticorps anti-MuSK ou
encore d’auto-anticorps anti-LRP4.
Ces auto-anticorps en se fixant sur les RACh, les récepteurs MuSK ou les
protéines LRP4 entrainent respectivement la destruction des RACh, des
récepteurs MuSK ou des protéines LRP4.
▪ Plus de 85% des personnes atteintes de myasthénie fabriquent des auto-
anticorps dirigés contre le récepteur de l’acétylcholine (auto-anticorps
anti-RACh). En se fixant sur ces récepteurs, les auto-anticorps bloquent le
fonctionnement de ceux-ci ou provoquent leur destruction.
L'acétylcholine ne peut alors plus se fixer sur son récepteur et la
transmission de l'influx nerveux vers le muscle s'effectue mal : le muscle se
contracte moins bien et se fatigue. Il s'en suit une faiblesse musculaire
d'intensité et de durée variables, qui peut toucher n'importe quel muscle
et qui augmente à l'exercice.
Une maladie est dite rare quand
elle touche moins d'une personne
sur 2 000. Les maladies rares font
l'objet d'une politique de santé
publique commune dans les
domaines de la recherche, de
l'information et de la prise en
charge.
Les auto-anticorps sont des
anticorps qui réagissent contre
des éléments de son propre
organisme, comme le muscle.
La jonction neuromusculaire
est la zone de communication
entre le nerf par qui le signal de
contraction (influx nerveux) arrive
et le muscle qui se contracte sous
l'impulsion de l'influx nerveux.
Les anticorps sont des protéines
complexes impliquées dans
l'immunité, dont le rôle est de
reconnaître spécifiquement un
élément étranger à l'organisme
afin qu'il soit détruit par le
système immunitaire. Ils
appartiennent à la famille des
immunoglobulines (Ig) dont il
existe cinq grands types : IgA,
IgD, IgE, IgG, IgM. Les IgG sont les
plus fréquentes de notre
organisme.
Les lymphocytes T sont des
globules blancs spécialisés dans
certains types de réponses
immunitaires. Il existe plusieurs
types de lymphocytes T chacun
assurant une fonction spécifique.
Les lymphocytes B sont des
globules blancs spécialisés dans
un autre type de réaction
immunitaire : ils produisent les
anticorps qui neutralisent des
substances ou des molécules
considérées comme étrangères
par l'organisme.

Avancées dans la myasthénie auto-immune
4 ǀ AFMTéléthon ǀ Juin 2016
Savoir & Comprendre
▪ Parmi les malades présentant une forme généralisée sans auto-anticorps
anti-RACh, environ 40% présentent des auto-anticorps contre le récepteur
tyrosine-kinase spécifique du muscle (auto-anticorps anti-MuSK). Le
récepteur MuSK joue un rôle important dans le développement et la
stabilité de la jonction neuromusculaire, en particulier dans le
déclenchement du regroupement des récepteurs de l'acétylcholine lors de
la formation de la jonction neuromusculaire.
▪ Environ 20% des patients chez qui on ne retrouve ni auto-anticorps anti-
RACh, ni auto-anticorps anti-MuSK, présentent des auto-anticorps contre
la protéine LRP4 (low-density lipoprotein (LDL) receptor-related protein 4),
un récepteur de l’agrine au niveau de la jonction neuromusculaire. En se
fixant sur son récepteur LRP4, l'agrine contribue au maintien du
regroupement des RACh sous la terminaison nerveuse.
Le rôle pathogénique des auto-anticorps anti-MuSK ou anti-LRP4 dans la
myasthénie autoimmune s’expliquerait par l’inhibition du regroupement
des récepteurs de l’acétylcholine au niveau de la jonction neuromusculaire.
▪ Le pourcentage de personnes atteintes de myasthénie qui n'ont ni auto-
anticorps anti-RACh, ni auto-anticorps anti-MuSK, ni auto-anticorps anti-
LRP4 est de l’ordre de 2 à 5%.
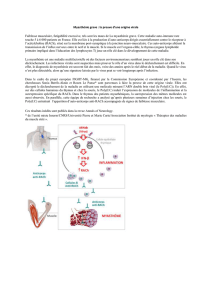
Mécanismes auto-immuns conduisant à la myasthénie

Avancées dans la myasthénie auto-immune
5 ǀ AFMTéléthon ǀ Juin 2016
Savoir & Comprendre
Les traitements actuels de la myasthénie auto-immune reposent sur les
connaissances acquises sur le fonctionnement de la jonction
La transmission synaptique à la jonction neuromusculaire
Le mouvement volontaire est déclenché par un influx nerveux qui chemine le long des nerfs et arrive au niveau de la
jonction entre le nerf et le muscle.
1 : Dans la terminaison axonale du nerf (élément pré-synaptique), le neurotransmetteur acétylcholine est stocké dans des
vésicules synaptiques.
2 : L’arrivée de l’influx nerveux à la terminaison nerveuse entraîne la fusion des vésicules avec la membrane pré-
synaptique.
3 : Les vésicules libèrent l’acétylcholine dans la fente synaptique.
4 : Les molécules d’acétylcholine libérées vont se fixer sur la membrane de la cellule musculaire (membrane post-
synaptique) au niveau des récepteurs de l'acétylcholine.
5 : Cette fixation entraîne un passage d’ions à travers la membrane de la fibre musculaire, qui par une cascade de
réactions chimiques aboutit à la contraction des myofibrilles et donc de la fibre musculaire.
5’ : Dans le même temps, les molécules d’acétylcholine présentes dans la fente synaptique sont soit recapturées par la
membrane pré-synaptique, soit détruites par l’acétylcholinestérase.
La machinerie de la transmission synaptique est alors prête à un nouveau cycle de transmission synaptique.
5'
1
2
3
4
5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
1
/
18
100%