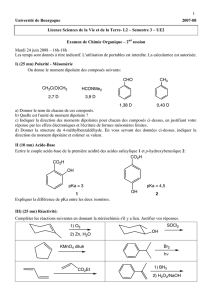
L`Extraction en discontinu

1
L’Extraction en discontinu
PRINCIPE
On se base sur le fait que:
1. Les produits acides (acides carboxyliques / Phénols) réagissent avec les bases (NaOH
ou NaHCO3 par exemple ) pour donner des sels généralement solubles dans l’eau et
insolubles dans de nombreux solvants organiques (en général ceux qui sont insolubles
dans l’eau)
2. Les bases organiques (amines) réagissent avec les acides pour donner des sels (en
particulier avec les acides halohydriques on obtient des halohydrates d'ammonium).
Ces sels sont généralement solubles dans l'eau et insolubles dans de nombreux
solvants organiques.
3. Les composés ne présentant pas de propriétés acides ou basiques, dits « neutres », ne
réagissent généralement pas, dans les conditions opératoires de l'extraction, avec les
acides et les bases minérales. De plus ils sont généralement plus solubles dans les
solvants organiques que dans l'eau.
PRINCIPE DU MODE OPERATOIRE
A partir d’un mélange acide (AH) + base (B) + produit neutre (N), on souhaite séparer ces
trois produits.
Le mélange est mis en solution dans un solvant organique non miscible à l'eau
On extrait:
L’acide par une solution aqueuse basique.
La base par une solution aqueuse acide.
Le produit neutre reste seul dans le solvant organique.
L'acide est ensuite régénéré de son sel par addition (à froid) d'une solution acide minéral puis
est extrait de l'eau par un solvant organique.
La base est régénérée de son sel par addition (à froid) d'une solution basique puis est extraite
de l'eau.
+H2O
+NaOH
CO2
+
H2O
+
RCO2Na
NaHCO3
+
RCO2H
H2O
+
RCO2NaNaOH
+
RCO2H
OH ONa
RNH2+HCl RNH3+Cl-
+

2
Remarques importantes :
1. On peut également séparer des composés ayant des pKa différents. Par exemple:
Si on a un mélange de ces deux composés plus un produit neutre, en solution dans un
solvant non miscible à l'eau, on lave par une solution de NaHCO3. On "fait passer" le
benzoate de sodium dans l'eau, le phénol n’étant pas assez acide pour réagir reste dans
le solvant.
On lave ensuite le mélange de phénol et du produit neutre par la soude diluée, on
forme alors le phénolate de sodium qui passe dans l'eau.
Le produit neutre est resté dans la phase organique.
2. Une réaction Acide + Base produit un dégagement de chaleur. En général, une telle
réaction sera faite dans un récipient plongé dans un bain glace + eau.
3. Les réactions Acide + NaHCO3 ou Na2CO3 donnent un dégagement de CO2. Il faut
les faire avec précautions, il peut y avoir formation d'une "mousse" due au
dégagement de CO2.
4. Les réactions avec les acides et bases organiques sont parfois lentes (acides et bases
faibles) il faut donc bien s'assurer que la réaction est terminée avant de passer à l’étape
suivante. En d’autres termes le pH doit être d'environ 1 quand on régénère un acide et
d'environ 10 quand on régénère une base.
5. Lors d'une extraction on utilise de nombreux erlens pour récupérer les différentes
fractions de solvant ou d’eau. Il est indispensable de tout garder jusqu’à ce que l'on ait
bien obtenu tous les produits avec de bons rendements. Il faut de plus noter sur chaque
erlen la nature du contenu.
6. Lors de toute extraction on utilise des solvants purs mais pas de qualité anhydre. L'eau
utilisée est généralement l'eau du robinet.
pKa = 8,0
pKa = 4,17
OH
CO2H
pKa = 8,0
pKa = 4,17
OH
CO2H
1
/
2
100%