Copie des diapositives du cours de M. Laurent Evanno Le polycopié est là pour

Copiedesdiapositivesdu
coursdeM.LaurentEvanno
Lepolycopiéestlàpour
résumerlesnotions
essentiellesducours.

29/03/2013
1
DrLaurentEvannoDrLaurentEvanno
U.E.SpécifiqueU.E.Spécifique––PharmaciePharmacie–– module4module4
ChimiepharmaceutiqueChimiepharmaceutique
1
1‐Chimiebio‐organiquedesphénols
…etréactiondeDiels‐Alder
2‐Composés1,3‐dicarbonylés
DrOlivierDrOlivierProvotProvot
SynthèsedeprincipesactifsdemédicamentsSynthèsedeprincipesactifsdemédicaments
PrDelphineJosephPrDelphineJoseph
ffidé i éffidé i é
2
Lesou
f
reet
f
onct
i
ons
dé
r
i
v
é
es:Lesou
f
reet
f
onct
i
ons
dé
r
i
v
é
es:
chimieduvivantetpourlevivantchimieduvivantetpourlevivant
DrLaurentEvannoDrLaurentEvanno
ChimiebioChimiebio‐‐organiquedesphénolsorganiquedesphénols
Composés1,3Composés1,3‐‐dicarbonylésdicarbonylés
????????
ssubstancesnaturellesubstancesnaturelles
???? ????
biochimiebiochimie
chimiepharmaceutiquechimiepharmaceutique culturepersonnelleculturepersonnelle
chimieorganiquechimieorganique
ChimieorganiquedesChimieorganiquedes
phénols,notiondephénols,notionde
polyphénolspolyphénols
4

29/03/2013
2
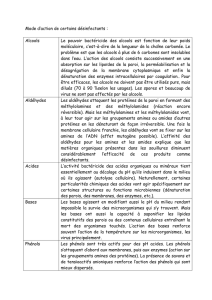
AU COURS D’UNE RÉACTION CHIMIQUE
INTERVIENNENT DES MOUVEMENTS
D’ÉLECTRONS
AU COURS D’UNE RÉACTION CHIMIQUE
INTERVIENNENT DES MOUVEMENTS
D’ÉLECTRONS
LesbonsréflexesenchimieorganiqueLesbonsréflexesenchimieorganique
LE«-» ATTAQUE LE «+»LE«-» ATTAQUE LE «+»
5
LE«+» : UN PROTON, UN CARBOCATION, UN CARBONE
δ
+ LIÉ À UN ATOME
ÉLECTRONÉGATIF
LE«+» : UN PROTON, UN CARBOCATION, UN CARBONE
δ
+ LIÉ À UN ATOME
ÉLECTRONÉGATIF
LE«-» : UNE DOUBLE LIAISON, UN ANION, UN DOUBLET LIBRE D’UN
ATOME ÉLECTRONÉGATIF (O, N)
LE«-» : UNE DOUBLE LIAISON, UN ANION, UN DOUBLET LIBRE D’UN
ATOME ÉLECTRONÉGATIF (O, N)
Phénols:structuresetcaractéristiquesPhénols:structuresetcaractéristiques
6
LE PHÉNOL :LE PHÉNOL :
FonctionhydroxylesuruncarbonearomatiqueFonctionhydroxylesuruncarbonearomatique
(benzèneparexemple)(benzèneparexemple)
PHÉNOLS
PLUS
OU
MOINS
SUBSTITUÉS
COMPOSÉS PHÉNOLIQUES : « LES PHÉNOLS »COMPOSÉS PHÉNOLIQUES : « LES PHÉNOLS »
ChimiedesphénolsChimiedesphénols
COMPOSÉS DI OU TRI PHÉNOLIQUESCOMPOSÉS DI OU TRI PHÉNOLIQUES
-
PHÉNOLS
PLUS
OU
MOINS
SUBSTITUÉS
-ÉVENTUELLEMENT POLYCYCLIQUES
7
RÉSORCINOL
RappelimportantetRappelimportantetffondamentalondamentalRappelimportantetRappelimportantetffondamentalondamental
PLUS UNE MOLÉCULE COMPORTE DE GROUPEMENTS
OH
PLUS
ELLE
EST
POLAIRE
PLUS UNE MOLÉCULE COMPORTE DE GROUPEMENTS
OH
PLUS
ELLE
EST
POLAIRE
PLUS UNE MOLÉCULE COMPORTE DE GROUPEMENTS
OH PLUS ELLE SERA SOLUBLE DANS L’EAU
PLUS UNE MOLÉCULE COMPORTE DE GROUPEMENTS
OH PLUS ELLE SERA SOLUBLE DANS L’EAU
8
OH
PLUS
ELLE
EST
POLAIRE
OH
PLUS
ELLE
EST
POLAIRE

29/03/2013
3
Phénols:caractéristiquesmoléculairesPhénols:caractéristiquesmoléculaires
9
O
pz
pz
Phénols:caractéristiquesmoléculairesPhénols:caractéristiquesmoléculaires
CONJUGAISON INTENSE : ÉNERGIE DE STABILISATION ~ 40 kcal/mole (~167 kJ/mole)
10
sp2
ÖCONSÉQUENCES SUR LA RÉACTIVITÉ :
ACIDITÉ NOTABLE DU
PROTON
BASICITÉ TRÈS FAIBLE
Phénols:caractéristiquesmoléculairesPhénols:caractéristiquesmoléculaires
11
COUPURE DE LA LIAISON
C-O DIFFICILE
SUBSTITUTIONS
ÉLECTROPHILES
FAVORISÉES
DES STRUCTURES SIMPLES…
THYMOL
VANILLINE
(«
GOUSSE
»
Phénols:denombreusessubstancesnaturellesPhénols:denombreusessubstancesnaturelles
… OU PLUS COMPLEXES :
THYMOL
(THYM)
(«
GOUSSE
»
DE VANILLE)
ESTRADIOL TÉTRAHYDROCANNABINOL
(CHANVRE INDIEN) 12

29/03/2013
4
TYROSINE
É
DOPAMINE
(NEUROTRANSMETTEUR)
Phénols:rôlesbiochimiquesPhénols:rôlesbiochimiques
NH2
HO
O
OH
(ACIDE AMIN
É
ESSENTIEL)
(NEUROTRANSMETTEUR)
ADRÉNALINE
HORMONE MESCALINE
(ALCALOÏDE DU PEYOTL)
13
Phénols:propriétésphysicochimiquesPhénols:propriétésphysicochimiques
LE PLUS SOUVENT : SOLIDES
ASSOCIATIONS INTERMOLÉCULAIRES IMPORTANTES :
POINTS
D’ÉBULLITION EN GÉNÉRAL ÉLEVÉS
SOLUBILITÉ DANS L’EAU : FONCTION DU pH
ODEUR EN GÉNÉRAL MARQUÉE
14
ASSOCIATIONS INTERMOLÉCULAIRES IMPORTANTES :
POINTS
D’ÉBULLITION EN GÉNÉRAL ÉLEVÉS
OH F
Phénols:propriétésphysicochimiquesPhénols:propriétésphysicochimiques
15
M=94g/mol
Tf=43°C
Teb =182°C
M = 96 g/mol
Tf=-44°C
Teb =84°C
ASSOCIATIONS INTERMOLÉCULAIRES IMPORTANTES :
POINTS
D’ÉBULLITION EN GÉNÉRAL ÉLEVÉS
Phénols:propriétésphysicochimiquesPhénols:propriétésphysicochimiques
16
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
1
/
32
100%