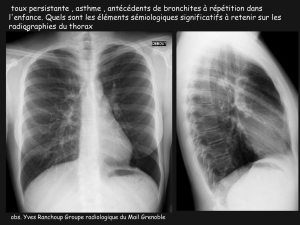
JFR 2010 - Innovations dans l'imagerie de la BPCO

JFR 2010 - Innovations dans l'imagerie de la BPCO
Mis à jour le 21/06/2011 par
SFR
Philippe A Grenier , Paris, France
Article i
ssu du quotidien des JFR2010
-
Lundi 25 Octobre
Pourquoi une séance des JFR sur l'imagerie des BPCO ? Il y a deux raisons à cela.1) La BPCO est
devenue la cinquième cause de mortalité dans le monde et par là même un problème majeur de
santé publique.2) Des progrès technologiques récents faits en scanographie multicoupes, IRM, et
analyse d'images permettent aujourd'hui une meilleure évaluation qualitative et quantitative des
modifications structurelles du parenchyme pulmonaire et des voies aériennes qui surviennent au
cours de cette maladie.
Au cours de cette séance, les experts feront le point sur les performances et les limites de ces
méthodes d'analyse et mettront en perspective l'impact que l'on peut attendre d'elles pour une
meilleure compréhension physiopathologique de la BPCO, une meilleure stratification des patients pour
les essais cliniques, et à terme une meilleure prise en
charge des patients.
Caractérisée par un syndrome obstructif aux épreuves
fonctionnelles respiratoires, la BPCO est la conséquence
d'une réponse inflammatoire chronique des voies
aériennes à la fumée de cigarette qui, à terme, entraîne
une destruction du parenchyme pulmonaire
(emphysème) et induit une réduction irréversible du
calibre des petites voies aériennes, par remodelage
pariétal bronchiolaire. Ces deux phénomènes,
bronchiolite obstructive et emphysème, sont tous deux
responsables d'un obstacle au flux aérien.
Bien que le diagnostic de BPCO soit basé
essentiellement sur des critères cliniques et
fonctionnels respiratoires, l'usage de la TDM a montré
que pour des patients BPCO ayant un même niveau de sévérité d'atteinte fonctionnelle, il existait des
différences morphologiques importantes reflétant probablement des mécanismes physiopathologiques et
des profils génomiques différents. Certains patients ont un emphysème sévère, tandis que d'autres
n'ont pas d'emphysème, ou seulement un emphysème minime, suggérant fortement la présence d'un
remodelage pariétal bronchiolaire diffus expliquant le syndrome obstructif fonctionnel.
Il est relativement aisé, sur l'analyse visuelle des images TDM, de différencier des patients ayant un
emphysème prédominant de ceux ayant une atteinte des voies aériennes prédominante. Il existe
toutefois dans la majorité des cas un important chevauchement des signes exprimant la destruction
pulmonaire et ceux du remodelage des voies aériennes.
Les différents phénotypes d'emphysème sont reconnus en TDM en fonction du type anatomique
(centrolobulaire, panlobulaire, paraseptal), et de la distribution lésionnelle. L'étendue de la destruction
lésionnelle est mieux quantifiée par analyse d'images. L'analyse quantitative densitométrique de
l'emphysème pulmonaire est une technique aujourd'hui parfaitement mature (Fig. 1). Sur la base de ses
travaux internationalement reconnus, Pierre
-
Alain Gevenois rappellera les critères permettant une
analyse globale et régionale de l'emphysème, et comment minimiser la variabilité des mesures sur des
acquisitions successives afin de rendre interprétable les études du suivi longitudinal de la maladie.
Les différents phénotypes de l'atteinte des voies aériennes sont identifiés sur des modifications
morphologiques de la trachée et des bronches, sur l'hypoperfusion pulmonaire et le piégeage
expiratoire. L'atteinte trachéobronchique inclut une déformation en fourreau de sabre de la trachée
intrathoracique, la présence de multiples diverticules trachéobronchiques exprimant la dilatation et la
fusion canalaire des glandes muqueuses, un épaississement pariétal bronchique et/ou une dilatation
luminale tubulée des bronches segmentaires et sous
-
segmentaires, et enfin une collapsibilité excessive
des lumières bronchiques et/ou trachéale en expiration dynamique (trachéobronchomalacie exprimant le
déficit en cartilage).
L'inflammation des petites voies aériennes chez ces sujets fumeurs peut s'exprimer par des opacités

centrolobulaires de faible densité et/ou des plages en verre dépoli (bronchiolite respiratoire). Plus rares
sont les foyers de petites opacités centrolobulaires nodulaires et/ou linéaires branchés (arbre en
bourgeons) dus à des impactions et/ou des infections bronchiolaires. À l'inverse, le remodelage pariétal
bronchiolaire ne s'exprime que par des signes indirects : plages hypodenses par hypoperfusion sans
destruction de l'architecture pulmonaire et qui, du fait du contraste avec les zones normalement
ventilées, créent un aspect de perfusion en mosaïque. Le piégeage expiratoire est aussi une
expression de l'obstruction luminale
bronchiolaire secondaire au remodelage.
Mais en présence concomitante
d'emphysème pulmonaire, ce signe n'est
pas spécifique de remodelage. En effet,
en raison de la perte des attaches
alvéolaires des bronches induite par la
destruction emphysémateuse, les
lumières bronchiolaires se collabent de
façon exagérée à l'expiration. Une
approche quantitative du piégeage induit
spécifiquement par le remodelage
bronchiolaire peut être obtenue en
soustrayant le volume pulmonaire
expiratoire du volume inspiratoire, après
avoir éliminé les voxels d'emphysème du
volume d'intérêt par seuillage densitométrique. Ainsi, ne sont pris dans l'analyse quantitative que des
voxels ayant une valeur d'atténuation comprise entre
-
810 et
-
950 UH.
L'épaississement pariétal bronchique est aussi un excellent marqueur indirect du remodelage pariétal
bronchiolaire. Des logiciels d'analyse d'images dédiés à l'analyse quantitative des dimensions
bronchiques sont actuellement disponibles. Ces logiciels permettent : 1) une extraction 2D/3D
automatique du contour aérique de l'arbre trachéobronchique et de son axe central ; 2) l'obtention
interactive d'autant d'images nécessaires des sections bronchiques reconstruites strictement
perpendiculaires à l'axe bronchique ; 3) la segmentation automatique des contours interne et externe
des sections bronchiques. Les surfaces de section bronchique ainsi segmentées sont automatiquement
mesurées et rapportées à la surface totale de la section bronchique (Fig. 2). Ces valeurs obtenues chez
des patients BPCO ont démontré être corrélées avec le degré de sévérité de l'obstruction fonctionnelle
et le degré de remodelage pariétal des bronchioles mesurées en histologie. Ainsi, cette mesure
quantifiée de la surface de section pariétale bronchique peut être utilisée comme une alternative à la
mesure du remodelage pariétal bronchiolaire qui n'est pas décelable en scanographie.
Ces méthodes d'analyse ne sont pas pour l'instant utilisées en routine clinique. Elles restent réservées
à la recherche clinique et translationnelle. Seule une standardisation et une validation à grande échelle
des méthodes permettront à terme une utilisation plus large. Une évaluation préalable de la variabilité
des mesures sur des acquisitions successives sera nécessaire avant une utilisation dans le suivi
longitudinal des patients.
D'autres méthodes peuvent venir en complément pour explorer la fonction pulmonaire. Il est possible de
mesurer de façon globale et régionale la perfusion pulmonaire par angioscanographie si on a de la
chance de disposer d'un scanographe double source. L'usage de la double énergie peut aussi permettre
de mesurer la ventilation pulmonaire après inhalation de xénon. Toutefois, ces méthodes sont pour
l'instant réservées à la recherche et ont l'inconvénient d'être irradiantes. Aujourd'hui, c'est l'IRM qui est
l'option de première intention pour compléter la scanographie dans l'exploration morpho
-
fonctionnelle
des patients BPCO. Hans
-
Ulrich Kauczor nous fera part de toute son expérience pour décrire toutes les
options offertes par cette modalité : mesure globale et régionale de la perfusion pulmonaire,
quantification du flux sanguin pulmonaire, évaluation de la ventilation et de la mécanique respiratoire.
Légendes des figures
Fig. 1
- Analyse quantitative par densitométrie de l'emphysème chez un patient BPCO (seuillage à
-
960
UH après une acquisition scanographique multicoupes). Les voxels ayant une valeur d'atténuation
inférieure à
-
960 UH sont segmentés et codés en couleur rouge. L'air dans la trachée et les bronches
proximales est extrait du volume calculé. Le logiciel calcule le volume d'emphysème et le volume
pulmonaire de façon globale et à poumons séparés.
Fig. 2
– Analyse quantitative des surfaces de section pariétale bronchique chez un patient BPCO.
Reconstructions 3D du contenu aérique et de l'axe central de l'arbre trachéobronchique. Exemples de

sections bronchiques perpendiculaires à l'axe central avant et après segmentation des contours interne
et externe.
1
/
3
100%