Lire l'article complet

La Lettre du Pharmacologue • Vol. 24 - n° 2 - avril-mai-juin 2010 | 47
DOSSIER THÉMATIQUE
Recherche
de concentrations cibles
plutôt que recherche de dose :
vers une meilleure ASMR ?
Finding target concentrations rather than fixed doses: towards
increased improvement of medical service provided?
P. Marquet*
* P. Marquet, UMR-S850 Inserm,
service de pharmacologie, toxicologie
et pharmacovigilance, CHU, Limoges.
L’
individualisation thérapeutique, autrement
appelée optimisation thérapeutique ou
thérapeutique ciblée, est régulièrement mise
en avant comme étant la médecine innovante
d’aujourd’hui ou de demain. On pense, la plupart du
temps, à la prise en compte de critères génétiques
pour mieux sélectionner les patients répondeurs,
ou à l’ajustement des doses sur la base de critères
pharmacogénétiques. On oublie parfois que la plus
ancienne modalité d’individualisation thérapeu-
tique est fondée sur la pharmacocinétique, visant
à réduire les différences d’exposition systémique
entre les patients. C’est l’objet du suivi thérapeutique
pharmacologique (STP), qui est sous-utilisé dans
de nombreux domaines thérapeutiques malgré les
progrès considérables réalisés depuis plus de 50 ans
que cette discipline existe (1). Le STP est pourtant
indissociable des traitements immunosuppres-
seurs en transplantation, et largement utilisé dans
les thérapies antirétrovirales ou anticancéreuses.
Il existe en effet, dans les spécialités médicales
correspondantes, contrairement à beaucoup
d’autres, une véritable culture de l’optimisation
thérapeutique, aussi bien chez les thérapeutes que
dans les laboratoires pharmaceutiques. Malgré cette
sensibilisation, et le fait que cette approche, dite
d’adaptation pharmacocinétique en “concentra-
tion-contrôlée”, permette d’améliorer la balance
bénéfice-risque de certains médicaments, et donc
potentiellement leur amélioration du service médical
rendu (ASMR), une grande part des essais cliniques
nécessaires au STP est conduite après leur autorisa-
tion de mise sur le marché (AMM). Il serait donc dans
l’intérêt des patients et des laboratoires qu’elle soit
conduite avant la mise sur le marché des produits.
Les leçons du post-AMM
Une petite minorité de médicaments, de l’ordre
d’une centaine dans la pharmacopée actuelle,
bénéficient ou devraient bénéficier du STP. Les
caractéristiques pharmacologiques communes à
ces médicaments sont essentiellement : l’absence de
mesure directe d’effet, des relations concentration-
effets bien établies, un index thérapeutique étroit,
une grande variabilité pharmacocinétique entre indi-
vidus (l’existence d’interactions médicamenteuses
étant un élément favorisant), et une faible variabilité
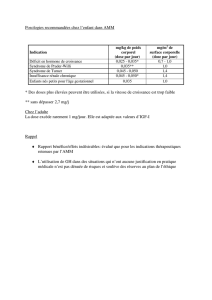
intra-individuelle à court terme (encadré I).
Caractéristiques pharmacologiques devant conduire
à envisager une approche “concentration-contrôlée”
1 – Mesure directe d’effet impossible
2 – Bonne relation concentration-effets
3 – Faible index thérapeutique (Cmineff/Cmintox)
4 – Grande variabilité interindividuelle des concentrations obtenues pour une même dose
5 – Existence d’interactions médicamenteuses pharmacocinétiques
6 – Faible variabilité intra-individuelle à court terme
Encadré I

48 | La Lettre du Pharmacologue • Vol. 24 - n° 2 - avril-mai-juin 2010
Résumé
»Pour un certain nombre de médicaments, l’adaptation de la posologie sur la base de leurs concentra-
tions sanguines apporte un bénéfice thérapeutique. Pourtant, les essais cliniques nécessaires à la mise en
place d’une telle procédure et permettant d’en démontrer l’intérêt ont généralement été menés, souvent
de façon incomplète, après leur mise sur le marché. Les études cliniques pré-AMM se prêteraient sans
grande complication supplémentaire à l’investigation de cette approche, en parallèle de la recherche de
dose. Or, la littérature fournit très peu d’exemples d’essais en concentration-contrôlée lors des phases de
développement clinique, alors que l’individualisation thérapeutique est susceptible d’accroître la taille de
l’effet dans la population cible, et améliorerait donc le service médical rendu.
Mots-clés
Suivi thérapeutique
Pharmacologique
Essais cliniques
Concentration-
contrôlée
ASMR
Summary
For a number of drugs, dose
adjustment based on drug
blood concentrations results
in a clinical benefit. However,
the clinical trials required to
set up such procedures and
demonstrate their interest
have generally been conducted,
often incompletely, after most
of these drugs have been
approved. The clinical trials
run in order to obtain drug
regulation agencies’ approval
are compatible with the inves-
tigation of such an approach
in parallel with dose finding,
without much complication.
However, there are very few
examples of concentration-
controlled trials in clinical
development phases in the
literature, despite the fact
that dose individualisation
is susceptible to increase the
effect size in the target popula-
tion, hence the improvement of
medical service provided.
Keywords
Therapeutic drug monitoring
Clinical trials
Concentration-controlled
Improvement
of medical service provided
Essais cliniques à mener
Dans l’idéal, trois grandes étapes doivent être
conduites pour définir les modalités du STP d’un
médicament (encadré II) : recherche du meilleur
index d’exposition, recherche du niveau d’exposition
cible et démonstration de l’apport de l’individualisa-
tion thérapeutique en termes de balance bénéfice/
risque. En pratique, bien peu de médicaments ont pu
bénéficier de toutes ces études et, quand cela a été le
cas, elles ont, la plupart du temps, été menées après
leur AMM. Pourtant, cette approche permet dans
certains cas des gains thérapeutiques importants
pour un investissement bien moindre que celui de
la mise au point d’un nouveau médicament, voire
que celui d’une extension d’AMM à une nouvelle
association thérapeutique.
Une bonne partie des informations nécessaires à
l’évaluation de l’intérêt potentiel du STP, ainsi que
de ses modalités, est déjà recueillie lors des essais
cliniques destinés à l’AMM, ou pourrait l’être sans
grande complication.
Situation actuelle des essais
cliniques pour l’obtention
de l’AMM et transposition
envisageable pour les
essais d’individualisation
thérapeutique
Examen des critères a priori en phase I
Pour toute nouvelle substance active chez l’homme,
les essais de phase I (ou, pour suivre la nomenclature
proposée par l’EMEA, les “essais de pharmacologie
humaine” [2]) se doivent d’établir, en plus de la
dose maximale tolérée, un premier profil pharma-
cocinétique et pharmacodynamique, chez les sujets
sains mais aussi dans des populations particulières
qui peuvent être concernées par le candidat-médi-
cament (insuffisants rénaux ou hépatiques, sujets
âgés, enfants, etc.), ainsi que les effets de la prise
alimentaire sur la pharmacocinétique (2). La recom-
mandation européenne propose également, pour
certains candidats-médicaments et certains effets
étudiés, de conduire des études pharmacocinétiques/
pharmacodynamiques (PK/PD) chez des volontaires
sains ou chez des patients atteints de la maladie
cible, précisant qu’une mesure pharmacodynamique
(c’est-à-dire d’un marqueur d’activité pharmaco-
logique) appropriée, si elle existe, peut fournir des
estimations précoces de l’activité et de l’efficacité
potentielle du candidat-médicament, et guider la
dose à administrer et la fréquence d’administration
dans les études ultérieures. Un premier examen des
critères a priori en faveur d’une approche d’indivi-
dualisation thérapeutique peut donc être fait à ce
stade, par l’évaluation : des relations dose-exposi-
tion, de la variabilité pharmacocinétique entre indi-
vidus d’une même “population”, entre populations
et en fonction des conditions d’expérimentation
(par exemple food effect), de la relation entre toxi-
cité et index d’exposition (Cmax, Cmin, ASC) et de sa
pertinence par rapport à la relation dose/toxicité ;
des relations dose-pharmacodynamie et exposition-
pharmacodynamie.
Études “concentrations-contrôlées”
en phase II
Les essais de phase II (ou “essais thérapeutiques
exploratoires”) étudient la relation dose-réponse, le
plus souvent sur la base de marqueurs intermédiaires
d’effets (surrogate markers), pour définir la dose
qui sera étudiée en phase III. Les études de phase II
précoce en escalade de doses sont généralement
conduites en dose unique, ce qui est très limitant
pour les études concentrations-effets, mais les essais
de phase II ultérieurs peuvent être en dose répétée.
Les études pharmacocinétiques sont généralement
poursuivies à ce stade, en particulier dans le but
de rechercher des interactions médicamenteuses
pharmacocinétiques, mais aussi en cas d’associations
thérapeutiques différentes, dans diverses populations
ou avec des critères de jugement cliniques diffé-
rents (2). À ce stade, les critères a priori en faveur de
l’individualisation thérapeutique vont pouvoir être
complétés, avec l’évaluation plus puissante des rela-
tions dose-concentrations et concentrations-effets,

La Lettre du Pharmacologue • Vol. 24 - n° 2 - avril-mai-juin 2010 | 49
DOSSIER THÉMATIQUE
de la variabilité pharmacocinétique interindividuelle
et intra-individuelle (à court et moyen termes), de
l’existence d’interactions médicamenteuses contri-
buant à cette variabilité, et surtout d’une première
estimation de l’index thérapeutique (concentration
minimale efficace/concentration minimale toxique).
Il est à noter que la modélisation pharmacociné-
tique de population peut permettre, dès ce stade,
d’identifier des causes de variabilité pharmacoci-
nétique d’origine physiopathologique, génétique
ou pharmacologique (3).
C’est également lors des essais de phase II que la
stratégie d’individualisation thérapeutique peut faire
l’objet d’une première évaluation prospective par la
réalisation d’essais en concentration-contrôlée (ce
qui nécessite l’administration de doses répétées),
comparativement à la recherche de dose efficace.
La recherche sur PubMed des mots-clés “concentra-
tion-controlled” et “phase II” a permis d’identifier neuf
articles, publiés entre 1994 et 2009, dont 7 concer-
naient des candidats-médicaments ou médicaments
immunosuppresseurs et 2 des antirétroviraux. En
réalité, dans la majorité de ces essais, c’est la dose de
l’un des immunosuppresseurs associés, et non celle
du produit à l’essai, qui était ajustée sur la concentra-
tion selon les recommandations en usage. D’autres
articles traitaient des phases II post-AMM comparant
une nouvelle association médicamenteuse avec celle
ayant obtenu l’AMM (4, 5), ne permettant pas d’éva-
luer l’intérêt de l’individualisation thérapeutique,
puisque le schéma d’administration et les concen-
trations cibles du médicament à l’essai étaient les
mêmes dans les deux bras.
Néanmoins, l’une des études en escalade de doses
(à doses fixes), concernant le sirolimus associé à la
ciclosporine en concentration-contrôlée, concluait
que les modifications des tests biologiques (NFS et
bilan lipidique) présentaient une meilleure associa-
tion avec la concentration sanguine de sirolimus
qu’avec la dose (6). Parmi les articles pertinents, un
essai de schéma complexe comparait l’administra-
tion à dose fixe versus concentration-contrôlée du
sirolimus, mais avec d’autres différences majeures
entre les deux bras qui ne permettaient pas d’at-
tribuer à la seule individualisation de posologie le
bénéfice clinique observé dans le second bras (7).
Pourtant, il est intéressant de noter que c’est cet
essai qui a conduit au schéma thérapeutique ayant
finalement obtenu l’AMM en Europe. Le seul vrai
essai en concentration-contrôlée d’un candidat
immunosuppresseur concernait le FK778, admi-
nistré avec deux niveaux de concentration résiduelle
cible. Il concluait à la nécessité de conserver cette
approche pour les essais ultérieurs, du fait des rela-
tions concentrations-effets constatées (8). Toutefois,
le développement de ce produit a été arrêté en 2006
pour cause d’efficacité insuffisante.
Un article rapporte les résultats de deux essais
de phase II concernant l’alovudine, un analogue
nucléosidique à activité antirétrovirale, dont le
développement a également été arrêté pour effi-
cacité limitée en 2005 (9). Le premier de ces essais
avait mis en évidence une relation ASC-toxicité chez
14 patients et le second, de type concentration-
contrôlée, randomisé et en double aveugle, avait
comparé chez 46 patients trois niveaux d’ASC cibles
lors d’une étude en dose répétée de 16 semaines,
confirmant la relation entre l’ASC et des marqueurs
d’effets intermédiaires et permettant même d’établir
l’ASC-efficace 50 %. Le fait que les trop rares essais
randomisés en concentration-contrôlée n’ont été
menés que pour des médicaments qui ont finalement
été abandonnés n’est peut-être pas totalement dû au
hasard : on peut supposer que c’est principalement
dans le but d’augmenter l’efficacité et d’améliorer
la balance bénéfice/risque de ces molécules qu’une
telle approche a été engagée.
Validation de l’individualisation
thérapeutique en phase III ?
Les essais de phase III (ou “essais thérapeutiques de
confirmation”, selon l’EMEA), généralement conduits
sur de plus longues périodes de traitement, ont pour
Essais cliniques nécessaires à l’établissement
d’une stratégie d’individualisation pharmacocinétique
1 – Recherche du meilleur index d’exposition
analyse rétrospective d’essais thérapeutiques : quel est l’index d’exposition (Cmin, Cmax, ASC,
etc.) le mieux corrélé au succès ou à l’échec ?
études prospectives randomisées : vérification par comparaison de 2 index
2 – Recherche de la valeur cible (zone thérapeutique)
analyses rétrospectives d’essais thérapeutiques : quels sont les niveaux moyens de l’index
d’exposition sélectionné (Cmin, Cmax, ASC, etc.) chez les patients en succès thérapeutique
versus ceux en échec versus ceux présentant des effets indésirables ?
essais cliniques “concentrations-controlées”, prospectifs et randomisés : comparaison de
différents niveaux d’exposition visés par adaptation de posologie
3 – Preuves expérimentales de l’intérêt du STP
essais thérapeutiques comparatifs randomisés, avec/sans adaptation de posologie
analyse de morbidité et de mortalité
aveugle ou double aveugle si possible
incluant une étude coût/bénéfice
Encadré II

50 | La Lettre du Pharmacologue • Vol. 24 - n° 2 - avril-mai-juin 2010
DOSSIER THÉMATIQUE
Nouveaux développements
du médicament Recherche de concentrations cibles plutôt que recherche
de dose : vers une meilleure ASMR ?
but de fournir une base adéquate à l’autorisation de
mise sur le marché. Ils peuvent également explorer
les relations dose-effets dans des populations plus
larges, à différents stades de la maladie ou en asso-
ciation avec d’autres médicaments. À ce stade, les
relations concentrations-effets peuvent être étudiées
dans une population plus vaste et variée, avec plus
une plus grande puissance statistique. Si le suivi
d’une concentration unique, telle que la concen-
tration résiduelle, n’est pas suffisant, les modèles
pharmacocinétiques de population et l’estimation
bayésienne associée à des stratégies de prélève-
ments en nombre limité permettent de généraliser
une telle approche à moindre coût, tout en limitant
les complications logistiques et l’inconfort pour les
patients. Une telle approche a été menée, des études
de phase I aux études de phase III, pour le docétaxel
par exemple (3, 10, 11). Toutefois, la recherche sur
PubMed de la combinaison de mots-clés “concentra-
tion-controlled” et “Phase III” n’a permis de retrouver
aucun article pertinent. Même pour le docétaxel,
cette stratégie n’a pas été retenue. L’expérience du
sirolimus est intéressante à ce titre. Aux États-Unis,
ce médicament a obtenu son AMM en transplantation
rénale en 1999, à dose fixe, sur la base des résultats
de deux essais de phase III, l’un conduit aux États-
Unis, l’autre mondial. Dans le même temps, l’EMEA
refusait de délivrer une AMM sur la base de ces deux
études. Elle l’a finalement délivrée en 2001, avec un
schéma d’administration imposant l’adaptation de
posologie sur la concentration résiduelle et l’arrêt
de la ciclosporine entre le deuxième et le quatrième
mois post-transplantation, sur la base des résultats
d’un troisième essai de phase III (12), lui-même dérivé
de l’essai de phase II déjà cité. L’AMM a secondaire-
ment été modifiée aux États-Unis pour se rappro-
cher de l’AMM européenne, avec toutefois moins de
contraintes concernant l’adaptation posologique
pendant la première période (sous ciclosporine) chez
les patients à faible risque immunologique.
Rattrapage ou bricolage en phase IV
Les essais de phase IV, post-AMM (ou “essais
d’utilisation thérapeutique” selon l’EMEA), sont
souvent importants pour optimiser l’utilisation du
médicament. C’est dans ce cadre qu’ont été le plus
souvent conduites les études d’associations concen-
trations-effets ou en concentration-contrôlée qui
ont permis la mise au point de stratégies d’invidua-
lisation thérapeutique par méthode pharmacociné-
tique. Malheureusement, elles ont été menées le
plus souvent par des investigateurs académiques,
avec des moyens limités et sans l’enchaînement de
toutes les étapes nécessaires aux meilleurs niveaux
de preuve. Les médicaments immunosuppresseurs
font donc à nouveau exception, puisque bien avant
le sirolimus, les recommandations de prescription
de la ciclosporine avaient rapidement évolué de
stratégies à dose fixe au début des années 1980 à
une dose ajustée sur la concentration.
Impact potentiel sur l’ASMR
et accès au marché des
stratégies d’individualisation
thérapeutique
L’amélioration du service médical rendu (ASMR) est
d’autant plus importante que la taille de l’effet est
grande dans la population cible. Deux stratégies
sont donc possibles : soit réduire la population cible
aux seuls répondeurs, soit diminuer la probabilité
d’échec thérapeutique. Lorsque la relation concen-
tration-effet, plus directe, est également plus forte
que la relation dose-effet, alors les stratégies de
recherche puis de ciblage de la meilleure concen-
tration cible doivent conduire à une diminution du
pourcentage de patients en échec thérapeutique
par efficacité insuffisante et/ou à une réduction
de l’incidence des événements indésirables. Elles
sont donc susceptibles d’avoir un effet majeur sur
la balance bénéfice/risque. La définition de seuils de
concentration efficace ou toxique avec adaptation
posologique peut être un moyen simple d’augmenter
la taille de l’effet sur une population en réduisant la
fréquence des effets indésirables.
Ces stratégies d’individualisation thérapeutique
permettent de gérer de manière pragmatique les
interactions médicamenteuses pharmacocinétiques.
Elles permettent de fournir des recommandations
pour l’utilisation du médicament dans des popu-
lations particulières (insuffisants rénaux ou hépa-
tiques), avec une adaptation pragmatique à chaque
individu, plutôt que d’établir des algorithmes de
dose complexes et simplificateurs, d’émettre des
précautions d’emploi et de déconseiller ou de contre-
indiquer le médicament dans ces populations. Enfin,
elles peuvent favoriser l’élargissement de l’AMM aux
âges extrêmes (nourrissons, enfants, sujets âgés) en
tenant compte des caractéristiques pharmacociné-
tiques propres à ces populations, à chaque individu
au sein de ces population, et de leur évolution dans
le temps chez un même individu.

DOSSIER THÉMATIQUE
Impact potentiel sur le prix
Un des arguments fréquemment avancés à l’encontre
de l’adaptation pharmacocinétique est son coût.
Dans une étude comparative, randomisée récente
évaluant l’adaptation pharmacocinétique du myco-
phénolate mofétil, et ayant démontré un gain d’effi-
cacité significatif (13), l’étude pharmaco-économique
conduite en parallèle a montré que le coût total de
cette procédure représentait 1 % des coûts médi-
caux totaux de la première année post-greffe, tandis
que le coût du suivi thérapeutique de routine de la
ciclosporine, effectué selon l’habitude des centres,
s’élevait à 3 % (14). Ensemble, ces coûts étaient
environ 7 fois inférieurs au coût des médicaments.
Limites et perspectives
Les limites actuelles de l’individualisation théra-
peutique concernent les biomolécules, dont les
mécanismes et les sources de variabilité pharmaco-
cinétiques sont moins connus que ceux des petites
molécules, ainsi que les promédicaments, dont la
forme active n’est produite que dans les cellules,
la phosphorylation intracellulaire des analogues
nucléosidiques, par exemple. Il s’agit de limites
relatives, car des travaux préliminaires récents ont
apporté des arguments en faveur de l’adaptation
pharmacocinétique d’anticorps monoclonaux (15),
tandis que des travaux anciens pré-AMM déjà cités
avaient démontré l’intérêt de l’adaptation de dose
d’un analogue nucléosidique sur la base de l’ASC
plasmatique (9).
Les agences ont un rôle à jouer dans l’utilisation plus
large de l’approche d’individualisation thérapeutique,
en relevant les critères a priori dans les études de
phases I et II (encadré I) et, pour les candidats-médi-
caments qui remplissent ces critères, en incitant les
industriels à conduire des études de type “concen-
tration-contrôlée” en phases II et III.
Les essais cliniques d’utilisation thérapeutique
conduits depuis de nombreuses années par des
promoteurs académiques et industriels, de même
que l’expérience clinique, ont permis d’améliorer
considérablement le pronostic de conditions telles
que la transplantation d’organes ou les leucémies
aiguës lymphoblastiques chez les enfants, en affinant
et individualisant les stratégies, malgré l’absence
de nouvelles molécules. On peut, à l’évidence, faire
mieux en anticipant cela dans le développement des
nouveaux médicaments !
Conclusion
L’adaptation de la posologie fondée sur la concen-
tration sanguine, ou suivi thérapeutique pharma-
cologique, est encore trop souvent vécue par les
industriels comme une complication freinant la
diffusion de leurs produits et majorant le coût des
traitements. Pourtant, outre que ce surcoût est
le plus souvent minime par rapport au coût du
produit lui-même, cette approche d’individualisa-
tion thérapeutique a démontré son intérêt clinique
depuis des décennies pour les médicaments à marge
thérapeutique étroite. Elle est surtout susceptible
d’améliorer le positionnement de candidats-
médicaments, en termes de taille de l’effet dans
la population cible et donc d’ASMR. C’est donc
dès les phases de développement clinique qu’une
approche “concentration-contrôlée” devrait être
étudiée, parallèlement à l’approche classique, à
dose fixe. ■
1. Reidenberg MM. Trends in clinical pharmacokinetics. Clin
Pharmacokinet. 1993;24(1):1-9.
2. Note for guidance on general considerations for clinical
trials (CPMP/ICH/291/95), EMEA 2006.
3. Bruno R, Hille D, Riva A et al. Population pharmacoki-
netics/pharmacodynamics of docetaxel in phase II studies
in patients with cancer. J Clin Oncol 1998;16(1):187-96.
4. Morales JM, Wramner L, Kreis H et al.; Sirolimus European
Renal Transplant Study Group. Sirolimus does not exhibit
nephrotoxicity compared to cyclosporine in renal transplant
recipients. Am J Transplant 2002;2(5):436-42.
5. Brundage RC, Yong FH, Fenton T, Spector SA, Starr SE,
Fletcher CV. Intrapatient variability of efavirenz concentra-
tions as a predictor of virologic response to antiretroviral
therapy. Antimicrob Agents Chemother 2004;48(3):979-84.
6. Kahan BD, Podbielski J, Napoli KL, Katz SM, Meier-
Kriesche HU, Van Buren CT. Immunosuppressive effects and
safety of a sirolimus/cyclosporine combination regimen for
renal transplantation. Transplantation 1998;66(8):1040-6.
7. Gonwa TA, Hricik DE, Brinker K, Grinyo JM, Schena FP;
Sirolimus Renal Function Study Group. Improved renal
function in sirolimus-treated renal transplant patients
after early cyclosporine elimination. Transplantation
2002;74(11):1560-7.
8. Vanrenterghem Y, Van Hooff JP, Klinger M et al. The
effects of FK778 in combination with tacrolimus and steroids:
a phase II multicenter study in renal transplant patients.
Transplantation 2004;78(1):9-14.
9. Flexner C, Van der Horst C, Jacobson MA et al. Relationship
between plasma concentrations of 3'-deoxy-3'-fluorothy-
midine (alovudine) and antiretroviral activity in two concen-
tration-controlled trials. J Infect Dis 1994;170(6):1394-403.
10. Baille P, Bruno R, Schellens JH et al. Optimal sampling
strategies for bayesian estimation of docetaxel (Taxotere)
clearance. Clin Cancer Res 1997;3(9):1535-8.
11. Bruno R, Vivier N, Veyrat-Follet C, Montay G, Rhodes GR.
Population pharmacokinetics and pharmacokinetic-
pharmacodynamic relationships for docetaxel. Invest New
Drugs 2001;19(2):163-9.
12. Johnson RW, Kreis H, Oberbauer R, Brattström C,
Claesson K, Eris J. Sirolimus allows early cyclosporine
withdrawal in renal transplantation resulting in improved
renal function and lower blood pressure. Transplantation
2001;72(5):777-86.
13. Le Meur Y, Büchler M, Thierry A et al. Individualized
mycophenolate mofetil dosing based on drug exposure
significantly improves patient outcomes after renal trans-
plantation. Am J Transplant 2007;7(11):2496-503.
14. Rousseau A, Laroche ML, Venisse N et al. Cost-effec-
tiveness analysis of individualized mycophenolate mofetil
dosing in kidney transplant patients in the APOMYGRE Trial.
Transplantation 2010; sous presse.
15. Mulleman D, Méric JC, Paintaud G et al. Infliximab
concentration monitoring improves the control of
disease activity in rheumatoid arthritis. Arthritis Res Ther
2009;11(6):R178.
Références bibliographiques
1
/
5
100%