Maladie d`amaigrissement du porcelet et circovirus - CIV

1
Février 2007
Maladie d’amaigrissement du porcelet et circovirus
La maladie d’amaigrissement du porcelet
La MAP (Maladie d’Amaigrissement du Porcelet), en anglais PMWS pour
« Postweaning Multisystemic Wasting Syndrome », est d’abord décrite au Canada en
1996 (11). La maladie est alors signalée en Europe en 1997 (Espagne, France,
Royaume-Uni …) puis dans la plupart des pays producteurs de porcs dans le monde.
Elle se caractérise par une expression ciblée sur le porc en phase de croissance (de
7 à 15 semaines d’âge) et se manifeste sous la forme de fièvre et de perte d’appétit,
signes accompagnés de difficultés respiratoires et parfois de diarrhée, l’ensemble
conduisant dans les cas sévères au dépérissement de l’animal (perte de poids) et
parfois à la mort. On observe une grande variabilité dans la sévérité de l’expression
clinique entre élevages et entre individus au sein d’un même élevage. Un effet
« portée » est également observé. Chez les sujets malades, les lésions concernent
différents organes (poumon, foie, rein, ganglions lymphatiques ..). L’histologie
pratiquée sur les tissus lymphoïdes révèle une destruction folliculaire, une déplétion
lymphocytaire, une expansion des zones paracorticales avec infiltration histiocytaire
et présence de cellules géantes multinucléées (19).
Les recherches virales entreprises sur les tissus lésés ont permis de détecter un
virus, le circovirus de type 2 ou PCV2 (en anglais : « Porcine Circovirus Type 2 »).
Dès que les techniques de détection du virus (immunohistochimie, hybridation in-situ)
et des anticorps produits se sont développées (9, 22), il est clairement apparu que le
PCV2 était largement répandu dans la population porcine mondiale. Des études
rétrospectives réalisées dans différents pays, soit sur sérums, soit sur tissus ont
également montré la présence du PCV2 dans la population porcine bien avant les
premières descriptions de la maladie (14). Enfin les études épidémiologiques de type
cas/témoin réalisées en élevage ont montré la présence du PCV2 tant dans les
élevages atteints de MAP que chez des témoins n’ayant aucun historique de la
maladie. Par ailleurs, les études génomiques ne montrent pas d’écart notable chez
les isolats viraux obtenus dans les élevages de ces études (12, 15). Outre la seule
présence du PCV2, d’autres conditions sont par conséquent nécessaires à
l’expression typique de la maladie telle qu’elle peut se présenter en élevage. Celles-
ci ne sont pas toutes précisément connues. Néanmoins, des mesures
essentiellement zootechniques ont été proposées dans de nombreux pays (17).
L’impact de la MAP est depuis plusieurs années considérablement réduit en France
suite à l’application de ces mesures.
Des reproductions expérimentales de MAP ont été tentées par inoculation du PCV2 à
des porcs en conditions contrôlées. Une maladie peu prononcée est en général
obtenue avec cependant les lésions typiques associées (1, 2, 6) et la présence virale
massive dans les tissus lésés.
Par ailleurs, toujours en conditions contrôlées, la neutralisation du PCV2 suite à une
vaccination par une protéine virale réduit considérablement l’impact de l’infection (8).

2
Le PCV2 est aujourd’hui considéré comme agent étiologique majeur associé à la
MAP. Les raisons de l’émergence de la MAP au milieu des années 90 ne sont pas
véritablement connues.
Les circovirus
À ce jour, seuls les suidés (porc et sanglier) et les oiseaux ont été identifiés comme
les hôtes des circovirus.
Les circovirus possèdent tous un génome à ADN circulaire simple brin d’environ
2000 nucléotides. Leur ADN contient une séquence nonanucléotidique nécessaire
pour la réplication, flanquée de séquences répétées inversées représentant un motif
tige-boucle et deux cadres de lecture principaux d’orientation opposée, l’un codant
pour la protéine Rep associée à la réplication et l’autre pour la protéine de capside
Cap .
Les circovirus infectent les vertébrés, ils possèdent un ADN circulaire simple brin et
présentent des similitudes avec les virus qui infectent les plantes (Geminivirus et
Nanovirus).
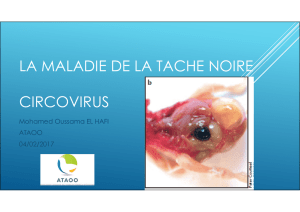
Le circovirus porcin de type 2 a été identifié à partir de lésions de porcelets malades
(porcine circovirus type 2, PCV2). Depuis 2005 deux genres sont identifiés dans la
famille des Circoviridae : le genre Gyrovirus et le genre Circovirus incluant les
circovirus porcins et de nouveaux membres découverts chez des espèces aviaires
dont le circovirus du pigeon (pigeon circovirus, PiCV), de l’oie (goose circovirus,
GoCV) et du canari (canary circovirus, CaCV) (19). Des espèces isolées chez le
pinson (finch circovirus, FiCV), le canard (duck circovirus, DuCV) et la mouette (gull
circovirus, GuCV) sont en attente d’y être classées (20).
Le Torque teno virus (TTV) et le TTV-like mini-virus (TLMV), découverts chez
l’homme à partir de 1997 et décrits initialement comme « circovirus humains », sont
différents des circovirus, et sont désormais regroupés dans le genre Anellovirus,
dans l’attente d’être assignés à une famille (7). De nombreuses études sont
consacrées aux TTV. Ils sont souvent désormais considérés comme non pathogènes
voire comme symbiontes (13) .
Spectre d’hôte
Le PCV2 a été isolé chez des suidés (porc et sanglier) en Europe (3, 18), en
Amérique du Nord, centrale et du Sud (3, 21) ainsi qu’en Asie (10).
Les circovirus porcins n’ont été retrouvés que chez les suidés, indiquant une grande
spécificité d’hôte. Les recherches sérologiques effectuées dans les populations
humaines exposées et animales (bovins, ovins, poulet, lapin) sont restées négatives
(4, 5). Des essais d’inoculation de PCV2 sur diverses lignées bovines et ovines ont
montré que les virus pouvaient infecter ces cellules sans qu’il y ait cependant
production de particules virales (5). L’infection de différentes lignées cellulaires
humaines et simiennes par le PCV1 ou le PCV2 est non productive de virus bien que
le PCV1, comme le PCV2, puisse entrer et se répliquer dans certaines cellules
humaines (16).
Pathologies associées

3
Tous les circovirus ont un tropisme pour le système immunitaire et provoquent une
déplétion lymphocytaire plus ou moins prononcée chez leurs hôtes. Toutefois, de très
nombreux animaux peuvent être infectés par les circovirus sans manifester de signes
cliniques.
1. Albina, E., C. Truong, E. Hutet, P. Blanchard, R. Cariolet, R. L'Hospitalier,
D. Mahe, C. Allee, H. Morvan, N. Amenna, M. Le Dimna, F. Madec, and A.
Jestin. 2001. An experimental model for post-weaning multisystemic wasting
syndrome (PMWS) in growing piglets. J Comp Pathol 125:292-303.
2. Allan, G. M., F. McNeilly, J. Ellis, S. Krakowka, B. Meehan, I. McNair, I.
Walker, and S. Kennedy. 2000. Experimental infection of colostrum deprived
piglets with porcine circovirus 2 (PCV2) and porcine reproductive and
respiratory syndrome virus (PRRSV) potentiates PCV2 replication. Arch Virol
145:2421-9.
3. Allan, G. M., F. McNeilly, S. Kennedy, B. Daft, E. G. Clarke, J. A. Ellis, D.
M. Haines, B. M. Meehan, and B. M. Adair. 1998. Isolation of porcine
circovirus-like viruses from pigs with a wasting disease in the USA and
Europe. J Vet Diagn Invest 10:3-10.
4. Allan, G. M., F. McNeilly, I. McNair, M. D. Curran, I. Walker, J. Ellis, C.
Konoby, S. Kennedy, and B. Meehan. 2000. Absence of evidence for
porcine circovirus type 2 in cattle and humans, and lack of seroconversion or
lesions in experimentally infected sheep. Arch Virol 145:853-7.
5. Allan, G. M., K. V. Phenix, D. Todd, and M. S. McNulty. 1994. Some
biological and physico-chemical properties of porcine circovirus. J Vet Med B
41:17-26.
6. Balasch, M., J. Segales, C. Rosell, M. Domingo, A. Mankertz, A. Urniza,
and J. Plana-Duran. 1999. Experimental inoculation of conventional pigs with
tissue homogenates from pigs with post-weaning multisystemic wasting
syndrome. J Comp Pathol 121:139-48.
7. Biagini, P., D. Todd, M. Bendinelli, S. Hino, A. Mankertz, S. Mishiro, C.
Niel, H. Okamoto, S. Raidal, B. W. Ritchie, and G. C. Teo. 2005.
Anellovirus, p. 335-341. In C. M. Fauquet, M. A. Mayo, J. Maniloff, U.
Desselberger, and L. A. Ball (ed.), Virus Taxonomy, VIIIth Report of the the
International Committee of Taxonomy of Viruses. Elsevier/Academic Press,
London.
8. Blanchard, P., D. Mahe, R. Cariolet, A. Keranflec'h, M. A. Baudouard, P.
Cordioli, E. Albina, and A. Jestin. 2003. Protection of swine against post-
weaning multisystemic wasting syndrome (PMWS) by porcine circovirus type 2
(PCV2) proteins. Vaccine 21:4565-75.
9. Blanchard, P., D. Mahe, R. Cariolet, C. Truong, M. Le Dimna, C. Arnauld,
N. Rose, E. Eveno, E. Albina, F. Madec, and A. Jestin. 2003. An ORF2
protein-based ELISA for porcine circovirus type 2 antibodies in post-weaning
multisystemic wasting syndrome. Vet Microbiol 94:183-94.
10. Choi, C., C. Chae, and E. G. Clark. 2000. Porcine postweaning multisystemic
wasting syndrome in Korean pig: detection of porcine circovirus 2 infection by
immunohistochemistry and polymerase chain reaction. J Vet Diagn Invest
12:151-3.
11. Clark, E. 1996. Post-weaning Multisystemic Wasting Syndrome. Proceedings
of the western Can. Asso of Swine Pract.:19-20.

4
12. de Boisseson, C., V. Beven, L. Bigarre, R. Thiery, N. Rose, E. Eveno, F.
Madec, and A. Jestin. 2004. Molecular characterization of Porcine circovirus
type 2 isolates from post-weaning multisystemic wasting syndrome-affected
and non-affected pigs. J Gen Virol 85:293-304.
13 Gergely P. J., Perl A., Poor G., 2006. Possible pathogenic nature of the
recently discovered TT virus: does it play a role in autoimmune rheumatic
disease? Autoimmunity Review 6:5-9
14. Grierson, S. S., D. P. King, T. Sandvik, D. Hicks, Y. Spencer, T. W. Drew,
and M. Banks. 2004. Detection and genetic typing of type 2 porcine
circoviruses in archived pig tissues from the UK. Arch Virol 149:1171-83.
15. Grierson, S. S., D. P. King, G. J. Wellenberg, and M. Banks. 2004. Genome
sequence analysis of 10 Dutch porcine circovirus type 2 (PCV-2) isolates from
a PMWS case-control study. Res Vet Sci 77:265-8.
16. Hattermann, K., C. Roedner, C. Schmitt, T. Finsterbusch, T. Steinfeldt,
and A. Mankertz. 2004. Infection studies on human cell lines with porcine
circovirus type 1 and porcine circovirus type 2. Xenotransplantation 11:284-94.
17. Madec, F., E. Eveno, P. Morvan, L. Hamon, P. Blanchard, R. Cariolet, N.
Amenna, H. Morvan, C. Truong, D. Mahe, E. Albina, and A. Jestin. 2000.
Post-weaning multisystemic wasting syndrome (PMWS) in pigs in
France:clinical observations from follow-up studies on affected farms. Liv Prod
Sci 63:223.
18. Mankertz, A., M. Domingo, J. M. Folch, P. LeCann, A. Jestin, J. Segales,
B. Chmielewicz, J. Plana-Duran, and D. Soike. 2000. Characterisation of
PCV-2 isolates from Spain, Germany and France. Virus Res 66:65-77.
19. Segales, J., and M. Domingo. 2002. Postweaning multisystemic wasting
syndrome (PMWS) in pigs. A review. Vet Q 24:109-24.
20. Todd, D., M. Bendinelli, P. Biagini, S. Hino, A. Mankertz, S. Mishiro, C.
Niel, H. Okamoto, S. Raidal, B. W. Ritchie, and G. C. Teo. 2005. Family
Circoviridae, p. 327-334. In C. M. Fauquet, M. A. Mayo, J. Maniloff, U.
Desselberger, and L. A. Ball (ed.), Virus Taxonomy, VIIIth Report of the the
International Committee of Taxonomy of Viruses. Elsevier/Academic Press,
London.
21. Trujano, M., G. Iglesias, J. Segales, and J. M. Palacios. 2001. PCV-2 from
emaciated pigs in Mexico. Vet Rec 148:792.
22. Walker, I. W., C. A. Konoby, V. A. Jewhurst, I. McNair, F. McNeilly, B. M.
Meehan, T. S. Cottrell, J. A. Ellis, and G. M. Allan. 2000. Development and
application of a competitive enzyme-linked immunosorbent assay for the
detection of serum antibodies to porcine circovirus type 2. J Vet Diagn Invest
12:400-5.
1
/
4
100%