L DOSSIER

30 | La Lettre du Gynécologue ̐ n° 367 - décembre 2011
DOSSIER Les thérapies fœtales
L
a mise en évidence d’un goitre fœtal à l’écho-
graphie est une pathologie rare et potentiel-
lement grave. Elle résulte d’un déséquilibre
hormonal chez le fœtus qui, en l’absence de trai-
tement, peut se révéler très préjudiciable pour son
développement psychomoteur futur.
Le goitre fœtal est généralement la conséquence
d’une pathologie thyroïdienne maternelle. Il faudra
alors dissocier les effets délétères de l’hyper- ou de
l’hypothyroïdie maternelle sur le déroulement de
la grossesse, des perturbations hormonales chez le
fœtus, plus souvent secondaires à un traitement
maternel ou à ses auto-anticorps, et responsables
d’un goitre et d’un éventuel retard de développement.
Thyroïde fœtale
et hormones thyroïdiennes
Thyroïde fœtale
Le développement embryonnaire de la thyroïde
fœtale commence dès la 3
e
semaine, sous forme d’un
épaississement du plancher de l’intestin pharyngien
sur la ligne médiane. Par la suite, l’ébauche thyroï-
dienne descend en avant de l’intestin pharyngien,
pour atteindre, à 7 semaines, sa situation définitive
en avant de la trachée. Elle sera rejointe par un dérivé
de la 4e poche pharyngobranchiale, qui donnera nais-
sance aux cellules parafolliculaires C. La synthèse de
thyroglobuline commence dès 12 SA. La maturité
structurale de la glande est complète vers 18 SA, date
à laquelle les premiers follicules remplis de colloïde
deviennent visibles, la synthèse d’hormones thyroï-
diennes devenant significative vers 20-22 SA.
Hormones thyroïdiennes maternelles
et fœtales
La thyroïde fœtale est partiellement soumise aux
différents paramètres thyroïdiens maternels, par
l’intermédiaire du placenta partiellement perméable
à l’iode et à la thyroxine (T4) maternelle, mais parfai-
tement imperméable à la thyréostimuline (TSH).
Pour autant, si la T4 traverse le placenta à un taux
physiologiquement significatif, celui-ci peux rester
insuffisant pour compenser une hypothyroïdie fœtale
(1, 2), et, à l’inverse, les désiodinases présentes dans
le placenta permettent d’éviter une thyréotoxicose
fœtale secondaire à une hyperthyroïdie maternelle.
De même, le placenta est perméable aux anticorps
maternels, dont les anticorps antirécepteurs à la TSH
(TRAK), qui passent librement, soumettant ainsi la
thyroïde fœtale à leur action activatrice (ou excep-
tionnellement inhibitrice). Enfin, les antithyroïdiens
de synthèse (ATS) pris par la mère peuvent également
freiner la thyroïde fœtale, tandis que la lévothyroxine
ne traverse que très faiblement le placenta.
Or, les hormones thyroïdiennes ont un rôle fonda-
mental dans le développement cérébral fœtal, du
point de vue structurel d’une part (organisation
tissulaire, migration neuronale), et du point de vue
fonctionnel d’autre part (acquisition de l’intelligence,
capacité d’apprentissage) [3].
Bien que le dépistage systématique en post-natal
permette un diagnostic et un traitement précoce de
l’hypothyroïdie, avec développement neurodévelop-
pemental normal dans la plupart des cas, certains
déficits neurologiques et intellectuels ont malgré tout
été décrits chez des enfants traités précocement pour
hypothyroïdie. En effet, la sévérité de l’hypothyroïdie
fœtale semble corrélée avec le devenir intellectuel
de ces enfants (2, 4, 5). Le dépistage et le traitement
d’un goitre hypothyroïdien fœtal pourraient donc
prévenir ces déficits.
Par ailleurs, si la contribution maternelle en T4 fœtale
est indispensable au développement du fœtus, une
hyperthyroïdie fœtale (via les TRAK maternels dans
10 % des cas de maladie de Basedow) peut avoir des
conséquences développementales aussi dramatiques
que l’hypothyroïdie fœtale.
Conséquences obstétricales et fœtales
des dysthyroïdies maternelles
◆Hypothyroïdie maternelle
L’hypothyroïdie peut avoir des répercussions
majeures sur le déroulement de la grossesse, avec
risque accru d’accouchement prématuré, de pré-
éclampsie, de petit poids de naissance, de fausse
Thérapie fœtale : goitre fœtal
Fetal goiter
Bérénice Depont*, Dominique Luton*
* Hôpital Beaujon, AP-HP, univer-
sité Paris 7.

La Lettre du Gynécologue ̐ n°367 - décembre 2011 | 31
Points forts
couche spontanée et de retard psychomoteur de
l’enfant (3). En effet, les enfants dont la mère présen-
tait une TSH élevée pendant la grossesse auraient
un QI significativement plus bas que les enfants de
mères euthyroïdiennes (6), de même chez les enfants
dont la mère avait une T4 basse (7).
◆Hyperthyroïdie maternelle
Comme l’hypothyroïdie, l’hyperthyroïdie majore
certains risques obstétricaux : fausse couche, anomalies
congénitales mineures (craniosténose), prééclampsie,
accouchement prématuré, petit poids de naissance,
dysfonction thyroïdienne néonatale et mortalité péri-
natale. Les complications maternelles de l’hyperthy-
roïdie sont liées au risque de crise aiguë thyréotoxique,
comme l’arythmie, voire l’insuffisance cardiaque.
Goitre fœtal
Circonstances de découverte
Un goitre fœtal peut être associé à une hypo- ou,
plus rarement, à une hyperthyroïdie fœtale, elles-
mêmes pouvant être secondaires à une pathologie
thyroïdienne maternelle. C’est un faisceau d’argu-
ments cliniques, biologiques, échographiques,
maternels et fœtaux, qui permettra à l’obstétricien
d’évoquer une origine hypo- ou hyperthyroïdienne
à ce goitre, et de traiter le fœtus in utero.
◆Dysthyroïdie maternelle connue
Hypothyroïdies
On n’a pas décrit de goitre lié au retentissement fœtal
d’une hypothyroïdie maternelle, telle qu’une thyroï-
dite auto-immune non ou mal substituée (thyroïdite
de Hashimoto) [8]. En revanche, une hypertrophie de
la glande thyroïdienne a pu être observée (9).
Hyperthyroïdies
L’étiologie principale est la maladie de Basedow, pour
laquelle la présence d’auto-anticorps activateurs
(TRAK) et/ou d’un traitement par ATS (tous 2 passant
la barrière placentaire) expose le fœtus aux risques
d’une hypo- ou d’une hyperthyroïdie anténatale et
néonatale. Les situations à risque sont donc multiples :
– maladie de Basedow traitée par ATS ;
– maladie de Basedow avec TRAK positifs ;
– patientes ayant été traitées de leur Basedow par
chirurgie ou iode radioactif mais gardant des TRAK
positifs ;
– autres hyperthyroïdies traitées par ATS.
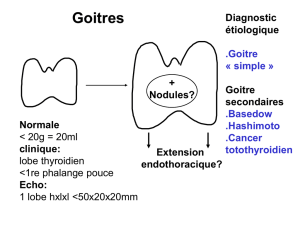
◆Goitre échographique
Devant une image cervicale, il faut avant tout
éliminer les diagnostics différentiels tels que les
tératomes, hémangiomes ou neuroblastomes (10).
➤Techniques de mesure de la thyroïde fœtale.
La thyroïde est caractérisée échographiquement par
une image tissulaire de la partie antérieure du cou. Sa
mesure est standardisée, permettant un monitorage
tout au long de la grossesse, en se reportant à la
courbe du périmètre thyroïdien publiée par Ranzini
(11). Elle sera facilitée en présence d’un goitre,
cependant, elle reste difficile avant 18-20 SA. Elle
sera réalisée sur une coupe transversale du cou, à fort
grossissement, dont le plan orthogonal sera objectivé
par la présence d’une vertèbre symétrique (en “V”) et
de la trachée en avant. La hauteur du plan de coupe
sera ajustée après avoir repéré le cartilage cricoïde
(ligne anéchogène en “C” en arrière de la trachée) :
la thyroïde se trouve juste en dessous, entourant
la trachée (de forme ronde à ce niveau), et limitée
latéralement par les carotides, qui pourront être
repérées au Doppler couleur. Le périmètre, incluant
la trachée, peut être tracé manuellement ou grâce
au mode ellipse. Un goitre se définit par une mesure
supérieure à 2 MoM (ou > 95e percentile) [9].
Prise en charge initiale
La découverte fortuite d’un goitre hypothyroïdien
en l’absence de traitement maternel par ATS ou
de contexte immun est le plus souvent associée
à un trouble de l’hormonogenèse (1/40 000 nais-
sances) [13]. En revanche, un goitre hyperthyroïdien
a jusqu’à présent toujours été associé à une patho-
logie maternelle. Même s’il existe de très rares cas
d’hyperthyroïdies congénitales sévères par mutation
activatrice de novo dans le gène du récepteur à la
TSH, ils n’ont pas été décrits in utero.
La découverte d’un goitre fœtal nécessite la mise en
place d’une prise en charge multidisciplinaire. L’obs-
tétricien devra agir en concertation avec l’endocrino-
logue afin d’optimiser ses choix thérapeutiques tout
en respectant l’équilibre de la fonction thyroïdienne
Mots-clés
Goitre fœtal
Hypothyroïdie
Hyperthyroïdie
»Les hormones thyroïdiennes ont un rôle fondamental dans le développement cérébral fœtal.
»Un goitre fœtal peut être associé à une hyper- ou à une hypothyroïdie fœtale.
»La cordocentèse n'est pas systématique. Elle est réalisée lorsqu'un doute persiste sur l'origine du
goitre selon le contexte clinique et l'échographie.
»
En cas d'hypothyroïdie fœtale, un traitement substitutif devra être considéré après avoir arrêté ou
réduit au minimum les antithyroïdiens de synthèse (ATS).
»Le fœtus hyperthyroïdien pourra être traité par ATS.
»La prise en charge périnatale nécessite une équipe pluridisciplinaire expérimentée.
Highlights
– Thyroid hormones play an
essential role in fetal brain
development.
– Fetal goiter can be associated
with fetal hyper- or hypothy-
roidism.
– Cordocentesis is not indicated
in every case. It is performed
when there is doubt regarding
the origin of the goiter, based
on the clinical picture and the
ultrasound.
– In case of fetal hypothy-
roidism, hormone replacement
treatment should be consid-
ered, once treatment with
synthetic antithyroid agents
(SATs) has been stopped or
reduced to a minimum.
– Fetal hyperthyroidism can be
treated using SATs.
– Perinatal management
requires an experienced multi-
disciplinary team.
Keywords
Fetal Goiter
Hypothyroidism
Hyperthyroidism

32 | La Lettre du Gynécologue ̐ n° 367 - décembre 2011
DOSSIER Les thérapies fœtales
maternelle. Dans un second temps, il devra préparer
avec le pédiatre la prise en charge post-natale de
l’enfant. Un bilan thyroïdien sera systématiquement
dosé au cordon.
◆Bilan maternel
C’est la première étape de l’exploration d’un goitre fœtal.
➤
L’interrogatoire recherchera des arguments en
faveur d’une pathologie thyroïdienne antérieure
à la grossesse (notamment des signes de maladie
de Basedow), et pourra identifier une éventuelle
surcharge en iode, par le biais de certains traitements
maternels en particulier.
➤
Le bilan thyroïdien initial comprend les dosages
de T3, T4, TSH, des TRAK et des anticorps anti-TPO.
➤
L’échographie thyroïdienne maternelle sera
décidé en fonction du bilan, de la clinique et de
l’avis d’un endocrinologue (goitre vasculaire, goitre
multinodulaire, nodule toxique, etc.).
◆Bilan échographique fœtal en cas de goitre
avéré
➤
Le Doppler couleur (13 cm/sec) de la thyroïde
n’a d’intérêt qu’en cas de goitre, il sera interprété
en l’absence totale du moindre mouvement fœtal
(risque de faux positif, d’hypervascularisation globale
due aux mouvements incessants de la gorge du fœtus
hypothyroïdien) et selon le contexte général maternel.
➤
Maturation osseuse. Selon l’état d’imprégnation
hormonale fœtale, la vitesse de maturation osseuse
pourra être modifiée. Les points de Béclard, Todt et
huméral supérieur seront recherchés et analysés en
fonction de l’âge gestationnel, dès 25 SA si les TRAK sont
positifs et à partir de 32 SA si traitement par ATS seul.
➤
La fréquence cardiaque est rarement modifiée,
mais retenons que la constatation d’une tachycardie
fœtale constitue un signe d’alarme.
◆But du traitement
Le but premier du traitement est de maintenir l’euthy-
roïdie maternelle, voire une légère hyperthyroïdie, afin
de minimiser les conséquences obstétricales d’une
hypo- ou d’une hyperthyroïdie maternelle. Le traite-
ment a également pour but de restaurer l’euthyroïdie
fœtale afin d’éviter les complications néonatales liées
à une dysthyroïdie et à un éventuel retentissement
sur le développement psychomoteur à long terme.
En cas de goitre hypothyroïdien, la mise en place d’un
traitement substitutif fœtal devra être considérée, et
le fœtus hyperthyroïdien pourra être traité par ATS.
Enfin, le traitement permet le plus souvent de faire
régresser le goitre fœtal et d’éviter les complications
obstétricales mécaniques qui en découlent.
Goitre hypo- ou goitre hyperthyroïdien ?
◆Arguments cliniques et biologiques maternels
En faveur d’un goitre hypothyroïdien : la mise en évidence
d’une exposition fœtale à des agents ou médicaments
goitrogènes : ATS chez une hyperthyroïdienne à TRAK
négatifs ou T4 basse (2 tiers inférieurs de la normale,
témoignant d’un traitement par ATS trop important),
ou surcharge iodée iatrogène.
En faveur d’un goitre hyperthyroïdien : il s’agit dans ce cas
d’une mère ayant ou ayant eu une maladie de Basedow
(antécédents et/ou tachycardie de repos, tremblements,
éclat du regard, paupières rétractées, exophtalmie et
goitre vasculaire) avec des TRAK positifs (14).
◆Arguments échographiques
➤
Doppler couleur : en cas de goitre hypothyroïdien,
le flash sera périphérique, tandis qu’en cas de goitre
hyperthyroïdien, le flash sera total par hypervascu-
larisation parenchymateuse.
➤
Maturation osseuse : un retard d’apparition des
points d’ossification sera en faveur d’un goitre hypo-
thyroïdien. À l’inverse, une avance de maturation
sera en faveur d’un goitre hyperthyroïdien.
➤
Mobilité fœtale : une hyperactivité fœtale
(mouvements incessants) est paradoxalement
retrouvée en cas de goitre hypothyroïdien, alors
qu’elle est normale en cas de goitre hyperthyroïdien.
➤
Fréquence cardiaque : normale, elle n’oriente pas
le diagnostic ; en particulier, il n’y a pas de brady-
cardie en cas de goitre hypothyroïdien. En revanche,
une tachycardie est un signe tardif d’alarme évoca-
teur d’un goitre associé à une hyperthyroïdie fœtale.
◆Cordocentèse
Sa réalisation n’est pas systématique, mais plutôt
lorsqu’un doute persiste sur l’origine du goitre fœtal,
afin d’effectuer un dosage des hormones thyroïdiennes
chez le fœtus, et des TRAK s’ils sont présents chez la
mère. Les risques de iatrogénie (hémorragie, infec-
tion, bradycardie, rupture prématurée des membranes,
voire mort fœtale in utero dans 0,5 à 9 % des cas)
[15] doivent être mis en balance avec les possibilités
d’un traitement empirique sur les arguments sus-cités.
L’apport de l’échographie dans l’identification du type
de dysthyroïdie fœtale est donc fondamental, certaines
équipes proposant même l’utilisation de scores écho-
graphiques. En pratique, la cordocentèse est réalisée
dans environ 50 % des cas (16). Le dosage de la TSH
dans le liquide amniotique est possible, mais les taux,
d’une grande variabilité, ne permettent pas de suivi
précis (16) et, bien souvent, ne reflètent pas la fonction
thyroïdienne fœtale (17).
Références
bibliographiques
1. Kempers MJ, van der Sluijs Veer L et
al. Neonatal screening for congenital
hypothyroidism in the Netherlands:
cognitive and motor outcome at 10
years of age. J Clin Endocrinol Metab
2007;92:919-24.
2. Glorieux J, Dussault J, Van Vliet
G. Intellectual development at age
12 years of children with conge-
nital hypothyroidism diagnosed
by neonatal screening. J Pediatr
1992;121:581-4.
3. Pop VJ, Kuijpens JL, Van Baart AL
et al. Low maternal free thyroxine
concentrations during early pregnancy
are associated with impaired psycho-
motor development in infancy. Clin
Endocrinol 1999;50:149-55.
4. Rovet J, Daneman D. Congenital
hypothyroidism: a review of current
diagnostic and treatment practices in
relation to neuropsychologic outcome.
Paediatr Drugs 2003;5:141-9.
5. Abuhamad AZ, Fisher DA, Warsof
SL et al. Antenatal diagnosis and
treatment of fetal goitrous hypothy-
roidism: case report and review of the
literature. Ultrasound Obstet Gynecol
1995;6:368-71.
6. Haddow JE, Palomaki GE, Allan
WC et al. Maternal thyroid deficiency
during pregnancy and subsequent
neuropsychological development of
the child. N Engl J Med 1999;341:549-
55.
7. Pop VJ, Brouwers EP, Vader HL et al.
Maternal hypothyroxinaemia during
early pregnancy and subsequent
child development: a 3-year follow-
up study. Clin Endocrinol (Oxf)
2003;59:282-8.
8. Zimmerman D. Fetal and
neonatal hyperthyroidism. Thyroid
1999;9:727-33.
9. Luton D, Alberti C, Vuillard E,
Ducarme G, Oury JF, Guibourdenche
J. Iodine deficiency in Northern Paris
Area: impact on fetal thyroid mensura-
tion. Plos One 2011;6:e14707.
10. Suchet IB. Ultrasonography of
the fetal neck in the second and
third trimesters. Part 3. Anomalies
of the anterior and anterolateral
nuchal region. Can Assoc Radiol J
1995;46:426-33.
11. Ranzini AC, Ananth CV, Smulian
JC et al. Ultrasonography of the fetal
thyroid: normograms based on bipa-
rietal diameter and gestational age. J
Ultrasound Med 2001; 20:613-7.
12. Luton D, Le Gac I, Vuillard E et al.
Management of Graves’ disease during
pregnancy: the key role of fetal thyroid
gland monitoring. J Clin Endocrinol
Metab 2005; 90:6093-8.
13. Macchia PE, De Felice M, Di Lauro
R. Molecular genetics of congenital
hypothyroidism. Curr Opin Genet Dev
1999;9:289-94.
14. Zakarija M, McKenzie

La Lettre du Gynécologue ̐ n°367 - décembre 2011 | 33
DOSSIER
Conséquences obstétricales
Un goitre fœtal peut entraîner une gène à la déglutition
du fœtus et être responsable d’un hydramnios, lui-
même responsable d’un risque de rupture prématurée
des membranes et d’accouchement prématuré. De plus,
un goitre volumineux peut également être source de
compression trachéale, avec un risque d’asphyxie et de
décès à l’accouchement. Enfin, le goitre pourra égale-
ment être source de dystocie en per-partum par le biais
de l’hyperextension du cou, et donc empêcher l’accou-
chement par voie vaginale (17, 18). Ces complications
potentielles soulignent l’importance du traitement in
utero du goitre, indépendamment des complications
associées à la dysfonction thyroïdienne fœtale.
Prise en charge d’un goitre hypothyroïdien
En premier lieu, une adaptation du traitement par
ATS sera réalisée avec le concours de l’endocrino-
logue. Cette adaptation consiste à réduire les doses
au maximum et, si possible, arrêter les ATS afin de
limiter le freinage de la thyroïde fœtale. Dans le cas
d’une hypothyroïdie antérieure, connue et traitée par
L-thyroxine, une augmentation des doses est néces-
saire au cours de la grossesse, ainsi qu’une surveil-
lance de la TSH, commencée le plus précocement
possible. Lorsque l’hypothyroïdie n’est pas traitée, un
traitement par L-thyroxine sera mis en place afin de
diminuer les risques de complications obstétricales
et pédiatriques, comme cela a été démontré dans
certaines études (6, 20). Ce premier temps peut suffire
à réduire le goitre fœtal.
Dans un second temps, en cas de persistance du goitre
et/ou de mauvaise tolérance maternelle, un traite-
ment par L-thyroxine en injection intra-amniotique
pourra être débuté. Cette méthode, mise en place par
Weiner il y a 30 ans (21), est désormais largement
utilisée. Mais les cas publiés (16, 22) témoignent d’une
grande variabilité des modalités thérapeutiques, en
termes de doses de L-thyroxine (de 50 à 800 mg/
injection, correspondant aux besoins fœtaux estimés
à 10 mg/kg/j), mais également en termes de nombre
d’injections (de 1 à 6) et de fréquence des injections
(toutes les 1 à 4 semaines). La L-thyroxine est avalée
par le fœtus, et l’on constate une augmentation des
taux circulants de T4 dans les études contrôlant le
bilan thyroïdien fœtal par cordocentèses itératives
(22, 23).
Le suivi sera réalisé par monitorage hebdomadaire de la
taille échographique du goitre fœtal (12), afin d’évaluer
l’efficacité du traitement et d’ajuster la prise en charge
(dose et fréquence des injections). Le bilan thyroïdien
maternel sera également surveillé de façon adaptée.
Les résultats de cette prise en charge sont le plus
souvent satisfaisants en ce qui concerne la réduc-
tion de la taille du goitre, y compris dans les cas de
goitres, souvent volumineux, associés à un trouble
de l’hormonogenèse. En revanche, les résultats sont
plus hasardeux pour ce qui est de la normalisation
du bilan thyroïdien fœtal et néonatal (16, 21).
À long terme, des études sont nécessaires afin de
comparer le développement psychomoteur de ces
fœtus hypothyroïdiens avec ou sans traitement par
L-thyroxine, et de déterminer si celui-ci permet
d’éviter certains déficits, même mineurs, que l’on
peut encore observer actuellement.
Prise en charge d’un goitre
hyperthyroïdien
Le premier temps du traitement sera le même que pour
le goitre hypothyroïdien, avec adaptation thérapeu-
tique, de concert avec l’endocrinologue. Cet ajustement
du traitement maternel par ATS permettra de traiter à
la fois la mère et le fœtus, puisque les ATS traversent le
placenta . Un traitement par injection intra-amniotique
ne sera donc pas nécessaire dans ce cas.
Les doses d’ATS seront initialement adaptées au statut
thyroïdien maternel, en commençant par 150 mg/j de
propylthiouracil (PTU), voire 300 mg/j si la mère est
hyperthyroïdienne. Les doses pourront être augmentées
par la suite, jusqu’à 450 mg/j, en fonction de la réponse
thérapeutique évaluée sur la taille du goitre. Dans de
rares cas, la dose d’ATS nécessaire au fœtus peut néces-
siter une substitution maternelle par L-thyroxine. Le
suivi sera le même qu’en cas de goitre hypothyroïdien,
et permettra d’adapter les doses maternelles d’ATS. Les
résultats de cette prise en charge dans la littérature sont
satisfaisants, avec régression du goitre in utero et euthy-
roïdie fœtale néonatale dans la plupart des cas (8, 24).
Conclusion
Les enjeux de la prise en charge d’un goitre fœtal
sont donc importants et nécessitent que les situa-
tions à risque soient reconnues et prises en charge au
sein d’une équipe médicale multidisciplinaire expé-
rimentée. Le pivot central de cette prise en charge est
l’échographie de la thyroïde fœtale, tant à l’échelle
du dépistage des fœtus à risque et du diagnostic de
la dysfonction thyroïdienne fœtale, que lors de la
surveillance d’un goitre en cours de traitement. La
prise en charge néonatale requiert également une
grande expertise médicale. ■
Références
bibliographiques
JM.Pregnancy-associated changes in
the thyroid-stimulating antibody of
Graves’ disease and the relationship
to neonatal hyperthyroidism. J Clin
Endocrinol Metab 1983; 57:1036-40.
15. Perrotin F, Sembely-Taveau C,
Haddad G et al. Prenatal diagnosis
and early in utero management of
fetal dyshormonogenetic goiter. Eur
J Obstet Gynecol Reprod Biol 2001;
94:309-14.
16. Volumenie JL, Polak M,
Guibourdenche J et al. Management of
feta thyroid goiters. A reportof eleven
cases in a single perinatal unit. Prenat
Diagn 2000; 20:799-806
17. Ribault V, Castanet M, Bertrand AM
et al. Experience with Intraamniotic
Thyroxine Treatment in Nonimmune
Fetal Goitrous Hypothyroidism in
12 Cases. J Clin Endocrinol Metab
2009;94:3731-9.
18. Reynolds BC, Simpson JH,
Macara L et al. Kubba H, Donaldson
MD,Pohlen J2006Goitrous congenital
hypothyroidism inatwin pregnancy
causing respiratory obstruction at
birth: implications for management.
Acta Paediatr 95:1345-8.
19. Mirsaeid Ghazi AA, Ordookhani
A, Pourafkari M et al. Intrauterine
diagnosis and management of fetal
goitrous hypothyroidism: a report of
an Iranian family with three consecu-
tive pregnancies complicated by fetal
goiter. Thyroid 2005;15:1341-7.
20. Hallengren B, Lantz M, Andreasson
B et al. Pregnant women on thyroxine
substitution are often dysregu-
lated in early pregnancy. Thyroid
2009;19:391-4.
21. Weiner S, Scharf JI, Bolognese RJ,
Librizzi RJ. Antenatal diagnosis and
traitment of fetal goiter. J Reprod
Med 1980;24:39-42.
22. Bliddal S, Krogh Rasmussen A,
Sundberg K, Brocks V, Skovbo P, Feldt-
Rasmussen U. Graves’ disease in two
pregnancies complicated by fetal
goitrous hypothyroidism: successful
in utero treatment with levothyroxine.
Thyroid 2011; 21:75.
23. Duclos B, Ville Y, Lenclen R, Paupe
A. Conduite à tenir en présence d’un
goitre fœtal hypothyroïdien. À propos
de trois observations. Gynecol Obstet
Fertil 2006; 34:34-7.
24. Srisupundit K, Sirichotiyakul S,
Tongprasert F, Luewan S, Tongsong
T. Fetal therapy in fetal thyrotoxi-
cosis: a case report. Fetal Diagn Ther
2008;23:114-6.
25. Glinoer D. Potential consequences
of maternal hypothyroidism on the
offspring: evidence and implications.
Horm Res 2001; 55:109-14.
1
/
4
100%