A Grossesse après cancer du sein dans un contexte de mutation

20 | La Lettre du Sénologue ̐ n° 55 - janvier-février-mars 2012
DOSSIER THÉMATIQUE Grossesse et cancer du sein
* Département d’oncologie radio-
thérapie, Institut Curie, Paris.
Grossesse après cancer du sein
dans un contexte de mutation
des gènes BRCA1 ou BRCA2
Pregnancy after breast cancer in BRCA1/2 mutation carriers
Anne de la Rochefordière*
A
ucune étude n’a spécifiquement examiné
l’influence pronostique d’une grossesse post-
thérapeutique chez les patientes porteuses
d’une altération délétère des gènes BRCA1 ou BRCA2.
Les données collectées portent essentiellement sur le
rôle d’une grossesse chez des patientes non atteintes
d’un cancer, mais présentant une mutation génétique
favorisant la survenue d’un cancer du sein ou d’un
cancer de l’ovaire. Les études à ce sujet sont contra-
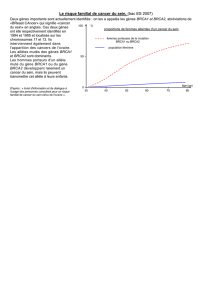
dictoires. L’une d’elles a montré que le risque de cancer
du sein est proportionnel à la parité (1). Ces résultats
sont contredits par une autre étude rétrospective, plus
large, de Cullinane et al. (2) montrant une diminution
de 38 % du risque de survenue d’un cancer du sein
chez les femmes multipares comparées aux femmes
nullipares dans un contexte BRCA1+. À l’inverse, le
risque de cancer du sein survenant avant l’âge de 50
ans semble proportionnel à la parité chez les femmes
porteuses d’une altération du gène BRCA2, ce risque
étant augmenté dans les 2 ans suivant l’accouche-
ment, mais de façon non significative (RR : 1,70 ; IC95 :
0,97-2,99) [3].
En pratique, il n’existe actuellement pas de restriction
particulière à un projet de grossesse post-thérapeu-
tique dans un contexte de mutation génétique. Il
est essentiel de réaliser un bilan local complet par
IRM mammaire, mammographie et échographie
mammaire dans les 4 mois précédant le projet de
conception. Rappelons que le bilan mammaire doit
être réalisé au maximum à 1 an d’intervalle. On pourra
donc envisager un bilan clinique et morphologique
mammaire par mammographie et échographie
mammaire avec protection abdominale plombée
durant la grossesse à 1 an du précédent bilan.
L’allaitement est-il possible
après un cancer du sein ?
L’allaitement est particulièrement favorable au bon déve-
loppement du nourrisson, réduisant le taux d’infections
néonatales, des allergies, des maladies auto-immunes
et le risque d’obésité (4). Il n’existe aucun élément
publié démontrant que la lactation augmenterait le
risque de rechute d’un cancer du sein ou la survenue
d’un cancer controlatéral. Une étude suédoise a montré
l’absence d’effet délétère de l’allaitement sur l’évolution
du cancer du sein, voire l’association non significative
à une augmentation de la survie globale chez les 30 %
de patientes qui avaient allaité dans les suites de leur
accouchement (5). De ce fait, les femmes traitées pour
un cancer du sein unilatéral sont maintenant encoura-
gées à allaiter du côté du sein non traité (6, 7).
Le sein traité par radiothérapie antérieure présente
généralement une lactation pauvre, voire inexistante (6,
8). La jeune mère doit cependant toujours être rassurée
par une production lactée unilatérale qui sera suffi-
sante pour allaiter son nourrisson. Elle doit modifier
régulièrement la position de la tétée pour obtenir un
drainage optimal de toutes les portions de la glande
mammaire. La surveillance clinique, voire morpho-
logique est difficile durant la période d’allaitement
et peut potentiellement rendre difficile la détection
d’une rechute locale ou controlatérale (9).
Il est donc souhaitable de limiter la période d’allai-
tement de manière à reprendre une surveillance
mammaire efficace. Cette limitation est particulière-
ment importante chez les jeunes femmes porteuses
d’une altération des gènes BRCA1 ou BRCA2 dont le
risque annuel d’apparition d’un cancer controlatéral
est de l’ordre de 3 à 4 %. L’imagerie IRM peut être
modifiée par la lactation, mais doit être reprise, comme

La Lettre du Sénologue ̐ n° 55 - janvier-février-mars 2012 | 21
Points forts Mots-clés
Grossesse après
cancer du sein
BRCA1 BRCA2 et
grossesse
Allaitement après
cancer du sein
la mammographie et l’échographie mammaire, dès la
fin de l’allaitement.
Risque de fausse couche après
chimiothérapie ou d’anomalie
génétique
Le traitement locorégional mammaire par radiothé-
rapie est sans effet sur la grossesse post-thérapeutique,
qu’il s’agisse du risque d’accouchement prématuré, du
taux de fausses couches, du poids de naissance ou de
l’anomalie génétique (5, 10-14).
L’interruption thérapeutique de grossesse doit être
conseillée si cette dernière survient en cours de radio-
thérapie. Aucune étude n’a rapporté l’expérience de
grossesses menées dès la fin de la radiothérapie. Il est
généralement recommandé aux patientes d’attendre
1 an après la fin de l’irradiation avant d’envisager de
commencer la grossesse, sans que cette recomman-
dation soit formelle. En effet, le risque d’irradiation du
fœtus n’existe plus dès l’arrêt définitif de l’irradiation (15).
Les conséquences de l’administration d’une chimio-
thérapie ou d’une hormonothérapie sur la fertilité des
femmes de plus de 30 ans ne sont pas négligeables et
sont abordées dans un autre chapitre de ce journal.
Compte tenu du temps nécessaire à la maturation
ovocytaire après altération des ovocytes primordiaux,
il est préconisé de patienter au moins 6 mois après la
fin d’une chimiothérapie avant de commencer une
grossesse (en dehors des recommandations liées aux
facteurs pronostiques) [16].
Deux études contradictoires ont porté sur les événe-
ments péjoratifs survenus lors de la grossesse après
chimiothérapie d’un cancer du sein. L’étude danoise
de Langagergaard et al. (13) – réalisée sur 216 nais-
sances post-thérapeutiques et 33 443 naissances
issues de femmes sans antécédent de cancer du sein
– n’a pas mis en évidence d’augmentation significa-
tive du risque de prématurité, de fausse couche, de
faible poids de naissance ou d’anomalie congénitale
en rapport avec un antécédent de chimiothérapie.
À l’inverse, l’étude suédoise de Dalberg et al. (5) –
comparant 331 naissances après traitement d’un
cancer du sein à une population de femmes sans anté-
cédent de cancer, ajustée sur l’âge, la parité, l’année
de l’accouchement – a constaté une augmentation
significative du risque d’accouchement prématuré à
moins de 32 semaines de grossesse (RR : 3,2 ; IC95 :
1,7-6,0), 32 et 36 semaines de grossesse (RR : 1,5 ; IC95 :
1,0-2,3), faible poids de naissance (< 1,5 kg ; RR : 2,9 ;
IC95 : 1,4-5,8) et de malformations congénitales (RR :
1,7 ; IC
95
: 1,1-2,5).Celles-ci étaient plus particulière-
ment observées dans la période d’étude la plus récente
(1988-2002), période durant laquelle les traitements
systémiques avaient plus souvent été utilisés. Seul
1 enfant parmi les 331 présentait un syndrome de Dow.
En outre, le risque de complications de la délivrance
était plus élevé (RR : 1,5 ; IC
95
: 1,2-1,9), ainsi que le
taux de césariennes (RR : 1,3 ; IC95 : 1,0-1,7).
Ces 2 études ne détaillaient pas les modalités théra-
peutiques locales ou systémiques. Quoi qu’il en soit, les
résultats de l’étude suédoise incitent à recommander la
surveillance étroite de la grossesse des femmes traitées
par chimiothérapie pour un cancer du sein, et de prévoir
une surveillance toute particulière de l’accouchement
et de ses suites. Bien que le tamoxifène et le létrozole
soient utilisés dans le cadre de la stimulation ovocytaire,
les effets tératogènes d’une hormonothérapie durant
le déroulement d’une grossesse font recommander
d’attendre un minimum de 2 mois après l’arrêt de tout
traitement hormonal avant la conception (17). ■
1. Narod SA. Modifiers of risk of hereditary breast and ovarian
breast cancer. Nat Rev Cancer 2002;2:113-23.
2. Cullinane CA, Lubinski J, Neuhausen SL et al.
Effect of pregnancy as a risk factor for breast cancer
in BRCA1 or BRCA2 mutation carriers. Int J Cancer
2005;117:988-91.
3. Andrieu N, Goldgar DE, Eaton DF et al. Pregnancies,
breast-feeding, and breast cancer risk in the international
BRCA1 and BRCA2 Carrier Cohort Study (IBCCS). J Natl
Cancer Inst 2006;95:535-44.
4. Zembo CT. Breastfeeding. Obstet Gynecol Clin N Am
2002;20:51-76.
5. Dalberg K, Eriksson J, Holmberg L. Birth outcome in
women with previously treated breast cancer-a popu-
lation-based cohort study from Sweden. PLoS Med
2006;3:e336.
6. Azim HA, Bellettini G, Gelber S et al. Breast-feeding after
breast cancer: if you wish, madam. Breast Cancer Res Treat
2009;114:7-12.
7. Gorman JR, Usita PM, Madlensky L et al. A qualitative
investigation of breast cancer survivors’ experience with
breastfeeding. J Cancer Surviv 2009;3:181-91.
8. Riordan J, Gill-Hopple K, Angeron J. Indicators of effec-
tive breastfeeding and estimates of breast milk intake. J
Hum Lact 2005;21:406-12.
9. Obenauer S, Dammert S. Palpable masses in breast
during lactation. Clin Imaging 2007;31:1-5.
10. Dow KH, Harris JR, Roy C. Pregnancy after breast-
conserving treatment. J Natl Cancer Inst Monogr
1994;16:131-7.
11. Malamos NA, Stahopoulos GP, Keramopoulos A et al.
Pregnancy and offsprings after the appearance of breast
cancer. Oncology 1996;53:471-5.
12. Velentgas P, Daling JR, Malone KE et al. Pregnancy after
breast cancer carcinoma-outcomes and influence on morta-
lity. Cancer 1999;85:2424-32.
13. Langagergaard V, Gislum M, Skriver MV et al. Birth
outcome in women with breast cancer. Br J Cancer
2006;94:142-6.
14. Kroman N, Jensen MB, Wohlfahrt J et al. Pregnancy after
treatment of breast cancer – A population-based study on
behalf of Danish Breast Cancer Cooperative Group. Acta
Oncologica 2008;47:545-9.
15. Fenig E, Mishaeli M, Kalish Y et al. Pregnancy and radiation.
Cancer treatment review 2001;27:1-7.
16. Oktay K, Sommezer M. Chemotherapy and amenorrhea:
risks and treatment options. Curr Opin Obstet Gynecol
2008;20:408-15.
17. Pagani O, Partridge A, Korde L et al. Pregnancy after
breast cancer: if you wish, ma'am. Breast Cancer Res Treat
2011;129:309-17.
Références bibliographiques
Highlights
Currently, BRCA1 or BRCA2
gene mutation is not a contra-
indication to project a pregnancy
following breast carcinoma. It is
essential to achieve a complete
local as well as distant disease
assessment, including breast
clinical examination, MRI,
mammograms as well as breast
ultrasound, in the 4 months
preceding pregnancy.
Breastfeeding is feasible without
influence on the prognosis of
breast cancer. The duration
must be limited to allow the
resumption of the radiological
follow-up.
Cardiac ultrasound, as well as
close monitor of the pregnancy
and childbirth are recommended
in patients previously treated
with anthracyclines systemic
treatment
Keywords
Pregnancy after breast cancer
BRCA1 BRCA2 and pregnancy
Breastfeeding following breast
cancer
»Actuellement, il n’existe pas de contre-indication particulière à un projet de grossesse post-thérapeutique dans
un contexte de mutation du gène BRCA1 ou BRCA2. Il est essentiel de réaliser un bilan local et métastatique complet
incluant la palpation, l’IRM mammaire, la mammographie et l’échographie mammaire dans les 4 mois précédant le
projet de conception.
»
L’allaitement est tout à fait envisageable, sans influence sur le pronostic du cancer du sein. Sa durée doit être
limitée pour permettre la reprise de la surveillance radiologique.
»Il est souhaitable de réaliser un bilan cardiaque et de surveiller étroitement la grossesse et l’accouchement des
femmes traitées par anthracyclines pour un cancer du sein.
1
/
2
100%