M i s e a u ... Hormone de croissance,

Mise au point
Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume V, n° 2, mars-avril 2001
61
hormone de croissance (GH) joue un
rôle essentiel dans la croissance statu-
rale et participe aux régulations métabo-
liques. Cette hormone protéique de
191 acides aminés est synthétisée par les
cellules somatotropes de l’antéhypophyse
et sécrétée de façon pulsatile. Le contrôle
de cette synthèse est assuré par l’hypothala-
mus : le growth hormone releasing factor
(GRF ou GHRH) la stimule et la somatosta-
tine l’inhibe. Son action sur la stimulation
de la croissance du squelette et des tissus
mous est indirecte, médiée (d’où le nom
autrefois utilisé de somatomédine) par
l’IGF I (insulin-like growth factor I). Les
effets métaboliques de la GH sur les méta-
bolismes des glucides (hyperglycémiant) et
des lipides (lipolytique) semblent être
directs. L’IGF I, polypeptide apparenté
structurellement à la proinsuline, présente
des effets opposés à ceux de la GH sur ces
deux métabolismes (hypoglycémiants et
lipogéniques), mais comme la GH, repré-
sente un facteur d’anabolisme protéique (1).
Structure des différents
paramètres de l’axe somatotrope
et mécanismes de contrôle
de leur biosynthèse
La GH hypophysaire est principalement
(# 90 %) produite sous la forme d’une pro-
téine de 191 acides aminés avec un PM de
22 kD. Une autre forme de 20 kDa (de
séquence identique à la GH 22 kD, mais
sans les acides aminés 32 à 46) issue d’un
épissage alternatif est produite de façon
minoritaire (# 10 %) et ses actions ne sem-
blent pas franchement différentes de celles
de la GH 22 kD. D’autres formes de GH,
modifiées en post-traductionnel, ne repré-
sentent qu’environ 1 % des formes circu-
lantes. Ces différentes molécules sont
retrouvées dans le sérum des sujets nor-
maux, déficitaires en GH ou acromégales.
La sécrétion de GH est sous le contrôle de
facteurs hypothalamiques stimulateurs
(GHRH mais également de nouvelles
molécules appelées GH releasing peptides
ou GHRP) ou inhibiteurs (somatostatine).
Au niveau hypothalamique, les stimula-
tions centrales (stress, sommeil, etc.) ou
périphériques (niveau de glycémie, concen-
trations des acides aminés, etc.) sont
relayées par di
fférents neuromédiateurs
(adrénergique αet ß, sérotoninergique,
dopaminergique) pour enclencher la réponse
en GHRH ou somatostatine. Il existe de plus
à ce niveau un rétrocontrôle négatif exercé
par l’IGF I (figure 1).
Hormone de croissance,
sport et dopage
J.C. Souberbielle*, M. Guinot**, E. Fink**, Y. Le Bouc**
*Laboratoire d’explorations fonctionnelles, hôpital Necker-enfants malades, Paris ;
** Laboratoire d’explorations fonctionnelles, hôpital A. Trousseau, Paris.
✎L’hormone de croissance (growth
hormone : GH) est utilisée comme
produit dopant par certains sportifs
pour ses effets anabolique, lipoly-
tique, anticatabolique et stimulateur
de l’érythropoïèse. Les doses utilisées
semblent être largement supra-
physiologiques.
✎Ces effets sont bien documentés
chez l’adulte déficitaire en GH mais
ne sont pas démontrés chez les non-
déficitaires.
✎Les effets secondaires néfastes de
la GH sont, en revanche, bien connus
(rétention hydrosodée, risques car-
diovasculaire et tumoral...).
✎Le dépistage d’un dopage par la
GH est aujourd’hui difficile en raison
de l’exacte similitude des formes
exogène et endogène, de la demi-vie
courte de l’hormone, de l’influence
intrinsèque de l’exercice physique
sur la sécrétion de GH et de l’in-
fluence de l’exercice sur l’élimination
rénale de la GH.
✎Ce dépistage pourrait reposer,
d’une part, sur la mesure des diffé-
rentes formes moléculaires produites
physiologiquement en exploitant le
rétrocontrôle exercé par la GH exo-
gène (actuellement la forme 22 kD)
sur la sécretion hypophysaire (GH
22 kD + GH 20 kD), et, d’autre part,
sur un faisceau d’arguments établi à
partir de la mesure de paramètres
dits “secondaires” (IGF I, IGFBP3,
ALS, marqueurs du remodelage
osseux ou du métabolisme de colla-
gènes non osseux).
L’

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume V, n° 2, mars-avril 2001
62
Mise au point
On peut comprendre la tentation de certains
de prendre des concentrés d’acides aminés
comme l’arginine (stimulateur de la sécré-
tion de GH), des αmimétiques comme la
clonidine ou des bêtabloquants (la voie bêta
stimule la biosynthèse de la somatostatine)
pour augmenter leur production journalière
de GH. L’effet dure-t-il ?
L’IGF I est un peptide de 70 acides aminés
apparenté structurellement à la proinsuline.
C’est la synthèse hépatique qui assure prin-
cipalement la concentration sérique
d’IGF I. Toutefois, de nombreux tissus syn-
thétisent également de l’IGF I à action
locale. Un deuxième peptide très proche
structurellement, l’IGF II (67 acides ami-
nés), est produit par pratiquement tous les
tissus et semble davantage impliqué dans la
croissance fœtale. Son action physiolo-
gique en période postnatale n’est pas, à
l’heure actuelle, encore bien élucidée.
Les IGF I et II sont associés dans leur grande
majorité (# 99 %) à des protéines de liaison
hautement spécifiques (affinités de l’ordre
de 109-1011 M-1) ou IGF Binding Proteins
(IGFBPs) qui sont au nombre de 6 (IGFBP
1 à 6). Parmi ces IGFBPs, trois sont parti-
culièrement à retenir. L’IGFBP3 est quanti-
tativement la plus importante (2) et elle est
associée dans la circulation à une autre pro-
téine, l’acide labile subunit (ALS), pour
former avec une molécule d’IGF un gros
complexe de haut PM (150 kDa) qui assu-
re le stockage des IGFs et diminue leur
clairance (une demi-vie d’IGF I dans ce
gros complexe de l’ordre de 12-15 heures
au lieu de 10 minutes pour l’IGF I libre).
La biosynthèse hépatique de l’IGFBP3,
comme celle de l’ALS, est stimulée par la
GH. Deux autres IGFBPs, la BP1 et la
BP2, présentes dans la circulation en quan-
tité moindre que la BP3 sont facilement
détectables par des techniques simples
d’immunoanalyse. Ces deux IGFBPs sont
régulées négativement par la GH. La bio-
synthèse d’IGFBP1 est, de plus, régulée
négativement (et rapidement) par l’insu-
line, ce qui entraîne des variations très
rapides de sa concentration sérique en
fonction de la prise alimentaire.
La nutrition a également un impact majeur
sur la biosynthèse d’IGF I et de BP3. En
cas de dénutrition, il existe une diminution
très forte du nombre de récepteurs hépa-
tiques de la GH avec, pour conséquence,
une diminution de la biosynthèse d’IGF I et
d’IGFBP3 dont les taux plasmatiques peu-
vent être effondrés.
Enfin, les stéroïdes sexuels ont un impact
sur la sécrétion de GH et d’IGF I comme
l’illustre l’augmentation de leurs concen-
trations sériques au cours de la puberté.
Le dopage à la GH est-il efficace?
Les effets de la GH chez l’adulte
déficitaire en GH
La tentation d’utiliser la GH comme sub-
stance dopante vient de son action théra-
peutique chez les patients déficitaires en
GH (GHD), notamment les GHD adultes.
De nombreuses études ont été réalisées à ce
sujet chez des GHD adultes dont le déficit
avait débuté lors de l’enfance. Les effets à
long terme (3 ans) de la GH (dont les doses
varient de 1 à 3 UI/m2/jour) sont tout à fait
nets (3):
–augmentation progressive des masses
musculaires des jambes (+ 29 %) ;
–diminution de la graisse sous-cutanée et
abdominale respectivement de 30 % et
46 % (produisant des éléments énergé-
tiques pour les sports d’endurance ?) ;
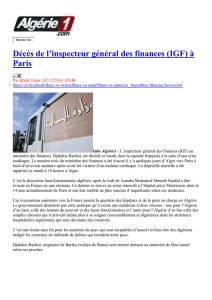
SNC
Hypothalamus
GH-RH (+) SRIF (-)
Testo Anté-hypophyse
GH
GHBP
Insuline
Nutrition Foie
IGFBPs
IGF I
Tissus cibles
IGF I /
IGFBPs
GH
(-)
(-)
E2
IGF I-R GH-R
GH-R
(+)
GH/IGF I
Figure 1. Représentation schématique de l’axe somatotrope. SNC, système nerveux central. GH-RH : growth
hormone releasing hormone. SRIF : somatostatine. GH : hormone de croissance. GHBP - GH binding protein.
GH-R : récepteur de la GH. IGF I : insulin-like growth factor I. IGFBPs : IGF binding proteins. IGF I-R :
récepteur de l’IGF I. Testo/E2 : testostérone/estradiol.

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume V, n° 2, mars-avril 2001
63
–densité minérale osseuse augmentée de
10 à 16 % en 3 ans suivant le site osseux
mesuré ;
–augmentation de certaines fonctions car-
diaques, notamment du volume d’éjection
systolique (+ 16 %) et du débit cardiaque
(+ 33 %).
En fait, si le traitement par hGH améliore
et normalise la performance maximale à
l’exercice musculaire de l’adulte GHD, ces
changements semblent essentiellement dus
à l’augmentation (ou plutôt à la restaura-
tion) de la masse musculaire et à la norma-
lisation de la force musculaire de certains
muscles proximaux des membres inférieurs
et de la ceinture. En effet, une augmenta-
tion de la VO2max n’est notée que lors-
qu’elle est exprimée par kilo de poids cor-
porel total et disparaît lorsqu’elle est expri-
mée par rapport à la masse maigre ou à la
surface musculaire de la cuisse (4, 5).
Ainsi, le traitement par hGH corrige les
anomalies de composition corporelle et
restaure les masses musculaires qui sont
déficitaires chez les GHD.
Les effets de la GH
chez l’adulte sain
Différents essais de traitement par la GH
ont été réalisés chez des sujets dont la fonc-
tion somatotrope était normale. Des sujets
âgés, réalisant un exercice musculaire pen-
dant 4 mois, améliorent leur synthèse pro-
téique musculaire, un traitement par hGH
n’ajoutant rien de plus à l’effet de l’exer-
cice musculaire malgré une augmentation
très significative des concentrations plas-
matiques d’IGF I (6). Par ailleurs, chez des
sujets jeunes (22-33 ans) et très entraînés,
la GH (24 UI/semaine, c’est-à-dire une
dose supraphysiologique) ne modifie que
peu la masse maigre (augmentation de
4%) et la masse grasse (diminution de
12 %) alors que les concentrations d’IGF I
sont augmentées (tout en restant dans la
zone physiologique) et la GH endogène
freinée (7). Ces modifications minimes
peuvent cependant être utilisées par les
sportifs de haut niveau pour qui une faible
amélioration du rendement musculaire peut
tout simplement faire “la différence” à un
niveau international de compétition.
Malgré l’absence d’études contrôlées, il a
été suggéré qu’existait une augmentation
de la VO2max sous GH, d’une part, par
augmentation du débit cardiaque (effet
inotrope de la GH [8]) et d’autre part, par
augmentation de la volémie en relation
avec un effet inhibiteur de la sécrétion de
facteur natriurétique auriculaire (9). Il ne
faut pas non plus ignorer l’effet de stimula-
tion de l’érythropoïèse par l’IGF I qui peut
intéresser les sportifs d’endurance (10).
La GH peut également présenter un autre
avantage pour le sportif par sa propriété de
s’opposer à certains états de catabolisme
protéique. De nombreux essais ont été réa-
lisés dans différents états cataboliques
comme, par exemple, chez des patients
venant de subir une cholécystectomie (11).
Malgré une alimentation parentérale hypo-
calorique, la GH permet de maintenir un
taux constant d’albuminémie plasmatique,
d’améliorer la balance azotée, de diminuer
l’incidence des infections et de réduire le
temps d’hospitalisation. Le sportif est-il
tenté d’utiliser la GH pour récupérer plus
rapidement après un exercice d’endurance
long et violent ou une blessure, ou pour pré-
venir la destruction des fibres musculaires ?
La GH et ses effets indésirables
L’analyse systématique des enfants traités
par hGH, comme le réalise le laboratoire
Pharmacia Upjohn depuis de nombreuses
années sur une cohorte européenne de
26 000 enfants environ (étude KIGS [12]),
a principalement rapporté des effets secon-
daires mineurs (tels que céphalées, infec-
tions des voies aériennes supérieures,
otites, pharyngites, convulsions, etc.) dont
on ne sait en fait pas s’ils sont à mettre sur
le compte du traitement, de la pathologie
ayant conduit à un traitement par hGH
(certains signes sont plus fréquemment
retrouvés dans les syndromes de Turner ou
chez les insuffisants rénaux traités par
hGH) ou s’ils sont simplement associés au
traitement de façon fortuite. Les sympto-
matologies plus inquiétantes, telles que
leucémies, tumeurs, épiphysiolyses de la
tête fémorale, ostéochondrites de la
hanche, etc., ne semblent pas plus fré-
quentes que dans la population générale.
Notons toutefois qu’il s’agit là de résultats
obtenus chez l’enfant.
En ce qui concerne les adultes GHD, les
doses de GH utilisées ont dû être dimi-
nuées (à # 1 UI/jour) puisque les traite-
ments utilisés initialement entraînaient dès
les premiers jours des symptômes de réten-
tion hydrosodée : douleurs articulaires,
œdème périorbitaire, syndrome du canal
carpien. L’utilisation de doses supraphysio-
logiques en traitement chronique par la GH
peut entraîner des complications à long
terme si on se réfère à celles rencontrées
dans l’acromégalie : pathologies cardiovas-
culaires, respiratoires ou tumorales (côlon
notamment [13]) qui réduisent l’espérance
de vie de ces patients. Par ailleurs, diffé-
rentes études ont montré qu’il existait une
relation positive entre les concentrations
sériques d’IGF I (même dans la zone nor-
male physiologique) et le risque de cancer
de la prostate (14) ou du sein (15).
Enfin, le risque de maladie de Creutzfeld-
Jacob ne peut pas être écarté chez le spor-
tif qui aurait utilisé (ou qui utiliserait enco-
re?) de la GH extraite d’hypophyses préle-
vées sur des cadavres humains.
Dopage par la GH et dépistage
Malgré le manque d’évidence scientifique
prouvant un effet bénéfique de la GH pour
le sportif, celle-ci semble utilisée à des
doses supraphysiologiques dans le monde
du sport. C’est tout du moins ce que suggè-
rent la rumeur, mais aussi des publications
non scientifiques (16, 17) ou les colonnes
de la presse quotidienne qui rapportent
régulièrement la saisie par la police ou les
douanes de flacons d’hGH dans les

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume V, n° 2, mars-avril 2001
64
Mise au point
bagages de sportifs ou d’entraîneurs. Cette
utilisation semble très largement dépasser
le domaine du sport de haut niveau puisque
5% des adolescents étudiants américains
interrogés dans le cadre d’une étude
conduite par des pédiatres ont déclaré utili-
ser (ou avoir utilisé) de la GH dans un but
de dopage (18).
La GH étant désignée comme une substan-
ce interdite par le Comité international
olympique (CIO), il faut déterminer la
meilleure méthode pour en détecter l’usa-
ge. Cette détection par dosage direct de la
GH est toutefois compliquée car :
–la GH recombinante exogène est iden-
tique à l’hormone endogène naturelle et on
ne peut donc pas utiliser des méthologies
identiques au dépistage des stéroïdes de
synthèse (par exemple, le rapport isoto-
pique 13C/12C n’a pas été retrouvé différent
de celui de la GH hypophysaire dans deux
préparations commerciales d’hGH parmi
trois étudiées [19]);
–la sécrétion de GH hypophysaire est pul-
satile et un prélèvement au hasard pourrait
ne refléter qu’un pic spontané de
sécrétion ;
–le dépistage par dosage urinaire de la GH
immédiatement après une compétition
(c’est le principe de la plupart des tests
antidopage) serait critiquable en raison de
la modification de l’élimination urinaire de
la GH par certains types d’activité phy-
sique (20) ;
–la demi-vie de la GH est courte et sa
mesure (sang ou urine) ne permettrait de
toute façon de ne dépister qu’une prise
récente.
Il semble aujourd’hui que seules les ana-
lyses sanguines offrent de détecter un dopa-
ge par la GH. L’orientation principale
actuellement prise est d’étudier les varia-
tions des marqueurs de l’action de la GH
comme les paramètres de l’axe somatotrope
(IGFs, IGFBPs, ALS, etc.), les marqueurs
du remodelage osseux (ostéocalcine, mar-
queurs du métabolisme du collagène de
type I, etc.) ou du renouvellement de colla-
gènes non osseux (comme le P3NP).
Pour optimiser cette approche, il faut tenir
compte de l’influence de l’activité sportive
sur ces différents paramètres. Il faudrait
donc disposer de valeurs de référence obte-
nues chez des sportifs (non dopés, cela va
de soi !) pratiquant différents types de
sports (endurance, résistance, etc.), en pre-
nant également en compte l’âge, le sexe, le
niveau et la période d’activité sportive
(entraînement, compétition). Pour informa-
tion, une étude préliminaire récente chez
des sportifs de haut niveau ne nous a pas
montré de différence de concentration
sérique de certains de ces facteurs (comme
l’IGF I) par rapport aux normes pour l’âge.
Afin d’éliminer les facteurs confondants
dans le cadre d’un dépistage effectué à la
fin d’une compétition, il a fallu bien carac-
tériser, d’une part, le retentissement aigu de
l’activité sportive sur les paramètres de
l’axe somatotrope et les marqueurs osseux
et, d’autre part, l’effet de l’administration
de GH à doses supraphysiologiques sur ces
mêmes paramètres. Ces résultats, issus
d’études contrôlées contre placebo récem-
ment publiées, sont résumés dans le
tableau I. Schématiquement, un exercice
bref et intense induit une augmentation
transitoire de la production de GH et des
marqueurs de son action qui se normalisent
une à deux heures après la fin de l’exercice
(21, 22, 23). Après une semaine d’adminis-
tration de GH à doses supraphysiologiques
(0,15 U/kg/jour), la réponse biologique au
même type d’exercice
(effectué 3 heures après
l
a dernière injection de
GH) est atténuée, mais
les concentrations ba-
sales des différents para-
mètres sont très aug-
mentées et ne reviennent
à la normale que long-
temps (plusieurs jours
pour certains para-
mètres) après la fin de
l’exercice. Parmi les
paramètres étudiés, ceux
qui présentent les varia-
tions les plus
impor-
tantes en réponse aux
injections de GH (IGF I, ALS) reviennent
relativement rapidement à la normale (2 à 4
jours), alors que l’augmentation des mar-
queurs du renouvellement osseux (ostéo-
calcine, P1CP) ou de la formation de colla-
gènes non osseux (P3NP) est moins impor-
tante mais semble plus persistante (22, 23).
Cela a été vérifié dans une autre étude ran-
domisée contre placebo (99 sujets inclus)
où l’influence sur les marqueurs osseux
d’une “cure” de 28 jours de GH à doses
importantes (0,1 U/kg/jour ou 0,2 U/kg/
jour) a été étudiée (24). Après 28 jours de
traitement par GH, les quatre marqueurs
étudiés (ostéocalcine, P1CP, 1CTP et
P3NP) étaient augmentés de manière dose-
dépendante. L’augmentation était plus
importante chez les hommes que chez les
femmes. Les marqueurs subissant l’aug-
mentation la plus importante après 28 jours
de traitement par GH étaient le P3NP
(+ 150 % en moyenne) et le 1CTP
(# 100 %). Toutefois, l’augmentation res-
tait significative 8 semaines après l’arrêt
des injections de GH pour le P3NP et l’os-
téocalcine, alors que le P1CP et le 1CTP
étaient revenus à leur niveau initial moins
de 2 semaines après la fin du traitement par
GH. Les auteurs ont calculé que, immédia-
tement après les 28 jours de traitement, la
sensibilité du P3NP pour séparer les sujets
ayant pris de la GH de ceux ayant eu le pla-
cebo était de 0,84 avec une spécificité de
Effet d’un exercice Effet de la GH
bref et violent exogène
(≥60 % VO2max)
GH +++ +++
GHBP + ±
IGF I + +++
IGFBP1 + -
IGFBP2 + -
IGFBP3 + +
ALS + ++
Protéase BP3 + ?
P3NP + ++
Marqueurs osseux + +(+)
Tableau I. Effets de l’exercice et de la GH (d’après [20, 22, 23]).

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume V, n° 2, mars-avril 2001
65
0,95. L’étude des concentrations de ces
marqueurs secondaires ou mieux, de leurs
variations au cours du temps, pourrait per-
mettre de constituer un faisceau d’argu-
ments orientant vers une prise illicite
d’hGH. Dans ce cadre, la mise en place
prochaine d’un suivi longitudinal du sportif
de haut niveau (dont la vocation n’est tou-
tefois pas le dépistage du dopage mais plu-
tôt le suivi médical des sportifs) devrait
apporter des informations sur les variations
de certains de ces paramètres avec le
temps. Il conviendra, dans ce contexte,
d’avoir une idée précise de la variabilité
intra-individuelle des paramètres étudiés
(c’est-à-dire du coefficient de variation que
l’on obtient en mesurant ces paramètres
plusieurs fois chez des sujets dont l’équi-
libre physiologique est stable), afin de ne
pas étiqueter les effets du dopage ou d’une
pathologie, des modifications biologiques
qui seraient tout simplement physiolo-
giques. Il sera possible de déterminer, à
partir de ce coefficient de variation intra-
individuel, le plus petit changement signifi-
catif (least significant change [LSC]) que
l’on pourra considérer comme reflet d’une
réelle modification biologique (comme
l’effet d’un dopage, par exemple). On peut
noter que cette notion de variabilité intra-
individuelle devrait être appliquée à tous
les domaines de la biologie, à partir du
moment où l’on compare plusieurs valeurs
d’un même paramètre chez un même indi-
vidu (par exemple, avant et pendant un trai-
tement ou lors d’une épreuve dynamique
d’exploration endocrinienne). À ce titre,
nous avons récemment évalué (25) la varia-
bilité intra-individuelle de plusieurs para-
mètres intéressants pour le dépistage d’un
dopage par la GH.
En plus de ces paramètres indirects de détec-
tion de la prise illicite de GH recombinante
(GH 22 kD), le dépistage pourrait utiliser
l’effet de rétrocontrôle sur la production
hypophysaire de GH (GH 22 kD +
20 kD).
La mesure spécifique de la GH 20 kD
devrait permettre de mettre en évidence en
cas d’apport de GH exogène la diminution
ou même la disparition de cette forme
moléculaire non apportée par les injections
de GH recombinante. Dans une étude
récente (26),le rapport 20 kD/22 kD a per-
mis une discrimination complète entre des
sujets GHD traités par hGH et des
contrôles non traités. Cette approche, si
elle est validée, pourrait permettre la détec-
tion à coup sûr d’une prise récente (moins
de 36 à 48 heures ?) de GH dans un but de
dopage.
Conclusions et perspectives
Ainsi, si axe somatotrope, activité physique
et fonction musculaire sont très étroitement
liés, il n’est pas évident que l’apport exo-
gène de GH permette d’améliorer les per-
formances sportives chez le sujet sain et
bien entraîné. Il n’est toutefois pas exclu
qu’elle puisse être bénéfique pour la répa-
ration musculaire après une période cata-
bolique. Son effet lipolytique doit très cer-
tainement intéresser certains types compé-
titeurs (comme les body-builders).
Si le bénéfice d’un dopage par la GH n’est
pas scientifiquement prouvé, il faut garder
en mémoire que les doses utilisées par les
sportifs seraient très nettement supérieures
(on parle de 16 UI/jour) aux doses étudiées
(environ 1 UI/jour) dans les travaux scien-
tifiques publiés où, par ailleurs, les durées
de traitement étaient relativement courtes,
par rapport à celles du dopage. Enfin,
l’éventuel effet additif de la GH et des ana-
bolisants stéroïdiens sur la force muscu-
laire n’a pas été envisagé dans ces études
scientifiques (27).
Les risques de l’utilisation de doses supra-
physiologiques de GH exogène sont poten-
tiellement importants même si les suivis à
long terme des thérapeutiques substitutives
chez l’enfant sont rassurants. À côté de la
GH, d’autres produits, l’IGF I, en particu-
lier, sont probablement utilisés de façon
illicite en raison de leurs mêmes propriétés.
Ce dernier peut entraîner des effets secon-
daires non négligeables comme des lipody-
strophies aux points d’injection, des viscé-
romégalies (rate, rein, tissu lymphoïde) et
surtout des hypoglycémies qui peuvent être
dramatiques. Enfin, les nouveaux sécréta-
gogues sous-cutanés de la GH (hexareline
ou ipamoreline) ou oraux (MK 0677 et
NNC 26 + 0703) sont probablement aussi
tacitement utilisés. Dans l’état actuel des
connaissances, le dépistage de l’abus de
GH devrait passer, d’une part, par la me-
sure simultanée des deux formes hypophy-
saires (22 kD et 20 kD) pour la détection
d’une prise récente, et, d’autre part, par
l’établissement d’un faisceau d’arguments
fondés sur la mesure des concentrations et
l’étude des variations dans le temps de
paramètres secondaires comme l’IGF I, la
BP3, l’ALS, le P3NP et certains marqueurs
du remodelage osseux.
La lutte contre le dopage par la GH rejoint
donc celle du dopage en général chez le
sportif de haut niveau. Elle reste aléatoire à
l’heure actuelle, ce qui est connu dans les
milieux sportifs. Elle nécessite la mise en
œuvre de moyens importants pour que des
progrès tangibles puissent être obtenus. ●
Références
1. Zapf J, Froesch E, Schmid C. Metabolic
effects of IGFs in contemporary endocrinology :
the IGF system. R. Rosenfeld and C. Roberts,
eds. Totowa : Humana Press Inc, NJ 1999 :
577-619.
2. Le Bouc Y. Biologie des IGF. Médecine thé-
rapeutique 1996 ; 2 : 22-31.
3. Ter Marten JC, De Boer H, Kamp O et al.
Long-term effects of growth hormone (GH)
replacement in men with childhood-onset GH
deficiency. J Clin Endocrinol Metab 1999 ; 84 :
2373-80.
4. Cuneo RC, Salomon F, Wiles MC et al.
Growth hormone treatment in growth hormone-
deficient adults. I. Effects on muscle mass and
strength. J Appl Physiol 1991 ; 70 : 688-94.
5. Cuneo RC, Salomon F, Wiles MC et al.
Growth hormone treatment in growth hormone-
deficient adults. II Effects on exercise perfor-
 6
6
1
/
6
100%