Dasatinib et cancer de la prostate nouvelle cible, nouvelle piste

dossier thématique
La prostate métastatique :
de la biologie à la clinique
Correspondances en Onco-Urologie - Vol. II - no 4 - octobre-novembre-décembre 2011
164164
Dasatinib et cancer de la prostate
métastatique résistant à la castration :
nouvelle cible, nouvelle piste
thérapeutique ?
Dasatinib and metastatic prostate cancer with castration-resistance:
new target, new targeted therapy?
M. Gross-Goupil*
* Hôpital Saint-André,
centre hospitalo-
universitaire, Bordeaux.
E
n France, en 2000, il y a eu 40 309 nouveaux cas
de cancer de la prostate et 10 004 décès dus à
cette maladie. Si le dépistage contribue à un
diagnostic à des stades précoces, dans 30 % des cas
le diagnostic est malheureusement posé à un stade
métastatique (1). La dernière décennie a été marquée
par l’importance des développements thérapeutiques
dans le cadre d’essais cliniques prospectifs. Ces études
ont permis de démontrer en 2004 l’effi cacité du docé-
taxel sur la survie globale (SG) chez des patients en
Résumé
Summary
»
Au cours de la dernière décennie, une véritable révolution
thérapeutique a eu lieu dans le traitement du cancer de la prostate
métastatique résistant à la castration (CPMRC) avec l’avènement
du docétaxel en 2004 et, en 2011, de l’acétate d’abiratérone et du
cabazitaxel. Le ciblage des localisations secondaires osseuses via
l’acide zolédronique et, plus récemment, celui du dénosumab, qui a
permis une réduction de l’incidence des événements osseux sévères
secondaires aux métastases, renforcent l’arsenal thérapeutique.
En parallèle, la recherche de nouvelles cibles ainsi que la meilleure
compréhension des voies de signalisation impliquées dans le
développement du cancer ont permis d’envisager Src et la famille
des Src-kinases comme une nouvelle cible, inhibée en particulier
par le dasatinib. Cet inhibiteur de tyrosine kinase de deuxième
génération, approuvé dans le traitement des leucémies myéloïdes
chroniques après échec de l’imatinib, a de façon logique été testé
dans le cadre d’essais thérapeutiques de phase I-II, en monothérapie
ainsi qu’en combinaison avec l’association docétaxel + prednisone
chez des patients atteints d’un CPMRC. Cette combinaison a été
comparée à un placebo dans le cadre d’un essai randomisé de
phase III, désormais fermé aux inclusions et dont les résultats sont
en attente. Si l'effi cacité du dasatinib se confi rme dans le traitement
du CPMRC en association avec le docétaxel, sa combinaison avec
d’autres molécules telles que l’acétate d’abiratérone, l’agent
prometteur qu’est le MDV3100, ainsi que le dénosumab devra faire
l’objet de nouveaux essais.
Mots-clés : Cancer de la prostate – Dasatinib – Src – Docétaxel –
Métastases osseuses.
A real therapeutic revolution has occurred during the
last decade in the treatment of castration-resistant
prostate cancer, with the approval of docetaxel in
2004, and, more recently, of the abiraterone acetate
and cabazitaxel in 2011. Targeting bone metastases,
with zoledronic acid, and denosumab, decreases
the incidence of severe skeletal-related events, and
is part of the treatment. In the same time, the search
for new targets and a better comprehension of the
signalling pathways, implicated in the development
of cancer, have permitted to consider Src and the Src-
kinases family as a new potential target, especially
for inhibition with dasatinib. This second generation
tyrosine kinase inhibitor, approved in the treatment
of chronic myelogenous leukemia, after imatinib, has
been tested in phase I-II clinical trials, as monotherapy
and in combination with docetaxel-prednisone also.
This combination has also been compared to placebo
in a randomized phase III trial. This trial is closed for
inclusions and results are pending. If dasatinib confi rms
his therapeutic effi cacy in treatment of castration-
resistant prostate cancer combined with docetaxel-
prednisone, next associations, with abiraterone
acetate, with the promising agent MDV3100, or with
denosumab, should be tested in new clinical trials.
Keywords: Prostate cancer – Dasatinib – Src –
Docetaxel – Bone metastasis.
COU-12 + pubs.indd 164COU-12 + pubs.indd 164 13/12/11 15:5813/12/11 15:58

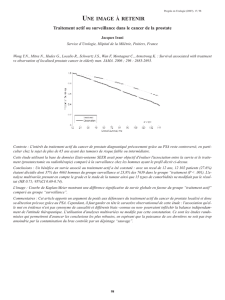
Figure. Mode d’action du dasatinib (15).
FC : facteurs de croissance ; R-FC : récepteurs des facteurs de croissance.
Correspondances en Onco-Urologie - Vol. II - no 4 - octobre-novembre-décembre 2011
165165
VEGF
IL-8
AKT
STAT3
RTK
MAPK
PI3K
FAK Src Ras
Dasatinib
Cellule stromale
Cellule tumorale prostatique
Angiogenèse
Survie
Transcription
R-FC
FC
Prolifération
Dasatinib et cancer de la prostate métastatique résistant à la castration :
nouvelle cible, nouvelle piste thérapeutique ?
situation de résistance à la castration (2, 3). En 2011,
2 grands essais prospectifs randomisés de phase III ont
permis de confi rmer l’effi cacité, suggérée en phase II,
de l’acétate d’abiratérone (Zytiga®) et du cabazitaxel
(Jevtana®) avec un allongement de la SG en situation
de résistance à la castration et après chimiothérapie
par docétaxel ; ces conclusions ont permis l’obtention
d’une autorisation de mise sur le marché (AMM) de
ces 2 molécules (4, 5). En parallèle, le tropisme osseux
des cellules cancéreuses a servi de base au dévelop-
pement de thérapies ciblant l’os. Dans un premier
temps, l’acide zolédronique a démontré son effi cacité
versus placebo, dans la réduction de l’incidence des
événements osseux sévères, ce qui a permis de l’inté-
grer à part entière dans la stratégie thérapeutique du
CPMRC osseux (6). Plus récemment, le dénosumab,
inhibiteur de RANK ligand, a également montré sa
supériorité sur l’acide zolédronique, dans la réduc-
tion du risque de survenue des événements osseux
chez les patients métastatiques (7). Le dasatinib fait
partie des thérapies ciblées, en tant qu’inhibiteur de
tyrosine kinase, ciblant par ailleurs plus spécifi que-
ment les métastases osseuses, les cellules tumorales
et leur microenvironnement. Logiquement, il a donc
fait l’objet d’études in vitro, puis in vivo sur modèle
animal. Les résultats intéressants ont amené à la réali-
sation d’essais de phase I-II en monothérapie, puis en
combinaison avec le docétaxel. Les résultats de l’essai
de phase III docétaxel + prednisone + dasatinib versus
docétaxel + prednisone + placebo sont désormais
attendus avant de pouvoir conclure, voire d’intégrer ce
nouvel agent dans l’arsenal thérapeutique du cancer
de la prostate.
Dasatinib
Le dasatinib (BMS-354825, Sprycel®, Bristol-Meyers
Squibb) est un inhibiteur de tyrosine kinase de
deuxième génération (fi gure). Il s’agit d’un inhibiteur
multicible : BCR/ABL et Src-kinases (SRC, FYN et LYN),
PDGFR, KIT (8). Le développement de la molécule a
été initialement axé sur le ciblage de la protéine de
fusion BCR-Abl, impliquée dans les leucémies myéloïdes
chroniques (LMC) gouvernées, aux stades précoces, par
le chromosome Philadelphia (Ph+), et dans certaines
leucémies aiguës lymphoblastiques (LAL) [9]. Le dasa-
tinib a confirmé son efficacité thérapeutique dans
la prise en charge de ces entités cliniques, chez les
patients résistants ou intolérants à l’imatinib, ce qui
lui a permis d’obtenir l’AMM dans cette indication dès
novembre 2006.
Dasatinib et cancer de la prostate
Données précliniques
Src et Src-kinases (LYN, FYN) sont impliquées dans
les voies de signalisation, ainsi que dans la survie,
la prolifération, la migration et la transition sur un
mode androgéno-indépendant des cellules tumorales
prostatiques (10, 11). L’hyperactivité des kinases de la
famille Src de tumeurs de patients atteints d’un cancer
de la prostate est associée à un raccourcissement de
la durée de la réponse à la privation androgénique
et de la SG (12). Src est également impliquée dans la
régulation de la fonction des ostéoclastes et dans la
pathogenèse des métastases osseuses (13), ce qui,
conjugué au tropisme osseux particulier du cancer
de la prostate, en fait un agent thérapeutique de
choix (14, 15).
In vitro, le dasatinib permet une réduction de la
prolifération et de la migration des cellules cancé-
reuses de lignées de cancer de la prostate (12, 16),
en particulier de cellules hormono-résistantes telles
que LNCaP-SCM (12).
Sur un modèle animal murin, l’exposition au dasatinib
permet une réduction du volume tumoral prostatique
de xénogreff e et du nombre de métastases ganglion-
naires par rapport à des souris témoins non traitées (16).
De plus, après greff e orthotopique d’une tumeur en
COU-12 + pubs.indd 165COU-12 + pubs.indd 165 13/12/11 15:5813/12/11 15:58

dossier thématique
La prostate métastatique :
de la biologie à la clinique
Correspondances en Onco-Urologie - Vol. II - no 4 - octobre-novembre-décembre 2011
166166
intratibial sur des souris, le dasatinib abaisse signifi ca-
tivement la concentration sérique de PSA et augmente
la densité minérale osseuse (17). Enfi n, l’activité de la
combinaison du dasatinib et du docétaxel s’est montrée
supérieure à celle de chaque agent utilisé séparément
dans ces modèles (17).
Monothérapie : étude de phase II – cohorte
d’expansion
Une première série de données a été obtenue à partir
de l’essai de phase II (CA180085) conduit par E.Y. Yu
et al. (18). Dans cette première étude, l’administration
du dasatinib se faisait 2 fois par jour à la dose de 70 mg
pour chaque prise (18). L’essai a permis de suggérer
une efficacité, notamment reflétée par la décrois-
sance des marqueurs de la résorption osseuse, mais
au prix d’une toxicité inacceptable et fréquente ayant
touché 40 % des patients, sous forme de pleurésie, de
fatigue, de nausées et de diarrhées. En parallèle, les
données d’optimisation de dose chez des patients
atteints de LMC ont permis d’envisager une admi-
nistration unique quotidienne avec amélioration de
la tolérance et maintien de l’effi cacité identique (19).
De ce fait, après amendement, l’étude de phase II a
été poursuivie dans le cadre d’une cohorte d’expan-
sion (NCT00385580), avec pour objectif de démontrer
l’amélioration de la tolérance et le maintien de l’effi -
cacité (critères PCWG2) d’un schéma d’administra-
tion de 100 mg/j (20). D’octobre 2006 à juillet 2008,
48 patients ont été inclus dans cette cohorte et traités
à la dose de 100 mg/j. Les patients souff raient d’un
CPMRC en progression biologique (élévation entre
2 dosages successifs du PSA). Le temps médian avant
progression était de 4,7 mois (IC95 : 2,8-5,5). Parmi les
20 patients présentant des cibles mesurables selon
les critères RECIST, le taux de contrôle de la maladie
a été de 40 % (8/20).
Combinaison avec le docétaxel :
études de phase I-II et de phase III
Renforcer l’effi cacité du docétaxel, agent cytotoxique,
par une combinaison avec le dasatinib, agent cytos-
tatique, ciblant le microenvironnement osseux, était
l'objectif de l’essai de phase I-II, publié récemment (21).
Le schéma comprenait une phase I d’escalade de
doses : docétaxel administré toutes les 3 semaines
combiné à 5 mg × 2/j de prednisone en continu ; dasa-
tinib instauré à J3 du premier cycle, puis administré
quotidiennement. Les paliers testés étaient de 50/60,
50/75, 70/75, 100/75 et 120 mg/75 mg/m2 pour le dasa-
tinib et le docétaxel respectivement. Seize patients ont
participé à la phase I, 33 à la phase II. Leurs caracté-
ristiques cliniques étaient les suivantes : âge médian
de 65 ans, 85 % de métastases osseuses, 65 % de loca-
lisations secondaires mesurables selon les critères
RECIST ; 33 % des patients avaient déjà été traités par
chimiothérapie, 18 % par docétaxel. Sur le plan de la
tolérance, la dose limitante toxique n’a pas été atteinte,
avec une sécurité d’emploi démontrée au palier de
doses maximal de 120 mg de dasatinib et de 75 mg/ m2
de docétaxel avec prednisone. Plus de la moitié des
patients (61 %) ont reçu au minimum 6 cycles de
chimiothérapie, 24 % ayant reçu au moins 10 cycles.
Le dasatinib a été poursuivi après l’arrêt du docétaxel
chez 28 sujets (61 %), pour une durée médiane de
2,9 mois (0,9-11,7 et plus). Sur les 46 patients traités,
13 (28 %) ont présenté des effets indésirables, au
maximum de grade 3. Parmi les eff ets indésirables
les plus fréquents : 35 % de fatigue de grade 1, 28 %
de grade 2 et 43 % de diarrhées. La survenue d’un
syndrome rétentionnel à type d’épanchement pleural
ou péricardique a été acceptable, avec 15 % de pleu-
résie (4 % de grade 3) et 1 cas (2 %) de péricardite
de grade 1. L’ajout de la prednisone ainsi que la
modifi cation du schéma d’administration du dasa-
tinib pourraient expliquer la meilleure tolérance de
la combinaison sur ce plan, comparativement aux
données de l’essai de phase I-II (21).
En termes d’efficacité, le taux de contrôle de la
maladie a été de 77 %. Selon les critères RECIST, 60 %
des patients (18 sur 30 évaluables) ont présenté une
réponse partielle ; 17 % (5 sur 30) ont eu une réponse
Tableau. Détail des réponses rapportées dans l’essai de phase I-II avec la combinaison docétaxel + prednisone +
dasatinib.
Réponses biologiques
50 % (26/46)
Réponses objectives
Réponses partielles, localisations viscérales (RECIST)
Réponses partielles, localisations ganglionnaires (RECIST)
60 % (18/30)
50 % (4/8)
64 % (14/22)
Stabilisation
17 % (5/30)
Réponses, localisations secondaires osseuses
(disparition d’au moins 1lésion sur scintigraphie osseuse)
30 % (14)
Stabilité osseuse
41 % (19)
Marqueurs de résorption osseuse
Diminution du taux de uNTX
Baisse du taux de PAL
87 % (33/38)
76 % (26/33)
Réponse biologique défi nie par une décroissance du taux de PSA de 50 % au minimum, confi rmée à 6 semaines ;
uNTX : Urinary N-telopeptide ; PAL : phosphatases alcalines.
COU-12 + pubs.indd 166COU-12 + pubs.indd 166 13/12/11 15:5813/12/11 15:58

Correspondances en Onco-Urologie - Vol. II - no 4 - octobre-novembre-décembre 2011
167167
Dasatinib et cancer de la prostate métastatique résistant à la castration :
nouvelle cible, nouvelle piste thérapeutique ?
prolongée de 18 semaines au minimum. Le détail
des types de réponses objectivées est rapporté dans
le tableau. La maladie s'est stabilisée chez 5 des
30 patients évaluables.
Conclusion
Le dasatinib semble donc prometteur, en particu-
lier en combinaison avec le docétaxel. Sans que la
comparaison ne soit possible, les taux de réponses
biologiques et objectives ont été respectivement de
57 et 60 % lorsque le dasatinib était combiné à l’asso-
ciation docétaxel + prednisone. Les taux rapportés
étaient de l’ordre de 45 à 50 % et de 12 à 17% pour
les essais TAX 327 et SWOG. Seule une comparaison
“frontale”, qui fait l’objet d’un essai de phase III, fermé
aux inclusions, permettra de conclure quant à l’apport
thérapeutique potentiel de l’ajout du dasatinib au
docétaxel en situation de résistance à la castra-
tion. L'objectif est un gain en SG et en survie sans
progression (NCT00744497). Par ailleurs, le ciblage
du microenvironnement par le dasatinib ouvre une
nouvelle voie, diff érente, voire potentiellement syner-
gique des nouvelles hormonothérapies axées sur la
réduction de la production de la dihydrotestostérone
intratumorale (inhibiteur de CYP17 comme l’acétate
d’abiratérone), ou sur le récepteur aux androgènes
(comme les nouveaux antiandrogènes du type
MDV3100). ■
1. Smith MR, Kabbinavar F, Saad
F et al. Natural history of rising
serum prostate-specifi c antigen
in men with castrate nonmetas-
tatic prostate cancer. J Clin Oncol
2005;23(13):2918-25.
2. Tannock IF, de Wit R, Berry WR
et al. Docetaxel plus prednisone or
mitoxantrone plus prednisone for
advanced prostate cancer. New
Engl J Med 2004;351:1502-12.
Retrouvez
l’intégralité
des références
bibliographiques
sur www.edimark.fr
Références
Nouvelles de l’industrie pharmaceutique
Communiqués des conférences de presse, symposiums, manifestations, organisés par l’industrie pharmaceutique
Zytiga®,
une nouvelle approche ducancer
de la prostate métastatique
Le traitement des patients atteints d’un
cancer de la prostate métastatique hormono-
résistant, qui reposait jusque-là sur une
chimiothérapie par taxanes, fait actuelle-
ment des progrès considérables, comme en
témoignent les nombreuses communications
présentées récemment au congrès de l’ESMO.
Parmi ces avancées, l’acétate d’abira térone,
qui permet, au-delà du traitement de
première ligne et après échec d’un traite-
ment par docétaxel, d’allonger la survie des
patients atteints d’un cancer de la prostate
métastatique et hormonorésistant. L’acétate
d’abiratérone, premier inhibiteur de la CYP17,
assure un blocage effi cace de la biosynthèse
des androgènes au niveau des testicules
mais aussi au niveau des surrénales et de
la prostate, exerçant ainsi un puissant eff et
antitumoral.
L’étude de phase III COU-AA-301 a comparé
l’efficacité et la tolérance d’un traitement
associant acétate d’abiratérone et predni-
sone à celles d’un traitement par placebo
et prednisone chez 1 195 patients atteints
d’un cancer de la prostate métastatique hor-
monorésistant et préalablement traités par
une chimiothérapie contenant du docétaxel.
✓
Les résultats sur le critère principal mettent
en évidence un allongement signifi catif de
la survie globale dans le groupe traité par
l’association acétate d’abiratérone-predni-
sone versus placebo-prednisone (p < 0,0001 ;
HR = 0,646 [0,543-0,768]), avec des médianes
de 14,8 versus 10,9 mois.
✓
La même tendance est retrouvée sur les
critères secondaires, avec un bénéfi ce signi-
fi catif de l’association acétate d’abiratérone-
prednisone versus placebo-prednisone, en
termes de temps médian jusqu’à progression
de l’antigène spécifi que de la prostate (PSA),
de survie sans progression radiologique et
de taux de réponse biologique (diminution
du taux de PSA > 50 %).
Les effets indésirables spécifiquement
observés avec l’association acétate d’abira-
térone-prednisone − œdèmes, hypokaliémie
et hypertension artérielle − sont essentiel-
lement liés aux eff ets minéralocorticoïdes
et compensés en partie par la prednisone.
Ces nouvelles données ont conduit l’Agence
française de sécurité sanitaire des produits
de santé (Afssaps) à octroyer à Janssen une
Autorisation temporaire d’utilisation (ATU)
le 1
er
aout 2011 et l’Agence européenne des
médicaments (EMEA) à émettre un avis favo-
rable pour sa mise sur le marché le 7 sep-
tembre dernier.
En pratique, Zytiga® est indiqué en associa-
tion avec la prednisone ou la prednisolone
dans le traitement du cancer de la prostate
métastatique résistant à la castration chez
les patients dont la maladie a progressé pen-
dant ou après une chimiothérapie à base de
docétaxel. Zytiga® est un traitement par voie
orale qui ne nécessite pas de déplacements
répétés à l’hôpital et les patients peuvent le
suivre à domicile. Il se présente sous forme
de comprimés à 250 mg et la posologie est
de 1 000 mg/j, soit 4 comprimés par jour.
N. Charbonnier (Vaucresson)
COU-12 + pubs.indd 167COU-12 + pubs.indd 167 13/12/11 15:5813/12/11 15:58

dossier thématique
La prostate métastatique :
de la biologie à la clinique
Correspondances en Onco-Urologie - Vol. II - no 4 - octobre-novembre-décembre 2011
322322
Dasatinib et cancer de la prostate métastatique résistant à la castration :
nouvelle cible, nouvelle piste thérapeutique ?
3
.
Petrylak DP, Tangen CM, Hussain MH et al. Docetaxel and
estramustine compared with mitoxantrone and prednisone
for advanced refractory prostate cancer. N Engl J Med 2004;
351(15):1513-20.
4. De Bono JS, Logothetis CJ, Molina A et al. Abiraterone and
increased survival in metastatic prostate cancer. N Engl J Med
2011;364(21):1995-2005.
5. De Bono JS, Oudard S, Ozguroglu M et al. Prednisone
plus cabazitaxel or mitoxantrone for metastatic castration-
resistant prostate cancer progressing after docetaxel treat-
ment: a randomized open-label trial. Lancet 2010;376(9747):
1147-54.
6. Saad F, Gleason DM, Murray R et al.; Zoledronic Acid Prostate
Cancer Study Group. Long-term effi cacy of zoledronic acid
for the prevention of skeletal complications in patients with
metastatic hormone-refractory prostate cancer. J Natl Cancer
Inst 2004;96(11):879-82.
7. Fizazi K, Carducci M, Smith M et al. Denosumab versus
zoledronic acid for treatment of bone metastases in men with
castration-resistant prostate cancer: a randomised, double-
blind study. Lancet 2011;377(9768):813-22.
8. Lombardo LJ, Lee FY, Chen P et al. Discovery of N-(2-chloro-
6-methyl-phenyl)-2-(6-(4-(2-hydroxyethyl)-piperazin-1-yl)-
2-methylpyrimidin-4-ylamino)thiazole-5-carboxamide
(BMS-354825), a dual Src/Abl kinase inhibitor with potent
antitumor activity in preclinical assays. J Med Chem 2004;
47(27):6658-61.
9. Talpaz M, Shah NP, Kantarjian H et al. Dasatinib in imatinib-
resistant Philadelphia chromosome-positive leukemias. N Engl
J Med 2006;354(24):2531-41.
10.
Nam S, Kim D, Cheng JQ et al. Action of the Src family
kinase inhibitor, dasatinib (BMS-354825), on human prostate
cancer cells. Cancer Res 2005;65(20):9185-9.
11.
Tatarov O, Mitchell TJ, Seywright M et al. SRC family kinase
activity is up-regulated in hormone-refractory prostate cancer.
Clin Cancer Res 2009;15(10):3540-9.
12. Miyazaki T, Sanjay A, Neff L et al. Src kinase activity is essen-
tial for osteoclast function. J Biol Chem 2004;279(17):17660-6.
13. Recchia I, Rucci N, Festuccia C et al. Pyrrolopyrimidine c-Src
inhibitors reduce growth, adhesion, motility and invasion of
prostate cancer cells in vitro. Eur J Cancer 2003;39(13):1927-35.
14.
Saad F, Lipton A. SRC kinase inhibition: targeting bone
metastases and tumor growth in prostate and breast cancer.
Cancer Treat Rev 2010;36(2):177-84.
15. Karlou M, Tzelepi V, Efstathiou E. Therapeutic targeting
of the prostate cancer microenvironment. Nat Rev Urol 2010;
7(9):494-509.
16.
Park SI, Zhang J, Phillips KA et al. Targeting SRC family
kinases inhibits growth and lymph node metastases of pros-
tate cancer in an orthotopic nude mouse model. Cancer Res
2008;68(9):3323-33
.
17. Koreckij T, Nguyen H, Brown LG et al. Dasatinib inhibits
the growth of prostate cancer in bone and provides additional
protection from osteolysis. Br J Cancer 2009;101(2):263-8.
18. Yu EY, Wilding G, Posadas E et al. Phase II study of dasatinib
in patients with metastatic castration-resistant prostate cancer.
Clin Cancer Res 2009;15(23):7421-8.
19. Shah NP, Kantarjian HM, Kim DW et al. Intermittent target
inhibition with dasatinib 100 mg once daily preserves effi cacy
and improves tolerability in imatinib-resistant and intolerant
chronic phase chronic myeloid leukemia. J Clin Oncol 2008;
26(19):3204-12.
20.
Yu EY, Massard C, Gross ME et al. Once-daily dasatinib:
expansion of phase II study evaluating safety and effi cacy
of dasatinib in patients with metastatic castration-resistant
prostate cancer. Urology 2011;77(5):1166-71.
21. Araujo JC, Mathew P, Armstrong AJ et al. Dasatinib
combined with docetaxel for castration-resistant prostate
cancer: results from a phase 1-2 study. Cancer 2011;doi:
10.1002/cncr.26204. Epub ahead of print.
Références
(suite de la p. 167)
COU-12 + pubs.indd 322COU-12 + pubs.indd 322 13/12/11 16:1113/12/11 16:11
1
/
5
100%