Version 3 du 19.03.08 - Recherche Clinique Paris Centre

1/67
Protocole de recherche AOR06019, P060204
INTERET DU DOSAGE SERIQUE DE LA PROCALCITONINE
POUR REDUIRE LA CONSOMMATION D’ANTIBIOTIQUES
EN REANIMATION
Promoteur : Assistance Publique – Hôpitaux de Paris (AP- HP)
Direction de la Politique Médicale
Service de la Recherche Clinique et du Développement
Carré historique de l’hôpital Saint-Louis
1, avenue Claude Vellefaux – 75010 paris
www.drrc.ap-hop-paris.fr
Investigateur Coordonnateur
Dr Lila BOUADMA
Service de Réanimation Médicale-
Groupe hospitalier Bichat-Claude Bernard
46, rue Henri Huchard - 75018 Paris
Tél. : 01.40.25.77.07
Fax : 01.40.25.88.37
e.mail : lila.bouadm[email protected]
Chef de projet DRCD
Mme Aurélie Guimfack
DRCD - Hôpital Saint Louis
1,avenue Claude Vellefaux - 75010 Paris
Tél. : 01.44.84.17.98
Fax : 01.44.84.17.99
e.mail aurelie.guim[email protected]
Responsable URC Paris Nord
Dr Florence TUBACH
Unité de Recherche Clinique Paris Nord
Groupe hospitalier Bichat-Claude Bernard
46, rue Henri Huchard - 75018 Paris
Tél : 01.40.25.79.41
Fax : 01.40.25.67.73
e.mail : florence.tubac[email protected]
Version 3 du 19 mars 2008
P
rotocole PRORATA

2/67
LISTE DES PARTICIPANTS
Co-investigateurs coordonnateurs
• Pr Jean Chastre (investigateur principal)
Service de Réanimation Médicale
GH de la Pitié Salpetrière - 43 bd de l’Hôpital – 75013 Paris
• Pr Christian Brun-Buisson (investigateur principal)
Service de Réanimation Médicale
Hôpital Henri Mondor – 51 av de Lattre de Tassigny – 94010 Créteil
• Pr Michel Wolff
Service de Réanimation Médicale
GH Bichat-Cl Bernard - 46 Rue Henri Huchard - 75018 Paris
Co-investigateurs
• Pr Philippe Montravers
Service de Réanimation Chirurgicale
GH Bichat-Cl Bernard - 46, Rue Henri Huchard - 75018 Paris
• Dr Sigismond Lasocki (investigateur principal)
Service de Réanimation Chirurgicale
GH Bichat-Cl Bernard - 46, Rue Henri Huchard - 75018 Paris
• Pr Jean-François Timsit (investigateur principal)
Service de Réanimation Médicale
Hôpital Michalon - BP 217 - 38043 Grenoble Cedex 9
• Dr Charles-Edouard Luyt
Service de Réanimation Médicale
GH de la Pitié Salpetrière - 43 bd de l’Hôpital – 75013 Paris
• Pr Benoît Veber (investigateur principal)
Service de Réanimation Médicale
Hôpital Charles Nicolle - 1 rue Germont - 76031 Rouen
• Dr Christophe Cracco (investigateur principal)
Unité de Réanimation, Service de Pneumologie
GH de la Pitié-Salpétrière - 43 bd de l'hôpital - 75013 Paris
• Pr Bernard Régnier
Service de Réanimation Médicale et Infectieuse
GH Bichat-Cl Bernard - 46 Rue Henri Huchard - 75018 Paris
• Dr Nathalie Mémain (investigateur principal)
Service de Réanimation Médicale
Hôpital Delafontaine - 2 rue Docteur Delafontaine - 93200 Saint Denis

3/67
LISTE DES PARTICIPANTS (suite)
Méthodologie et analyse statistique
Dr Florence TUBACH
Département d'Epidémiologie, de Biostatistique et de Recherche Clinique
GH Bichat-Claude Bernard - 46 rue Henri Huchard - 75018 Paris
Tél. : 01 40 25 67 51
Fax : 01 40 25 67 73
Représentants du Promoteur APHP
• Département de la Recherche Clinique et du développement (DRCD)
Hôpital Saint Louis
1, avenue Claude Vellefaux - 75010 Paris
Aurélie GUIMFACK
Tél. : 01.44.84.17.98
Fax : 01.44.84.17.99
e.mail : [email protected]
Christine LANAU
Tél. : 01.44.84.17.89
Fax : 01.44.84.17.99
e.mail : [email protected]
• Unité de Recherche Clinique Paris Nord
Département d'Epidémiologie, de Biostatistique et de Recherche Clinique
GH Bichat-Claude Bernard - 46 rue Henri Huchard - 75018 Paris
Dr Florence TUBACH
Tél. : 01 40 25 79 41
Fax : 01 40 25 67 73
e.mail : [email protected]
Isabelle HOFFMANN
Tél. : 01 40 25 79 65
Fax : 01 40 25 73 81
e.mail : [email protected]

4/67
Page de SIGNATURE D'UN PROTOCOLE de recherche biomédicale
par l’investigateur COORDONNATEUR et le représentant du PROMOTEUR
Code de la Recherche biomédicale : P060204
Titre : « Intérêt du dosage sérique de la Procalcitonine pour réduire la consommation
d’antibiotiques en réanimation.»
Version N° 03 du : 19 mars 2008
L’investigateur coordonnateur
:
Docteur Lila BOUADMA
Service de Réanimation Médicale
Hôpital Bichat - Claude Bernard
46, rue Henri Huchard - 75018 Paris
Date : ………/………/………..
Signature :
Le promoteur
:
Docteur Olivier CHASSANY
Assistance publique – Hôpitaux de Paris
Délégation Interrégionale à la Recherche Clinique
Hôpital Saint Louis
1, avenue Claude Vellefaux - 75010 PARIS
Date : ………/………/………..
Signature :
NB : cette version correspond au texte du protocole et annexes adressés au CPP et à
l’autorité compétente respectivement pour avis et demande d’autorisation.
Si ensuite une autre version est rédigée suite à des modifications, il faut refaire le circuit des
signatures afin d’être toujours à jour des versions du protocole actif.

5/67
TABLE DES MATIERES
1. Résumé .............................................................................................................................. 7
2. Introduction et justification de la recherche, résultats attendus et perspectives ....... 8
3. Données de la littérature et pré-requis ........................................................................... 9
3.1. PCT et diagnostic des infections bactériennes communautaires et du sepsis ............ 9
3.2. PCT et diagnostic des infections nosocomiales ....................................................... 11
3.3. PCT et résultats d’une méta-analyse récente ........................................................... 12
3.4. Valeur pronostique de la PCT .................................................................................. 12
3.5. Données sur les durées de l’antibiothérapie ............................................................. 12
4. Objectifs de la recherche (Hypothèses testées, objectif primaire, objectifs
secondaires) ............................................................................................................................. 13
4.1. Hypothèse testée ....................................................................................................... 13
4.2. Objectif primaire ...................................................................................................... 14
4.3. Objectifs secondaires ................................................................................................ 14
5. Plan expérimental ........................................................................................................... 15
5.1. Choix du plan expérimental et justification ............................................................. 15
5.1.1. Une étude multicentrique ................................................................................. 15
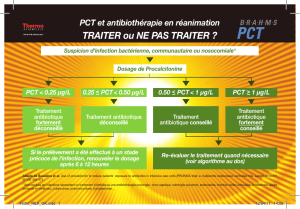
5.1.2. L’algorithme décisionnel .................................................................................. 15
5.1.3. Le ‘traitement usuel’ comme groupe de comparaison ..................................... 17
5.1.4. Une randomisation individuelle ....................................................................... 17
5.1.5. Le nombre de jours vivant sans antibiotique comme critère de jugement ....... 18
5.2. Critères de sélection (inclusion et non inclusion) des personnes ............................. 19
5.2.1. Critères d’inclusion .......................................................................................... 19
5.2.2. Critères de non inclusion ................................................................................. 19
5.2.3. Mode de recrutement ........................................................................................ 20
5.2.4. Nombre prévu de personnes et justification ..................................................... 20
5.2.5. Durée de participation de chaque personne .................................................... 21
6. Schéma et conduite de la recherche .............................................................................. 21
6.1. Déroulement de l’étude ............................................................................................ 21
6.1.1. Vérification des critères d’inclusion et de non-inclusion après examen clinique
et résultat des premiers examens complémentaires ......................................................... 21
6.1.2. Information et recueil du consentement éclairé si possible ............................. 21
6.1.3. Procédure de randomisation ............................................................................ 21
6.1.4. Bras expérimental ............................................................................................ 21
6.1.5. Bras standard ................................................................................................... 22
6.1.6. Dosage de Procalcitonine ................................................................................ 22
6.1.7. Constitution d’une plasmathèque ..................................................................... 22
6.2. Suivi des patients, chronologie et contenu des visites ............................................. 23
6.3. Durée totale prévisionnelle de la recherche : 24 mois ............................................. 24
6.4. Règles d’arrêt ........................................................................................................... 24
7. Médicaments, matériel ou procédures évalué(e)s ........................................................ 25
8. Critères d’évaluation ...................................................................................................... 27
8.1. Critères de jugement principaux .............................................................................. 27
8.2. Critères de jugement secondaires ............................................................................. 27
8.3. Variables mesurées et calendrier des évaluations dans les différents groupes ........ 28
8.3.1. Données recueillies entre J1 et J28 .................................................................. 29
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
1
/
67
100%