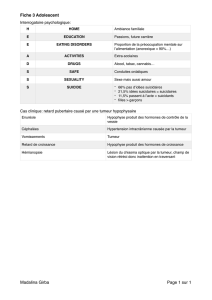
Lire l'article complet

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XVI - n° 9 - novembre 2012
275
Cas clinique
Tumeur surrénalienne
androgéno sécrétante :
un cas d’hirsutisme peu ordinaire
Ludovic Appert, Christine Do Cao*
* Service d’endocrino-
logie, de diabétologie
et métabolisme, hôpital
Claude-Huriez, Lille.
Observation
Mme B., âgée de 32 ans, 2 grossesses, 1 naissance, en
spanioménorrhée depuis plusieurs années, consulte en
2012 pour une infertilité secondaire. Elle a pour seuls
antécédents des lithiases rénales non calciques (3 épi-
sodes de colique néphrétique jusqu’à l’âge de 21 ans).
Elle n’a aucun traitement médicamenteux et ne prend
pas d’œstroprogestatifs.
Anamnèse
Une première grossesse a été mise en route sans diffi-
culté à l’âge de 24 ans, au cours de laquelle la patiente
constate le développement d’une pilosité excessive,
qui sera attribuée aux modifications hormonales ges-
tationnelles. Au terme de cette grossesse, naît une fil-
lette de poids normal, bien portante. L’enfant présente
cependant une clitoridomégalie isolée, conduisant
à des dosages hormonaux qui vont écarter un bloc
enzymatique surrénalien.
L’hirsutisme maternel va perdurer dans le post-partum,
s’aggravant même au fil des années au niveau du visage,
de la poitrine, du dos, des mains, de la ligne blanche
abdominale et des membres inférieurs. Une à deux
épilations hebdomadaires sont devenues nécessaires,
mais la jeune femme s’en accommode. Après l’accou-
chement, 3 dosages de testostérone totale sont réalisés
chez Mme B., en 2007, 2009 et 2011 ; ils montrent des
taux élevés, respectivement à 1,69, 2,14 et à 1,50 ng/ml
(N < 0,76). Ces premières analyses n’ont pas été suivies
d’explorations étiologiques complémentaires.
Mme B. se juge par ailleurs en excellente santé et n’a
jamais ressenti de gêne ni de douleur abdominale.
Une évaluation endocrinologique est proposée à l’issue
de la consultation présente.
Examen clinique
L’examen note un hirsutisme évident, diffus, isolé, ins-
tallé brutalement 8 années auparavant, modérément
évolutif depuis. Le score de Ferriman et Gallwey est
à 24/36. Les autres signes d’hyperandrogénie (acné,
alopécie, morphotype masculin, etc.) sont absents. Il
n’y a pas d’hypercorticisme associé. L’état général est
en effet conservé, la tension artérielle est mesurée à
106/73 mmHg, le poids est de 63 kg pour une taille
de 1,68 m.
Analyses hormonales
✓17 hydroxyprogestérone : 1,35 ng/ml (N < 5,2).
✓Sulfate de DHEA : 688 μg/dl (N < 340).
✓Androsténedione : 11,55 ng/ml (N < 2,07).
✓Testostéronémie : 1,33 ng/ml (N < 0,76).
Examens morphologiques
✓
Échographie ovarienne : ovaires de taille normale,
non kystiques (pelvis et abdomen non explorés).
✓
TDM surrénalienne en coupes fines, injectée (image) :
présence d’une masse surrénalienne gauche mesurant
8 cm de grand axe, bien limitée, de densité spontanée
égale à 40 UH, avec un lavage absolu de 50 % et un
Image. TDM abdominale coupe axiale : mise en évidence d’une masse surrénalienne gauche.

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XVI - n° 9 - novembre 2012
276
Cas clinique
lavage relatif de 37 %. La lésion est homogène, sans
calcifications, sans image de thrombus dans la veine sur-
rénalienne. La glande surrénale controlatérale est fine.
Complément d’investigation
✓
Pas d’argument pour un cancer du sein, un lym-
phome, un cancer pulmonaire, un mélanome ; à l’exa-
men clinique, la masse surrénalienne n’est pas palpable.
✓Normalité du dosage des autres stéroïdes surréna-
liens, des métanéphrines plasmatiques et urinaires, de
la chromogranine A.
✓
Scintigraphie TEP-TDM au 18FDG : la masse surréna-
lienne est le siège d’un hypermétabolisme glucidique
modéré : SUV (max) = 3,3 g/ml, et rapport SUV tumeur/
foie = 0,8. Il n’y a pas d’autres foyers de fixation du FDG
sur le corps entier.
Diagnostic retenu
Le diagnostic est celui d’une tumeur surrénalienne viri-
lisante. La tumeur est volumineuse mais non remaniée
(sans zone évocatrice de saignement ou de nécrose
intratumorale) et non hypermétabolique. Elle sécrète
des androgènes de manière exclusive. L’hirsutisme est
isolé, d’aggravation progressive. L’imagerie corps entier
ne décèle pas de lésion suspecte de métastase après
au moins 8 années d’évolution tumorale.
Traitement
Il consiste en une surrénalectomie gauche associée à un
curage ganglionnaire réalisé par laparotomie. L’examen
anatomopathologique définitif est en faveur d’une
tumeur cortico-surrénalienne de score de Weiss égal
à 2/9, sans envahissement ganglionnaire, vasculaire ni
capsulaire. L’index Ki67 est de 1,5 %. La tumeur d’exé-
rèse complète est classée en lésion de bon pronostic
(analyse des marqueurs moléculaires pronostiques en
cours). Un traitement adjuvant par O,p’DDD ne semble
pas indiqué. En postopératoire, les taux d’androgènes
se normalisent. Une surveillance clinique et un scanner
abdominal sont néanmoins organisés à distance en
raison de la taille tumorale au diagnostic.
Discussion
Dans cette observation, l’argumentation diagnostique
(hyperandrogénie tumorale ? malignité ? bénignité ?) s’est
modifiée au fur et à mesure de l’analyse des éléments
cliniques et paracliniques. Dans un premier temps, on
pouvait présumer d’un hirsutisme d’origine tumorale
sur l’intensité de l’expression clinique et le taux de testo-
stérone sérique. Dans un second temps, on évoquait a
contrario la possible bénignité de cette tumeur cortico-
surrénalienne malgré sa taille, en raison de la latence
d’évolution, de l’aspect homogène en tomodensitométrie
et de l’absence de fixation significative en 18TEP-FDG.
Dès le départ, plusieurs éléments cliniques orientaient
vers une vraisemblable origine tumorale de l’hirsutisme.
C’est, d’abord, la rapidité d’installation de l’hirsutisme
– en quelques mois –, son étendue et son intensité
avec un score de Ferriman et Gallwey non équivoque.
Les circonstances d’apparition sont également inha-
bituelles. La grossesse est en effet une période durant
laquelle la mère est théoriquement protégée de l’effet
des androgènes par une synthèse accrue de la protéine
de transport de la testostérone, par l’aromatisation des
androgènes par le placenta et par la surproduction de
progestérone (1).
D’autre part, la virilisation des organes génitaux
externes chez l’enfant devait témoigner d’une impré-
gnation androgénique particulièrement importante et
prolongée. La masculinisation d’un fœtus féminin par
le passage transplacentaire d’androgènes provenant de
la mère est de fait un événement rarissime : c’est géné-
ralement le fait d’une prise d’hormones virilisantes, et,
exceptionnellement, la conséquence d’une tumeur
surrénalienne androgénosécrétante. L.F. Morris et al.
ont néanmoins décrit le cas d’une ambiguïté sexuelle
chez un nouveau-né de caryotype 46 XX causée par
un carcinome cortico-surrénalien maternel sécrétant
des androgènes et du cortisol. Fait remarquable, la
patiente était parfaitement asymptomatique avant sa
grossesse. Une surexpression de récepteurs LH/HCG par
la tumeur maternelle était mise en évidence, avançant
l’hypothèse que la grossesse ait pu stimuler à la fois la
croissance tumorale et la production des hormones
masculinisantes (2). La similitude du cas étudié par
L.F. Morris et al. avec le nôtre – en particulier, l’histoire
clinique gestationnelle – nous a conduit également
à demander la recherche de récepteurs illégitimes à
l’HCG sur la tumeur maternelle (étude en cours).
Le taux de testostérone devait faire suspecter une cause
tumorale. Chez la femme, une testostéronémie totale
supérieure à 1,5, voire 2 ng/ml permet en théorie de
départager le syndrome des ovaires polykystiques
(SOPK) d’étiologies tumorales plus rares mais graves
(3). La figure ci-contre résume ainsi les orientations
diagnostiques en fonction de la testostérone totale et
de l’anamnèse clinique (4).
En termes de fréquence, les étiologies de l’hirsu-
tisme chez la femme sont largement dominées
par le syndrome des ovaires polykystiques dont la
prévalence varie entre 72 % et 86 % selon les séries
(5). Les causes minoritaires sont représentées par

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XVI - n° 9 - novembre 2012
277
Tumeur surrénalienne androgéno sécrétante : un cas d’hirsutisme peu ordinaire
le déficit en 21 hydroxylase (moins de 5 % des cas),
d’autres endocrinopathies (syndrome de Cushing,
hyperprolactinémie, dysthyroïdie, acromégalie) et
l’hirsutisme idiopathique. La prévalence des tumeurs
androgéno-sécrétantes chez les patientes consultant
pour hirsutisme apparaît extrêmement faible, éva-
luée à 0,2 %, et la moitié de ces cas sont malins (6-7).
Cette estimation demande néanmoins confirmation,
car les données disponibles proviennent de séries
rétrospectives s’intéressant aux tumeurs androgéno-
sécrétantes diagnostiquées dans des circonstances
diverses et elles ne sont pas issues de l’analyse d’une
population de femmes explorées de premier abord
pour hirsutisme.
Dans l’observation présente, l’évolution rapide, la sévé-
rité des symptômes et la taille tumorale de 8 cm auraient
pu faire craindre la malignité (8). Cependant, l’absence
de caractère multisécrétoire, la latence d’évolution,
l’absence d’extension locorégionale au scanner et les
caractéristiques en 18TEP-FDG évoquaient finalement
une tumeur indolente.
Les critères discriminants pour préjuger de la nature
maligne ou bénigne sont en général le profil sécrétoire,
la taille lésionnelle associée à d’autres caractéristiques
tomodensitométriques, l’avidité ou non de la tumeur
pour le FDG.
Les publications corrélant la taille et la nature des
tumeurs surrénaliennes sécrétant exclusivement des
androgènes sont rares et rassemblent de faibles effectifs.
Dans une série rétrospective et pédiatrique regroupant
23 patients ayant une tumeur surrénalienne andro-
géno-sécrétante, une tumeur surrénalienne mesurant
plus de 10 cm était maligne dans 100 % des cas, tandis
qu’une tumeur mesurant moins de 5 cm était toujours
bénigne. Entre 5 et 9 cm, la tumeur était bénigne dans
7 cas sur 10 (9).
Nous disposons chez l’adulte de l’étude rétrospective
lilloise colligeant 21 cas de tumeurs cortico-surréna-
liennes sécrétant des androgènes de manière exclu-
sive et identifiées parmi 801 tumeurs surrénaliennes
opérées entre 1970 et 2003. Cette revue confirme
la rareté de cette entité. Le groupe de 11 cas de
tumeurs bénignes ou indéterminées (score de Weiss
≤ 3) a été comparé au groupe de 10 cas de tumeurs
malignes (score de Weiss ≥ 4). Il s’agissait unique-
ment de femmes. L’âge et la nature des androgènes
secrétés n’étaient pas différents. En revanche, le taux
de testostérone totale était 2,6 fois plus élevé dans
le groupe des tumeurs malignes. De même, taille et
masse tumorale étaient significativement plus impor-
tantes dans le groupe de cas de tumeur maligne (13,7
versus 9,2 cm et 1 462 versus 206 g) [10].
Même lorsque le scanner n’apporte pas les éléments
nécessaires au diagnostic, la place de la TEP-FDG
dans le diagnostic de malignité des tumeurs surré-
naliennes est encore débattue. Le consensus pour
la prise en charge des incidentalomes surrénaliens,
publié en 2007 sous l’égide de la SFE, ne recomman-
dait la réalisation d’une TEP au FDG qu’en situation
de néoplasie évidente (tumeur d’emblée suspecte
ou volumineuse en TDM ou en IRM, recherche d’un
foyer tumoral extra-surrénalien, recherche d’un lym-
phome, etc.), en raison de la faible prévalence des
cortico-surrénalomes comparée à la fréquence des
tumeurs surrénaliennes de plus de 1 cm découvertes
par hasard à l’imagerie (11). Dans une méta-analyse
récente regroupant les résultats de 21 études, soit
l’analyse de 1 391 lésions surrénaliennes (824 bénignes,
567 malignes), la sensibilité et la spécificité de la TEP
au FDG pour différencier une tumeur bénigne d’une
tumeur maligne était respectivement de 97 % (IC
95
:
0,93-0,98) et de 91 % (IC95 : 0,87-0,94) [12]. Un para-
mètre discriminant et reproductible dans un centre
donné semble être le rapport de SUVmax tumeur/foie.
Selon M. Okada et al., dont le travail repose sur l’étude
de 35 tumeurs surrénaliennes dont 19 malignes, ce
rapport, lorsqu’il est supérieur à 1,8 permettait de dif-
férencier une tumeur maligne d’une tumeur bénigne,
avec une sensibilité de 85 %, une spécificité de 100 %,
une valeur prédictive positive de 100 % et une valeur
prédictive négative de 83 % (13).
Même en l’absence de contexte néoplasique connu,
la TEP au 18FDG semble pouvoir prédire la malignité
Figure. Arbre décisionnel devant un cas d’hirsutisme (adapté de [4]).
Hirsutisme
Testostérone
Récent
Virilisation
> 2 ng/ml
Imagerie des
surrénales et des ovaires
Tumeur
(0,6 % à 2,1 %)
Depuis la puberté
Oligoménorrhée
< 1,5 ng/ml
Échographie des ovaires
17-OH progestérone
SOPK (72 % à 86 %)
ou bloc 21-hydroxylase (1,4 % à 4 %)
Ancien
Règles régulières
Cycles ovulatoires
< 0,6 ng/ml
Échographie des ovaires
normale
Hirsutisme idiopathique ?
(5 % à 8%)

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XVI - n° 9 - novembre 2012
278
Nouvelles de l’industrie pharmaceutique
Communiqués des conférences de presse, symposiums, manifestations organisés par l’industrie pharmaceutique
Cas clinique
d’une tumeur surrénalienne d’après l’étude prospective
menée à Cochin et s’intéressant spécifiquement à la
question. Dans cette série de 77 tumeurs surrénaliennes
de diagnostic histologique prouvé (43 adénomes,
22 carcinomes, 12 tumeurs non corticales), le recours
à un rapport SUV max tumeur/foie avec un seuil de 1,45
permettait de distinguer un carcinome cortico-surréna-
lien d’un adénome avec une sensibilité de 100 % et une
spécificité de 88 %. Les auteurs ont également souligné
une forte corrélation entre le rapport SUV max tumeur/
lésion et le score de Weiss en cas de tumeur corticale.
En revanche, l’intensité de la fixation en TEP au FDG
n’était pas corrélée à la capacité sécrétoire lésionnelle
(14). Dans le cas clinique présent, le rapport SUVmax
tumeur/lésion est à 0,8 avec un score de Weiss de 2/9
correspondant aux observations de Cochin.
L’adénome cortico-surrénalien mesure en général moins
de 5 cm. Un score de Weiss de 0 ou 1 permet d’exclure
la malignité avec un faible risque d’erreur. Un score de
Weiss ≥ 4 signe la malignité. Les cas de score intermé-
diaire doivent inciter à une certaine prudence, surtout
s’il existe des éléments atypiques (comme la taille tumo-
rale), car la lecture des items du score de Weiss peut
être prise en défaut. La caractérisation d’éventuelles
anomalies génétiques (perte d’hétérogyzotie en 11p15,
17p13, surexpression d’IGF-II, de p53, de la βcaténine…)
peut aider à mieux apprécier le risque de rechute pour
adapter la surveillance au long cours.
■
1.Kanova N, Bičíková M. Hyperandrogenic states in pregnancy.
Physiol Res 2011;60(2):243-52.
2.
Morris LF, Park S, Daskivich T et al. Virilization of a female
infant by a maternal adrenocortical carcinoma. Endocrine
Practice 2011;(17)2:
3.Pugeat M, Déchaud H, Raverot V et al. Recommandations
pour l’exploration des hyperandrogénies. Ann Endocrinol
2010;7:e3-e8.
4.Droumaguet C, Salenave S, Brailly-Tabard S, Young J.
Hyperandrogénie et hirsutisme. EMC (Elsevier Masson SAS,
Paris), Endocrinologie-Nutrition 2010;10-033-G-10.
5.Azziz R, Sanchez LA, Knochenhauer ES et al. Androgen excess
in women: experience with over 1000 consecutive patients. J
Clin Endocrinol Metab 2004;89:453-62.
6.Carmina E, Rosato F, Jannì A, Rizzo M, Longo RA. Extensive
clinical experience: relative prevalence of different androgen
excess disorders in 950 women referred because of clinical
hyperandrogenism. J Clin Endocrinol Metab 2006;91:2-6.
7.Kaltsas GA, Isidori AM, Kola BP et al. The value of the low-
dose dexamethasone suppression test in the differential
diagnosis of hyperandrogenism in women. J Clin Endocrinol
Metab 2003;88:2634-43.
8.Allolio B, Fassnacht M. Adrenocortical carcinoma: clinical
update. J Clin Endocrinol Metab 2006 91(6):2027-37.
9.Wolthers OD and al. Androgen secreting adrenocorti-
cal tumours. London Centre for Paediatric Endocrinology,
Middlesex Hospital, UK.
10.Moreno S, Montoya G, Armstrong J et al. Profile and out-
come of pure androgen-secreting adrenal tumors in women:
experience of 21 cases. Surgery 2004;136(6):1192-8.
11.Tabarin A, Bardet S, Bertherat J et al. Exploration and
management of adrenal incidentalomas. French Society of
Endocrinology Consensus. Ann Endocrinol 2008;69:487-500.
12.
Boland GW, Dwamena BA, Jagtiani Sangwaiya M et al.
Characterization of Adrenal Masses by Using FDG PET: A
Systematic Review and Meta-Analysis of Diagnostic Test
Performance. Radiology 2011;(259):1.
13.Okada M, Shimono T, Komeya Y et al.
Adrenal masses:
the value of additional fluorodeoxyglucose-positron emission
tomography/computed tomography (FDG-PET/CT) in diffe-
rentiating between benign and malignant lesions. Ann Nucl
Med 2009;23(4):349-54.
14. Groussin L, Bonardel G, Silvéra S et al.
18F-Fluorodeoxyglucose Positron Emission Tomography for
the Diagnosis of Adrenocortical Tumors: A Prospective Study in
77 Operated Patients. J Clin Endocrinol Metab 2009;94:1713-22.
Références
bloc-NoTes
Société francophone du diabète
et Société de néphrologie
Journée thématique
auralieulevendredi7décembre2012,de8h45à17h00
Centre d’information scientifique de l’Institut Pasteur (CIS)
Institut Pasteur - 28, rue du docteur-Roux - 75015 PARIS
Organisation :
Michel Marre (Paris)
Maurice Laville (Lyon)
Samy Hadjadj (Poitiers)
Contact : Carte blanche
Tél. : +33(0) 5 63 72 30 68
Fax : +33(0) 5 63 72 30 32
Contact. jthem@sfdiabete.cborg.ne
1
/
4
100%