Lire l'article complet

Thérapie biologique des maladies inflammatoires
chroniques intestinales
Biologic therapies in inflammatory bowel diseases
●A. Bourreille
1, 2
, M. Flamant
2
RÉSUMÉ.
La maladie de Crohn et la rectocolite hémorragique font partie des maladies inflammatoires chroniques intestinales. Ces atteintes
se caractérisent par l’existence dans la muqueuse du tube digestif d’une intense réaction inflammatoire incontrôlée d’évolution chronique et
récidivante. La physiopathologie est encore incomplètement connue,mais fait intervenir des facteurs environnementaux sur un terrain géné-
tiquement prédisposé. Les progrès réalisés dans la compréhension de la réponse immunitaire digestive et de ses mécanismes de régulation ont
permis de définir de nouvelles cibles thérapeutiques. L’infliximab est le premier agent biologique utilisé pour le traitement des patients atteints
de maladie de Crohn, mais de nombreuses molécules sont actuellement en cours d’évaluation.
Mots-clés :
Maladies inflammatoires chroniques intestinales (MICI) - Maladie de Crohn (MC) - Rectocolite hémorragique (RCH) -
Interleukine (IL) - Tumor necrosis factor (TNF) - Traitement.
ABSTRACT.
Crohn’s disease and ulcerative colitis are idiopathic inflammatory bowel diseases characterized by a severe, chronic and relap-
sing mucosal inflammation in the small and large bowel. Physiopathology is incompletely understood, but inflammatory bowel diseases are
thought to result from interactions between environmental factors and a genetically predisposed inheritance. The ongoing research in muco-
sal immunology allows us to determine new therapeutic targets. Infliximab is the first and only biologic treatment approved for the treatment
of inflammatory bowel disease but new biologic agents are currently evaluated in several clinical trials both in Crohn’s disease and ulcerati-
ve colitis.
Key w o rd s :
I n fl a m m at o ry bowel disease (IBD) - Cro h n ’s disease (CD) - Ulcerat ive colitis (UC) - Interleukin (IL) - Tumor necrosis factor (TNF) -
Treatment.
L
es maladies inflammatoires chroniques intestinales
(MICI) regroupent deux affections principales : la
maladie de Crohn (MC) et la rectocolite hémorra-
gique (RCH). Ces maladies touchent le sujet jeune et évoluent
de façon chronique par poussées entrecoupées de rémissions
plus ou moins longues. Les données épidémiologiques en
provenance des pays anglo-saxons ou scandinaves ont montré
une augmentation de l’incidence de la RCH et de la MC dans
la seconde moitié du XX
e
siècle jusque dans les années 1990.
Les données épidémiologiques françaises proviennent de
deux registres de la région Nord-Ouest (EPIMAD) et des
départements bretons (ABERMAD). Dans notre pays, l’inci-
dence de la RCH, voisine de 3,5 nouveaux cas par an pour
100 000 habitants, est plus faible que celle de la MC, com-
prise entre 5 et 6 nouveaux cas par an et pour 100 000 habi-
tants. Ces deux maladies touchent les sujets jeunes des deux
sexes sans réelle prédominance, avec un pic de fréquence aux
alentours de la troisième décennie.
Les MICI sont des maladies évoluant par poussées succes-
sives. La physiopathologie est encore mal connue, mais
implique des facteurs environnementaux, bactériens et immu-
nologiques sur un terrain génétique prédisposant.
STRATÉGIE THÉRAPEUTIQUE :
RECOMMANDATIONS ACTUELLES
Le traitement médical associe le traitement de la poussée,
dont le but est d’obtenir une disparition des symptômes diges-
t i f s , et le traitement d’entre t i e n , visant à pro l o n g er les
périodes de rémission. Le traitement chirurgical est, quant à
lui, réservé aux complications de l’inflammation digestive
(hémorragies, sténoses, perforations, dysplasies) ou en cas
1
Hépato-gastroentérologie et assistance nutritionnelle, CHU Hôtel-Dieu, 44093
Nantes Cedex.
2
INSERM U539, CHU Hôtel-Dieu, 44093 Nantes Cedex.
116
La Lettre du Pharmacologue - Volume 18 - n° 4 - octobre-novembre-décembre 2004
T
H É R A P E U T I Q U E

d ’ é c hec du traitement médical. Les re c o m m a n d at i o n s
actuelles préconisent l’utilisation d’anti-infl a m m a t o i r e s
digestifs non stéroïdiens (5-aminosalicylates) ou stéroïdiens
(prednisone, budésonide) et d’immunosuppresseurs (azathio-
prine ou 6-mercaptopurine, ciclosporine, méthotrexate). Les
indications dépendent de l’étendue,de la sévérité et de la
réponse aux traitements de première intention. Les aminosa-
licylates sont indiqués en première intention pour le traite-
ment des poussées faibles à modérées de RCH et de MC. Ils
sont également indiqués à des doses plus faibles en traitement
d’entretien. Si leur efficacité est reconnue et démontrée au
cours de la RCH tant en poussée qu’en entretien, elle est plus
contestée au cours de la MC, en raison de la très grande varia-
bilité des résultats des essais cliniques.
Les anti-inflammatoires stéroïdiens sont indiqués dans les
poussées modérées à sévères de RCH ou de MC ou en secon-
de intention après l’échec des aminosalicylates. La predniso-
ne à forte dose est efficace dans 50 à 90 % des cas ; cepen-
dant, les corticoïdes ne peuvent être utilisés au long cours en
raison de leurs nombreux effets indésirables. Par ailleurs,
30 % des patients deviennent corticodépendants, ayant des
rechutes à chaque tentative de sevrage ou lors de la décrois-
sance progressive des doses de prednisone. Chez ces patients
comme chez ceux ayant une maladie chronique active avec
des poussées répétées sans intervalle libre,
les immu n o s u p p r e s s e u r s sont indiqués
pour aider au sevrage en corticoïdes et
maintenir la maladie quiescente.
L’azathioprine et son métabolite, la 6-mer-
captopurine, sont efficaces dans la RCH et
la MC. Leur délai d’action médian est de
6 mois, ce qui empêche leur utilisation en
t raitement d’at t a q u e . Le délai d’action
n’est pas raccourci par l’utilisation de la
voie parentérale. À l’inverse, la ciclospori-
ne est rapidement effica c e , mais ses effe t s
i n d é s i r ables (hy p e r tension art é ri e l l e ,n é p h r o-
t ox i c i t é , i m mu n o s u p p r ession) contre - i n d i-
quent son utilisation au long cours en tra i t e-
ment d’entretien. La cicl o s p o r ine est indi-
quée dans les RCH aiguës graves en troisiè-
me ligne de traitement après l’échec des
aminosalicylates et des corticoïdes. Plus
récemment, le méthotrexate a été utilisé en
traitement d’entretien de la MC en admi-
nistration hebdomadaire. Son délai d’ac-
tion est de 4 à 8 semaines et son efficacité
est plus importante en administration par
voie intramusculaire qu’orale. La tolérance
est bonne,notamment du fait de la préven-
tion des effets indésirables par la prise
d’acide folinique. De ce fait, le traitement
n’impose plus la réalisation d’une biopsie hépatique systéma-
tique. Il n’existe pas suffisamment de données pour préconi-
ser son utilisation dans la RCH.
Les travaux concernant le système immunitaire du tube diges-
tif chez l’animal et chez l’homme ont permis, ces dernières
années, d’identifier de nouvelles voies d’activation lympho-
cytaire, de signalisation et des populations lymphocytaires
impliquées dans la physiopathologie des MICI. Ces progrès
sont à la base du développement de nouvelles molécules dites
biologiques. Les molécules testées dans les MICI correspon-
dent à des protéines recombinantes, à des anticorps monoclo-
naux chimériques ou humanisés ou à des oligonucléotides
antisens anti-ARN.
PHYSIOPATHOLOGIE, NOUVELLES CIBLES MOLÉCULAIRES
ET NOUVEAUX TRAITEMENTS
(tableau I)
Physiopathologie
En fonction de la nature et de la concentration antigénique, la
réponse immunitaire cellulaire du tube digestif est orientée
soit vers un profil de type T-helper (Th) 1, caractérisée par la
production d’interféron (IFN)γ,d’interleukine (IL)-2 et de
tumor necrosis factor (TNF), soit un profil de type Th2 carac-
Tableau I. Molécules utilisées ou en cours d’éva l u ation dans les MICI chez l’homme.
Cible thérapeutique Firme Indication
Inhibiteur de prolifération des lymphocytes
D i ff é r e n c i ation des ly m p h o cytes CD4+ en ly m p h o cytes de type Th1 ou Th 2
Cytokines anti-inflammatoires
Anticorps anti-IL-2R (daclizumab) Zenapax, Roche RCH
Anticorps anti-IL-2R (basiliximab) Simulect, Novartis RCH
Anticorps anti-IL-12 Genetics Institute MC
Anticorps anti-IL-18 MC
IL-10 (tenovil) Schering-Plough MC, RCH
IL-11 Genetics Institute MC
Circulation entéro-lymphatique
Anticorps anti-α4 (natalizumab) Elan Pharmaceuticals MC, RCH
Anticorps anti-α4ß7 (MLN-2) Millenium Pharmaceuticals MC, RCH
Antisens anti-ICAM-1 ISIS 2302 (alicaforsen) ISIS Pharmaceuticals MC, RCH
Inhibiteur de TNF
Anticorps anti-TNFαchimérique (infliximab) Centocor MC
Anticorps anti-TNFαhumanisé (CDP571, 870) Celltech MC, RCH
Anticorps anti-TNFαhumanisé (adalimumab) Abbott MC
Récepteur de TNFα(etanercept) Immunex MC
Protéine de fusion au TNFαp55 (onercept) Serono MC
Rational Design Peptide 58 SangStat RCH
Inhibiteur de Map-Kinase (BIRB) Boehringer MC
Facteurs de croissance
Keratinocyte growth factor (repifermin) Human Genome Sciences RCH
Epidermal growth factor Heber Biotec RCH
IL : interleukine ; IL-2R : récepteur à l’IL-2 ; MC : maladie de Crohn ; RCH : rectocolite hémorr a g i q u e ;
TNF : tumor necrosis factor.
La Lettre du Pharmacologue - Volume 18 - n° 4 - octobre-novembre-décembre 2004
117
T
H É R A P E U T I Q U E

118
La Lettre du Pharmacologue - Volume 18 - n° 4 - octobre-novembre-décembre 2004
T
H É R A P E U T I Q U E
t é risé la production d’IL-4, d ’ I L - 5 , d’IL-10 et d’IL-13.
Physiologiquement, la réponse immunitaire Th1 ou Th2 est
contrôlée par différents signaux provenant des cellules pré-
sentatrices de l’antigène ou de lymphocytes régulateurs. Les
MICI n’échappent pas à cette dichotomie et représentent un
exemple de déséquilibre de la réponse immune aboutissant à
un emballement de l’inflammation (figure1). Les facteurs
responsables du déclenchement de la réponse immunitaire et
de sa chronicité ne sont pas connus, mais de nombreux argu-
ments sont en faveur du rôle essentiel de la flore digestive. En
effet, il existe chez les patients atteints de MICI :
✓une augmentation de la perméabilité intestinale favorisant
le passage d’antigènes bactériens luminaux dans la
lamina
propria
;
✓une rupture de tolérance du système immunitaire vis-à-vis
de la flore digestive autologue ;
✓chez des patients atteints de MC et ayant une mutation du
gène Nod-2/Card15, une insuffisance de la réponse immuni-
taire innée vis-à-vis de la flore digestive favorisant la réponse
acquise antigène-dépendante
(1)
.
Dans la MC, il existe de nombreux arguments en faveur d’une
réponse de type Th1 secondaire à la production excessive
d’IL-12 et d’IL-18 par les macrophages activés présents dans
la
lamina propria
. Les lymphocytes produisent en réponse de
grandes quantités d’IFNγet d’IL-2. Inversement, dans la
RCH, la réponse immune est plutôt de type Th2. Cependant,
le phénotype des lymphocytes isolés de patients atteints de
RCH a un profil atypique avec une production accrue d’IL-5,
mais pas d’IL-4
(2)
.
La réponse immunitaire de type Th1 dans la MC ou de type
Th2 dans la RCH aboutit à l’activation de cellules effectrices
et à la production de cytokines pro-inflammatoires comme
l’IL-1ß, l’IL-6 ou le TNF, cytokines responsables de l’in-
flammation chronique digestive et favorisant le recrutement
de cellules effectrices au site de l’inflammation. Parmi ces
cytokines, le TNF joue un rôle central et de nombreuses
études ont confirmé une augmentation de sa concentration
dans la muqueuse intestinale,les selles, le sérum, les cellules
mononucléées de la
lamina propria
ou du sang périphérique
des patients atteints de MC ou de RCH
(3)
.
L’identification des mécanismes de régulation, de différencia-
tion et d’activation des lymphocytes naïfs en lymphocytes de
type Th1, Th2 ou régulateurs a permis de définir de nouvelles
cibles thérapeutiques. De plus, l’identification des intégrines
à la surface des lymphocytes et de leur ligand permet de
moduler le recrutement des cellules effectrices au site de l’in-
flammation.
Molécules anti-TNFα
De nombreuses stratégies anti-TNF ont été développées ou
sont en cours de développement dans les MICI. Les molé-
cules agissent sur des phases tardives de la production cellu-
laire en utilisant des anticorps monoclonaux (infliximab,
CDP571, CDP870, adalimumab) ou des récepteurs solubles
p75 (étanercept) ou p55 (onercept) qui empêchent l’interac-
tion du TNF mature circulant sur son récepteur. D’autres
molécules ont été développées pour inhiber la production plus
en amont dans la cellule, comme le
R a tional Design
Peptide 58
(RDP58).
L’infliximab est le seul anticorps anti-TNFαdisposant d’une
autorisation de mise sur le marché dans la MC. Il s’agit d’un
anticorps monoclonal chimérique de type IgG1 se fixant spé-
cifiquement sur le TNFαcirculant et transmembranaire. Il
fi xe le complément, e n t r aîne une cy t o t oxicité anticorp s -
dépendante et induit l’apoptose de lymphocytes activés dans
la
lamina propria
. Il est utilisé pour le traitement de la MC fis-
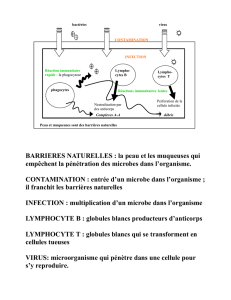
Fi g u r e 1. P hy s i o p at h o l ogie des maladies infl a m m at o i res ch ro n i q u e s
intestinales.
La modification de la flore digestive ou l’existence d’un pathogène
associés à l’augmentation de perméabilité de la barrière épithéliale
digestive permettent le passage d’antigènes bactériens ou non intra-
luminaux dans la lamina propria (1). Les antigènes bactériens inter-
agissent avec les monocy t e s / m a c r o p h ages par l’interm é d i a i re d’un
récepteur de surface (toll like receptor) ou par des sensors intracel-
l u l a i res (NOD2/CARD15) ( 2 ). L’ existence de mu t ations de NOD2/
CARD15 dans la maladie de Crohn induit une diminution de l’acti-
vation du facteur de transcription NF-
κ
B et une diminution de l’im-
munité innée favo risant l’immunité antigène-dépendante acquise. Les
antigènes sont intern a l i s é s , m o d i f iés puis présentés aux ly m p h o cy t e s T.
L’activation et la différenciation des lymphocytes dépendent de l’an-
tigène présenté, des molécules associées à la présentation antigénique
et de l’environnement cytokinique. La production d’IL-12, d’IL-23 et
d’IL-18 oriente la diff é re n c i a tion ve rs un phénotype Th1 dans la mala-
die de Crohn, et la production d’IL-10 vers un phénotype de type Th2
dans la rectocolite hémorragique (3). Un défaut d’activité des lym-
phocytes régulateurs participe à la chronicité de la réponse inflam-
matoire (4) caractérisée par une augmentation de la production de
cytokines pro-inflammatoires (5).
1
2
3
4
5
CPA
IBD1/NOD2
IL-12IL-10
IL-4 IFNγ
TNF
IL-10
TGFß TNF, IL-1ß, IL-6
INFLAMMATION
Treg
Th2 Th1

tulisante ou non, sévère et réfractaire aux traitements usuels
(4, 5)
. Depuis 2003, l’infliximab est également indiqué en
traitement d’entretien par perfusions répétées toutes les huit
semaines ou à la demande en fonction des rechutes sympto-
matiques des patients
(6)
. Il permet d’obtenir une rémission
de la maladie ou une fermeture des fistules dans deux tiers des
cas pour une durée limitée dans le temps. Sa tolérance est
bonne avec, toutefois, une augmentation du risque d’infection
opportuniste, et notamment de tuberculose. L’existence ou la
suspicion d’une tuberculose doivent faire différer le traite-
ment par infliximab après confirmation et traitement éventuel
antituberculeux. Par ailleurs, il existe un risque d’immunisa-
tion anti-infliximab majoré par l’absence de prise concomi-
tante d’immunosuppresseurs classiques. Cette immunisation
est à l’origine d’une diminution progressive de l’efficacité de
l’anticorps, d’un raccourcissement de sa durée d’action,
d’une augmentation de ses effets indésirables et d’une moins
bonne tolérance. Pour ces raisons, de nouveaux anticorps
humanisés ont été déve l o p p é s , comme le CDP571, l e
CDP870 et l’adalimumab.
Le CDP571 est un anticorps monoclonal anti-TNFαhumani-
sé à 95 % permettant de diminuer le risque théorique d’im-
munisation. En revanche, il s’agit d’un anticorps de type IgG4
n’entraînant pas de cytotoxicité anticorps-dépendante,et pro-
bablement pas d’apoptose des lymphocytes activés de type
Th1. L’efficacité du CDP571 a été évaluée dans quatre essais
contrôlés chez des patients atteints de MC légère à modérée,
modérée à sévère et cortico-dépendants. Globalement, le
CDP571 permettait d’obtenir une réponse objective avec une
diminution de l’activité de la maladie,mais sans plus de
rémission que le placebo. Le CDP571 était bien toléré, y
compris chez les patients ayant eu des effets indésirables ou
une réaction d’hypersensibilité retardée à l’infliximab
(7)
.
L’efficacité insuffisante du CDP571 a motivé l’arrêt du déve-
loppement de cette molécule par Celltech (Slough, Grande-
Bretagne) dans les MICI. Le même laboratoire s’est concen-
tré sur un second anticorps anti-TNF :le CDP870, qui cor-
respond à un fragment Fab d’un anticorps monoclonal anti-
TNFαhumanisé lié à une molécule de polyéthylène glycol,
ce qui permet d’augmenter sa biodisponibilité et sa durée de
demi-vie. Un essai contrôlé contre placebo de phase II a mon-
tré une efficacité du CDP870 par voie sous-cutanée pour l’in-
duction d’une réponse et d’une rémission chez des patients
atteints de MC active et ayant une protéine C réactive supé-
rieure à la normale
(8)
. Plusieurs essais de phase III sont
actuellement en cours pour évaluer l’efficacité du CDP870 en
traitement d’induction et d’entretien chez des patients atteints
de MC modérée à sévère.
L’adalimumab est un anticorps monoclonal totalement huma-
nisé éliminant ainsi le risque d’immu n i s ation. Il s’agi t ,
comme l’infliximab, d’une IgG1se fixant sur le TNFαcircu-
lant ou transmembranaire, fixant le complément et capable
d’induire une cytotoxicité anticorps-dépendante. Il induit, par
ailleurs l’apoptose des lymphocytes T CD4+ activés
(9)
. Les
premiers résultats des essais de l’adalimumab dans la MC ont
montré qu’il était bien toléré et efficace chez les patients into-
lérants à l’infliximab ou ayant développé une résistance
secondaire
(10)
.
Le TNFαse fixe sur deux récepteurs transmembranaires p55
et p75. La fraction soluble des protéines, en liant le TNFαcir-
culant, permet de diminuer l’effet du TNFαvia son interac-
tion avec ses récepteurs. L’étanercept est un anticorps liant
deux protéines p75 et l’onercept correspond à la fraction
soluble de p55. Contrairement à la polyarthrite rhumatoïde,
l’étanercept n’était pas plus efficace qu’un placebo dans la
MC active, ni pour induire une rémission clinique des pous-
s é e s , ni pour diminuer l’activité de la maladie
( 1 1 )
.
Cependant, les résultats de cet essai sont difficiles à interpré-
ter en raison de l’effet considérable du placebo. L’onercept a
fait l’objet d’un essai ouvert chez seulement 12 patients
atteints de MC. Dans cette étude,la tolérance était bonne, et
l’onercept induisait une réponse objective avec une diminu-
tion de l’intensité des poussées chez 7 patients
(12)
. Les don-
nées sont insuffisantes pour conclure à un effet de cette molé-
cule dans la MC.
Les strat é gie s anti-TNF dans les essais cliniques ont été essen-
tiellement développées dans la MC, a l o r s que l’infl a m m at i o n
ch ronique entraîne également une production accrue de T N F
dans la muqueuse colique des patients atteints de RCH. En ra i-
son de l’efficacité de l’infl i x i m ab dans la MC, de nombre u x
groupes ont publié les résultats d’essais non contrôlés chez des
p atients atteints de RCH sévères corticorésistantes ou non. Les
r é s u l t ats contra d i c t o i res ne permettent pas de dégager d’indi-
c ation précise de l’infl i x i m ab dans la RCH, d’autant que le
seul essai contrôlé publié n’a pas montré de bénéfice chez les
p atients atteints de RCH corticorésistante
( 1 3 )
.
Ces dern i è res années, p l u s i e u r s équipes ont étudié les
séquences peptidiques des molécules du HLA de classe I
impliquées dans la liaison et dans la présentation des anti-
gènes à des lymphocytes T cytotoxiques. Il a été démontré
que les peptides dérivés de la région conservée et fonction-
nelle située entre les acides aminés 75-84 de la chaîne α1 de
la molécule HLA de classe I possédaient des propriétés
immunomodulatrices. Le peptide RDP58 dérive lui-même de
ces peptides par la substitution d’acides aminés en fonction
d’une stratégie de recherche assistée par ordinateur
(Rational
Design) (14)
. Il ne semble pas être immunogène,et n’est pas
dégradé après administration par voie orale. Les mécanismes
d’action du RDP58 ne sont pas complètement élucidés, mais
peuvent être séparés en deux catégories, d’une part l’inhibi-
tion de synthèse du TNF et, d’autre part, l’augmentation de
l’activité enzymatique de l’hème oxygénase de type 1 (HO-1)
(15)
. Le RDP58 a été évalué chez des patients atteints de
RCH. L’administration orale de 200 et 300 mg de RDP58
La Lettre du Pharmacologue - Volume 18 - n° 4 - octobre-novembre-décembre 2004
119
T
H É R A P E U T I Q U E

était efficace comparativement au placebo pour induire une
rémission clinique et une amélioration des lésions ulcéreuses
coliques constatées en endoscopie
(16)
.
Cytokines anti-inflammatoires : IL-10 et IL-11
L’IL-10 est une cytokine produite majoritairement par les
lymphocytes de type Th2 et les lymphocytes régulateurs.
L’IL-10 inhibe la production d’IFNγpar les lymphocytes de
type Th1 et diminue la production d’IL-12 par les macro-
phages. Les propriétés de l’IL-10 ont conduit à la réalisation
de différents essais thérapeutiques chez l’homme au cours de
la MC
(17, 18)
. Après des premiers résultats encourageants
dans un essai ouvert chez des patients atteints de MC, les
essais contrôlés effectués chez des patients ayant des formes
corticodépendantes ou non, en poussées mineures ou modé-
rées, ou en prévention de récidives postopératoires ont été
décevants et n’ont pas confirmé les résultats initiaux. Une
nouvelle voie d’utilisation de l’IL-10 au cours des MICI a été
explorée chez l’animal par le transfert de lymphocytes trans-
fectés de façon stable par des rétrovirus produisant de l’IL-10.
Les lymphocytes transfectés par le rétrovirus étaient efficaces
en traitement curatif et préventif de colite induite par le trans-
fert de lymphocytes CD45RB
high
chez la souris SCID et
n’étaient détectés que dans le tube digestif et les organes lym-
phoïdes de drainage. La production directement in situ par les
ly m p h o cyt es tra n s fect és perm e t t r ait d’obtenir de fo rt e s
concentrations d’IL-10 et d’induire la différenciation de lym-
phocytes T naïfs en lymphocytes T régulateurs, sans avoir les
effets indésirables systémiques décrits avec les plus hautes
doses d’IL-10 recombinante humaine administrée par voie
générale
(19)
.
L’IL-11 est une cytokine ayant de multiples propriétés dont
des effets anti-inflammatoires et protecteurs muqueux. Elle
inhibe le facteur de transcription NF-κB et induit une dimi-
nution de la production de plusieurs cytokines et chemokines,
dont le TNFαet l’IL-1ß. La tolérance de l’IL-11 recombi-
nante humaine a été évaluée chez des patients atteints de MC
dans deux essais contrôlés
(20)
. L’analyse des objectifs d’ef-
ficacité montrait un taux de rémission plus élevé dans le sous-
groupe de patients ne recevant pas de corticoïdes et traités par
15 mg/kg x 1/sem. (36,7 % versus 16,3 %) comparativement
au placebo. Les résultats d’autres essais sont cependant
nécessaires pour conclure à une efficacité certaine de l’IL-11
dans les MICI, définir sa place dans les stratégies thérapeu-
tiques et évaluer sa tolérance,d’autant qu’il existait une fré-
quence plus élevée de thrombocytose chez les patients ayant
reçu l’IL-11.
Inhibition de la réponse immunitaire de type Th-1 :
neutralisation de l’IL-12 et de l’IL-18
L’IL-12 sécrétée par les cellules présentatrices de l’antigène
activées entraîne une différenciation des lymphocytes CD4+
en phénotype de type Th1. Les données chez l’animal et chez
l’homme ont démontré le rôle essentiel de ce phénotype lym-
phocytaire dans la MC. Les premiers résultats d’une étude
multicentrique évaluant l’efficacité d’un anticorps monoclo-
nal anti IL-12 ont été présentés en 2004
(21)
. Soixante-dix-
neuf patients ont reçu un placebo ou l’anticorps anti-IL-12.
L’anticorps anti-IL-12 à la dose de 3 mg/kg était significati-
vement plus efficace que le placebo pour induire une réponse
clinique (70 % versus 13 %) et une rémission de la poussée
(50 % versus 0 %) à la douzième semaine. Il n’y avait pas de
différence concernant la tolérance entre les groupes, à l’ex-
ception d’une fréquence plus élevée de réaction au point de
perfusion.
L’IL-18 est une cytokine produite par les monocytes/macro-
phages activés. Il a été également démontré qu’elle était pro-
duite en grande quantité dans la muqueuse digestive au cours
de la MC. La stimulation par l’IL-18 des lymphocytes
muqueux spécifiquement au cours de la MC entraîne une aug-
mentation de la production de cytokine Th1 (interféron IFNγ)
et une diminution de la production d’IL-10. Il a été démontré
que la neutralisation de l’IL-18 par une protéine de fusion
était efficace dans un modèle d’inflammation colique chez
l’animal
(22)
. Il n’y a pas de donnée actuellement disponible
chez l’homme.
Inhibition du cycle entéro-lymphatique :
anticorps anti-α4 et α4ß7, antisens anti-ICAM-1
Il existe de façon physiologique une circulation permanente
des lymphocytes entre le compartiment muqueux digestif et
la circulation générale grâce au cycle entéro-lymphatique.
Une fois sensibilisés par les antigènes intraluminaux diges-
tifs, les lymphocytes regagnent la circulation générale via les
ganglions mésentériques et le canal thoracique. Une partie de
ces lymphocytes matures retourne dans la muqueuse intesti-
nale et participe à la réponse immunitaire. L’adressage des
lymphocytes vers la muqueuse nécessite l’interaction entre
des intégrines exprimées par les lymphocytes (α4ß7) avec des
adressines (MadCAM) exprimées par les cellules endothé-
liales de la muqueuse. Les cytokines pro-inflammatoires
sécrétées au cours des MICI augmentent l’expression mem-
branaire des intégrines et favorisent le recrutement au lieu de
l’inflammation d’une quantité importante de cellules effec-
trices de la réponse immunitaire. Les stratégies utilisant des
anticorps monoclonaux dirigés contre ces intégrines (natali-
zumab, MLN-02, alicaforsen) ont pour but d’interrompre le
recrutement des cellules dans la muqueuse digestive.
Le nat a l i z u m ab est un anticorps monoclonal anti-α4. Son
e fficacité dans les MICI a été évaluée chez des pat i e n t s
atteints de MC modérée à sévère dans un essai mu l t i c e n-
t r ique contrôlé contre placebo en traitement de la poussée et
en traitement d’entretien
( 2 3 , 2 4 )
. Les patients re c evaient une
ou deux perfusions de nat a l i z u m ab à deux doses diff é r e n t e s
120
La Lettre du Pharmacologue - Volume 18 - n° 4 - octobre-novembre-décembre 2004
T
H É R A P E U T I Q U E
 6
6
 7
7
1
/
7
100%