La tumeur d`Ewing Ewing`s tumor - RHéOP

Mise au point
La tumeur d’Ewing
Ewing’s tumor
M. Taylor, M. Guillon, V. Champion, M. Marcu, J.B. Arnoux, O. Hartmann *
Service d’oncologie pédiatrique, institut Gustave-Roussy, 39, rue Camille-Desmoulins, 94805 Villejuif, France
Reçu le 4 octobre 2004 ; accepté le 24 mai 2005
Disponible sur internet le 19 juillet 2005
Résumé
La tumeur d’Ewing (TE) est une tumeur osseuse maligne de l’enfant et de l’adulte jeune. Elle siège préférentiellement au niveau des os
plats et s’accompagne le plus souvent d’une importante extension dans les tissus mous. La découverte des anomalies cytogénétiques dont la
plus fréquente est la translocation fusionnant le gène EWS du chromosome 22 avec le gène FLI1 du chromosome 11 a situé la tumeur d’Ewing
dans le cadre plus large des tumeurs neuroectodermiques. Cette translocation est spécifique pour ces tumeurs et elle est actuellement la base
de leur définition. Elle a, de plus, fourni un nouvel outil diagnostique et aussi probablement pronostique s’ajoutant à l’imagerie et à l’examen
histologique. D’importants progrès ont été réalisés à partir des années 1970 dans la prise en charge thérapeutique. L’introduction de la
polychimiothérapie associée au traitement local (chirurgie et radiothérapie) a nettement augmenté la survie. Le traitement systémique systé-
matique a été justifié par la très fréquente dissémination infraclinique des TE apparemment localisées. Les intensifications thérapeutiques ont
permis pour la première fois d’obtenir des guérisons en cas de TE métastasée, mais au prix d’importants effets secondaires. Le traitement est
actuellement adapté grâce à une meilleure définition des facteurs pronostiques, en tenant compte des connaissances des effets secondaires des
thérapeutiques administrées. L’amélioration de la prise en charge globale des patients et des complications spécifiques de la TE, très souvent
intriquées avec les complications iatrogènes, représente une avancée importante pour la qualité de vie et la limitation des complications à long
terme. À la lumière des études actuelles, les adultes guéris ont un état de santé et une qualité de vie considérés comme bons par la très grande
majorité d’entre eux. La tumeur d’Ewing est un exemple fascinant de progrès non seulement dans le domaine du diagnostic et du traitement
mais aussi dans la compréhension des mécanismes de carcinogénèse, témoin de l’évolution de la pensée médicale de la fin du XX
e
et du début
du XXI
e
siècle.
© 2005 Elsevier SAS. Tous droits réservés.
Abstract
Ewing’s tumor (ET) is a malignant bone tumor occurring in children and young adults. ET affects mainly bones of the central axis, and
almost always involves soft tissue infiltration. The discovery of a unique genetic alteration, which is a reciprocal translocation most frequently
resulting in the fusion of the EWS gene situated on chromosome 22 with the FLI-1 gene on chromosome 11, currently places ET among
neuroectodermal tumors. Moreover, this translocation is a tumor-specific genetic marker at the basis of defining ET today and is used as a
diagnostic and potentially prognostic tool complementary to imaging and histopathological work-up. Since the 1970 s, important progress has
been made in the clinical management of ET patients. Multiagent chemotherapy in association with local treatment (surgery and/or radiation)
has clearly improved outcome. The introduction of systemic treatment was justified by the frequent sub-clinical diffusion of apparently
localized ET. Intensified therapeutic strategies have for the first time cured some metastatic ET patients, but at the cost of major side effects.
Treatment is currently adapted as a result of a better definition of prognostic factors as well as a better assessment of its adverse effects.
Improvement in global patient care and increased management of specific acute complications associated with ET (often interwoven with
iatrogeneous effects) represent an important step towards improving the quality of life for ET patients as well as preventing long term com-
plications. In the light of present studies, the majority of surviving adults today describe their health and quality of life as good. ET is a
fascinating example of the progress made not only in the diagnostic and therapeutic approach to cancer but also in the comprehension of the
mechanisms behind carcinogenesis, and consequently reflects the revolution of medicine over the last century.
© 2005 Elsevier SAS. Tous droits réservés.
* Auteur correspondant.
Adresse e-mail : [email protected] (O. Hartmann).
Archives de pédiatrie 12 (2005) 1383–1391
http://france.elsevier.com/direct/ARCPED/
0929-693X/$ - see front matter © 2005 Elsevier SAS. Tous droits réservés.
doi:10.1016/j.arcped.2005.05.014

Mots clés : Tumeur d’Ewing
Keywords: Bone neoplasms; Sarcoma, Ewing’s; Child
1. Introduction et épidémiologie
La tumeur d’Ewing (TE) est une tumeur essentiellement
osseuse correspondant à la forme indifférenciée des tumeurs
neurectodermiques primitives périphériques. Avant l’âge de
20 ans, c’est la seconde tumeur osseuse maligne la plus fré-
quente (30 % des cas) derrière l’ostéosarcome (60 % des cas)
[1]. Son incidence est de deux à trois nouveaux cas par an et
par million d’enfants de moins de 15 ans en France avec un
pic entre 10 et 20 ans (Fig. 1)[2]. Il est étonnant de constater
que la TE est six fois plus fréquente chez les enfants de race
blanche par rapport à ceux de race noire. Aucun facteur de
risque n’a été identifié [3].
2. Histologie et biologie de la tumeur
Décrite pour la première fois par James Ewing en
1921 sous le nom d’endothéliome diffus de l’os, cette entité
tumorale a suscité de nombreuses discussions quant à sa noso-
logie. Le groupe des sarcomes osseux semblant dériver du
« système réticuloendothélial » a été appelé sarcome d’Ewing.
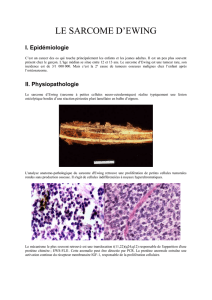
Sur le plan histologique, la prolifération est constituée de nap-
pes de cellules identiques entre elles, au cytoplasme peu abon-
dant renfermant souvent du glycogène, et à chromatine et
membrane nucléaire fines. Ces plages denses et compactes
de petites cellules rondes sont souvent remaniées par de la
nécrose ou de l’hémorragie réalisant des images dites en pseu-
dorosettes. La tumeur appartient à la catégorie des tumeurs
de l’enfant à petites cellules rondes bleutées, qui regroupe les
métastases de neuroblastome, les rhabdomyosarcomes, les
lymphomes et leucoses, les tumeurs neuroectodermiques pri-
mitives périphériques (pPNET). Le sarcome d’Ewing a long-
temps été un diagnostic d’élimination du fait de l’absence de
marqueurs morphologiques distinctifs des autres tumeurs de
l’enfant à petites cellules rondes.
En 1983, Aurias et al. décrivent la présence d’une translo-
cation chromosomique équilibrée retrouvée dans 83 % des
sarcomes d’Ewing. La translocation t(11;22)(q24;q12) devient
un marqueur cytogénétique spécifique de cette entité tumo-
rale [4]. L’année suivante, elle est identifiée dans les cellules
de pPNET [5]. Le séquençage moléculaire de l’ADN révèle
que la translocation entraîne de façon constante la fusion du
gène EWS porté par le chromosome 22 avec l’homologue
humain du gène FLI1 de la souris, porté sur le chromosome
11 [6]. Il faut attendre 1994 pour que soit mis en évidence par
RT-PCR (Reverse transcriptase polymerase chain reaction)
le transcrit de fusion issu de l’expression du gène chimère
EWS–FLI1. Retrouvé dans plus de 95 % des cellules d’Ewing
et de pPNET, l’ARNm d’EWS-FLI1 devient un marqueur
génétique très spécifique. La translocation t(11;22)(q24;q12)
est la plus fréquente, aboutissant au gène de fusion EWS–
FLI1 (90 %). Il existe deux variants de fusion chimérique
principaux, correspondant aux différents points de cassure :
la forme commune (60 %), dite de type 1, et le type 2, cor-
respondant à 25 % des cas.
L’oncogénicité probable de la protéine chimérique peut
être expliquée par la vocation des deux gènes impliqués dans
la translocation. Le gène EWS en 22q12 est un gène d’expres-
sion ubiquitaire, codant pour un cofacteur de la transactiva-
tion (« allumage » de gènes cibles par activité transcription-
nelle). Le gène FLI1 en 11q24, lui, code pour un facteur de
transcription dont l’expression est essentiellement, et norma-
lement, limitée aux stades précoces de l’hématopoïèse, de
l’angiogenèse et du développement neuroectodermique.Ainsi,
l’oncogénicité du transcrit chimérique peut être imputable à
l’expression ubiquitaire de FLI1 sous l’effet du promoteur
d’EWS, notamment dans des tissus inappropriés, lors d’éta-
pes de la différenciation accidentellement intéressées, et exer-
çant son action de facteur de transcription sur des gènes cibles
inhabituels.
Fig. 1
.
Histogramme de l’âge au diagnostic de la tumeur d’Ewing : d’après [2].
1384 M. Taylor et al. / Archives de pédiatrie 12 (2005) 1383–1391

Parallèlement, à la fin des années 1980, d’autres auteurs
mettent en évidence, au sein des cellules tumorales d’Ewing,
des antigènes de différenciation neuronale et dérivant du neu-
roectoderme [7].
En 1990, Kovar et al.découvrent une liaison génétique
supplémentaire partagée par la TE et le pPNET : ces deux
entités néoplasiques surexpriment de façon constante le gène
MIC2 codant pour la protéine transmembranaire CD99 [8].
La TE n’est donc que la forme indifférenciée des tumeurs
neuroectodermiques, dont le neuroépithéliome représente la
forme différenciée. La famille des tumeurs d’Ewing devient
alors une famille de tumeurs neuroectodermiques regroupant
l’ancien « sarcome » d’Ewing, le pPNET, la tumeur d’Askin,
et les quelques TE à localisations « extraosseuses ». Elle est
caractérisée par la présence d’un transcrit de fusion issu de
l’expression génique de la t(11;22)(q24;q12).
3. Diagnostic
3.1. Clinique
Tous les os de l’organisme peuvent être atteints mais le
squelette du membre inférieur, y compris l’os iliaque, paie le
plus lourd tribut, représentant environ 60 % des atteintes. Cer-
tains os plats (côtes, bassin) et le rachis sont également fré-
quemment touchés [2]. La TE est révélée dans 95 % des cas
par une douleur permanente ou intermittente, nocturne dans
moins d’un quart des cas, localisée à la zone tumorale ou
projetée. Le caractère non spécifique de la douleur conduit,
dans 20 % des cas, à la rattacher à un traumatisme antérieur.
La douleur, souvent améliorée par le repos au début, est trom-
peuse et peut exister depuis plusieurs semaines ou mois.
Ainsi, il faut rappeler que les douleurs rachidiennes de
l’enfant et les douleurs post-traumatiques persistantes doi-
vent être impérativement explorées. L’examen clinique peut
retrouver une tuméfaction inflammatoire au niveau de la
tumeur, témoin de l’importance de l’atteinte des parties mol-
les, en particulier au niveau des os plats. Elle n’est pas cons-
tante ni spécifique des tumeurs malignes. Les signes géné-
raux tels l’altération de l’état général et la fièvre sont rares,
évoquent volontiers la présence de métastases, mais joints
aux signes locaux peuvent simuler une lésion osseuse infec-
tieuse ou inflammatoire. Une des particularités de la TE est
sa capacité à s’étendre aux parties molles, infiltrant souvent
de façon importante muscles, tendons et gaines nerveuses, et
ce, de façon cliniquement silencieuse. C’est pourquoi cer-
tains modes de révélation peuvent être spécifiques à la loca-
lisation de la tumeur : syndrome de compression médullaire
ou radiculaire des tumeurs rachidiennes, troubles respiratoi-
res et épanchement pleural des tumeurs costales, troubles
moteurs et sphinctériens des tumeurs pelviennes.
3.2. Imagerie
L’imagerie est essentielle. Non seulement elle est impor-
tante pour le diagnostic et le bilan d’extension, mais elle per-
met aussi l’évaluation de l’efficacité du traitement et la détec-
tion de récidives. Les fractures sur os fragilisé ne sont pas des
modes de révélation exceptionnels, et imposent un examen
soigneux de la trame osseuse pour ne pas immobiliser une
lésion tumorale qui deviendrait évidente par la suite. Il est
possible d’évaluer l’agressivité d’une lésion osseuse sur des
clichés standards. Les critères habituels incluent la taille
(> 6 cm), la matrice tumorale plus ou moins calcifiée ou ossi-
fiée, et les réactions périostées, volontiers interrompues,
lamellaires ou spiculaires dans les lésions malignes, qui
contrastent avec les réactions épaisses et longitudinales des
lésions à évolution lente. Ainsi, en premier lieu, il sera pri-
mordial d’écarter parmi les diagnostics différentiels, les
tumeurs bénignes qui ne doivent pas être nécessairement tou-
tes biopsiées : chondrome, dysplasie fibreuse et kyste osseux
simple en sont quelques exemples.
En radiologie standard, la TE apparaît comme une plage
d’ostéolyse étendue, aux limites imprécises. La corticale est
détruite ou soufflée, la réaction périostée est spiculaire ou
lamellaire. Lorsque la TE atteint les os longs, son point de
départ est volontiers diaphysaire, à la différence de l’ostéo-
sarcome qui siège essentiellement au niveau de la méta-
physe.
L’atteinte des parties molles peut prédominer de sorte que
la radiographie standard peut apparaître normale au niveau
osseux (Fig. 2)[9]. Si un processus malin est suspecté, le
bilan d’imagerie doit être approfondi. La scintigraphie osseuse
permet de mettre en évidence une lésion fixante dans une
région précise. Pour analyser au mieux cette lésion osseuse
Fig. 2
.
Imagerie de tumeur d’Ewing du tibia gauche : d’après [9].
a) Radiographie standard de la jambe gauche de face : épaississement corti-
cal de la face latérale du tibia avec réaction périostée, associée à une image
hyperdense dans les parties molles.
b) Imagerie par résonance magnétique de la jambe gauche (T1 après injec-
tion de gadolinium) : hypersignal diffus de la cavité médullaire du tibia, et
présence d’une tumeur des parties molles en hypersignal avec zones nécro-
tiques.
1385M. Taylor et al. / Archives de pédiatrie 12 (2005) 1383–1391

et ses rapports avec les parties molles adjacentes, un scanner
permettra une meilleure analyse des os plats et des os courts
difficiles à apprécier sur les clichés standards, tandis que
l’imagerie par résonance magnétique (IRM) sera plus sensi-
ble pour étudier l’extension locorégionale [10].
3.3. Bilan d’extension
Un enfant atteint d’une TE doit être adressé dans un ser-
vice d’oncologie pédiatrique spécialisé car le bilan d’exten-
sion, qui guidera le choix thérapeutique, devra chaque fois
que possible être réalisé avant toute biopsie osseuse.
3.3.1. Bilan d’extension locale
La stratégie thérapeutique locale dépend de cette évalua-
tion locorégionale. L’IRM est l’examen de choix pour ana-
lyser l’extension locale d’une tumeur osseuse. La tumeur se
caractérise par un hyposignal en T1, hypersignal en T2 et une
prise de contraste lors de l’injection de gadolinium. Le signal
des espaces médullaires normaux (graisseux) diffère de celui
de la tumeur si bien qu’il est possible d’apprécier l’étendue
de la tumeur, de détecter d’éventuelles « skip métastases »
(petites métastases osseuses séparées du primitif par du tissu
osseux sain) et d’évaluer une possible extension à l’articula-
tion adjacente. La planification de l’intervention chirurgicale
définira le niveau de résection osseuse selon l’étendue de la
maladie et l’existence ou non d’une atteinte articulaire.
3.3.2. Bilan d’extension à distance
Dans un quart des cas, il existe des métastases au moment
du diagnostic. Ainsi seront réalisés une radiographie de tho-
rax standard et un scanner thoracique afin de rechercher des
métastases pulmonaires (50 % des localisations métastati-
ques). Une scintigraphie osseuse au technétium révèlera des
localisations osseuses autres que la tumeur primitive dans
25 % des cas métastatiques. La recherche d’une atteinte
médullaire, par myélogrammes multiples et biopsie ostéomé-
dullaire, s’impose chez tous les patients et est positive dans
20 % des cas au diagnostic.
3.3.3. Diagnostic histologique
Le diagnostic de la TE est histologique, de préférence sur
une biopsie osseuse chirurgicale réalisée dans un centre de
référence disposant des laboratoires capables de réaliser les
examens nécessaires de cytogénétique et de biologie molé-
culaire sur la tumeur. Le prélèvement devra comporter du
matériel frais stérile et congelé pour analyses immédiates
cytogénétiques (caryotype) et différées (transcrit de fusion).
Chaque fois que c’est possible, la biopsie sera impérative-
ment réalisée après l’IRM afin de ne pas créer d’artéfact par
le biais d’un hématome ou d’un œdème.
Il est préférable que la biopsie osseuse chirurgicale soit
réalisée par un chirurgien expérimenté qui prendra en charge
le patient par la suite car la chirurgie d’exérèse de la tumeur
inclut le trajet biopsique et doit retirer la cicatrice [11]. L’ense-
mencement du champ opératoire par des cellules tumorales
lors d’une biopsie mal faite peut compromettre voire rendre
impossible la réalisation d’un traitement conservateur ulté-
rieur.
L’histopathologie est indispensable pour préciser le dia-
gnostic avant tout traitement. Elle est aussi primordiale pour
évaluer l’efficacité et la qualité du traitement. Ainsi, la qua-
lité de l’exérèse chirurgicale est analysée sur la pièce de résec-
tion. L’efficacité de la chimiothérapie préopératoire sera
appréciée sur une tranche de section complète du prélève-
ment, lui-même comparé à la biopsie initiale. Le pourcen-
tage moyen de cellules résiduelles a une importance pronos-
tique influençant la stratégie postopératoire.
3.3.4. Diagnostics différentiels
Les principaux diagnostics différentiels sont dominés par
l’ostéomyélite et l’ostéosarcome, qui diffèrent par des signes
cliniques et radiologiques souvent trompeurs (Tableau 1).
4. Prise en charge thérapeutique
4.1. Complications initiales et leur traitement
Par sa nature très invasive et sa localisation préférentielle
aux os plats, la TE est souvent grevée de complications ini-
tiales graves qui entravent la mise en route du traitement. Il
est essentiel de prendre en compte, dès le début du traite-
ment, la douleur, les complications neurologiques potentiel-
les et la compression ou l’envahissement des organes adja-
cents à la tumeur.
4.1.1. La douleur
Pour évaluer l’intensité de la douleur chez l’enfant, plu-
sieurs moyens sont à la disposition du clinicien mais doivent
Tableau 1
Diagnostics différentiels
Diagnotics différentiels Clinique et biologie Imagerie
Fréquents Ostéomyélite Nourrisson et petit enfant, fièvre,
syndrome inflammatoire, hyperleu-
cocytose, hémocultures positives.
Atteinte métaphysaire avec franchissement du cartilage de conjugaison.
Ostéosarcome Enfant de plus de dix ans. Atteinte métaphysaire des os longs, plage d’ostéogenèse, mais avec un
rapport d’envahissement des parties molles/osseuse moins important.
Rares Hystiocytose langheran-
sienne
Enfant jeune (1–4 ans), présence de
l’antigène CD1a sur biopsie.
Lacune osseuse à contours réguliers, parfois similaire à la tumeur
d’Ewing.
Tumeurs bénignes Hypodensités de taille < 6 cm, pas de rupture corticale, pas d’envahisse-
ment des parties molles. Réaction périostée longitudinale.
1386 M. Taylor et al. / Archives de pédiatrie 12 (2005) 1383–1391

être adaptés à son âge. L’interprétation des méthodes d’autoé-
valuation recommandées par l’Anaes à partir de six ans doit
être prudente et tenir compte à la fois des antécédents de
l’enfant et de son niveau de compréhension. La tâche est
malaisée en raison de l’intrication des douleurs neuropathi-
ques et nociceptives. La douleur neuropathique est une dou-
leur perçue en dehors de toute stimulation ou après une sti-
mulation douce (allodynie). Elle est continue ou paroxystique
et peut être associée à une hyper- ou une hyposensibilité. Ces
douleurs sont habituellement traitées par de faibles doses
d’amitriptyline, de clonazépam ou encore la gabapentine. La
prise en charge de la douleur nociceptive repose sur l’utilisa-
tion des antalgiques des trois paliers de l’OMS. Il est souvent
préférable de mettre en route un traitement à faible dose, en
l’augmentant rapidement en fonction des besoins, plutôt que
d’instaurer un traitement lourd qui sera refusé en raison de
ses effets secondaires. Il faut rechercher et prévenir les effets
secondaires des morphiniques par une antagonisation de ses
effets périphériques, par exemple par la naloxone ou la nal-
buphine à petites doses, et éviter la somnolence [12].Une chi-
miothérapie efficace est un outil très puissant pour soulager
les douleurs liées à la maladie. Cependant le traitement spé-
cifique est lui-même responsable de douleurs. Les mucites et
les oesophagites, les douleurs abdominales et la diarrhée, les
atteintes anales et du siège sont des complications douloureu-
ses fréquentes de la chimiothérapie. Se surajoutent dépres-
sion et anxiété qui devront être recherchées systématique-
ment et traitées [12]. Dans tous les cas le traitement
médicamenteux de la douleur doit être associé à une prise en
charge psychologique.
4.1.2. Prise en charge et prévention des complications
liées à l’effet de masse tumoral
La localisation thoracique peut exposer à un risque vital
immédiat. Les tumeurs des côtes et de la plèvre se dévelop-
pent rapidement dans la cage thoracique comprimant l’appa-
reil respiratoire et circulatoire. Les pPNET du rachis peuvent
atteindre tous les niveaux et être responsables de tableaux
neurologiques variés. Face à une compression médullaire ou
un syndrome de la queue de cheval, la prise en charge neuro-
chirurgicale parait s’imposer. Mais la laminectomie, ou la
laminotomie qui expose à moins de complications, ne doi-
vent être réservées qu’aux cas de grande urgence neurologi-
que [13,14]. En effet, d’une part, l’abord chirurgical incom-
plet à proximité d’une tumeur maligne représente un risque
de dissémination, d’autre part, le bénéfice de l’abord chirur-
gical d’une compression tumorale est incertain. La chimio-
thérapie, débutée rapidement, est le traitement qui semble
actuellement le plus efficace sur les complications neurolo-
giques. Ces tableaux neurologiques peuvent être compliqués
par des troubles hémodynamiques nécessitant une prise en
charge en réanimation, des thromboses veineuses, des dou-
leurs, une vessie neurologique, des troubles de motricité intes-
tinale et des escarres, interférant avec le bon déroulement du
traitement du cancer. Ainsi, par exemple, la chimiothérapie
est particulièrement délicate à administrer en cas de troubles
urinaires : atteinte sphinctérienne neurologique ou compres-
sion directe de l’arbre urinaire peuvent compliquer sa mise
en route car les produits utilisés, en particulier le cyclophos-
phamide et ses analogues, ont une toxicité vésicale impor-
tante responsable de cystites hématuriques sévères. En cas
d’atteinte sphinctérienne, sonde à demeure ou sondages plu-
riquotidiens sont souvent nécessaires. Une compression
extrinsèque ou l’envahissement des voies urinaires par la
tumeur exposent de plus à l’insuffisance rénale, à la mau-
vaise élimination de médicaments et donc à une toxicité exces-
sive. Le recours, avant le début de la chimiothérapie, à la pose
de sonde double J ou plus rarement à la néphrostomie percu-
tanée, peut s’imposer mais ces manœuvres de vidange vési-
cale et de dérivation des urines exposent à un haut risque infec-
tieux pendant les périodes d’aplasie [15].
4.2. Principes du traitement
4.2.1. Facteurs pronostiques
Les stratégies thérapeutiques actuelles de la TE reposent
en premier lieu sur la répartition des patients dans des grou-
pes de pronostic homogène afin de leur proposer un traite-
ment d’intensité adaptée [16]. L’existence de métastases au
diagnostic est le facteur pronostique principal. Une tumeur
primitive de volume important expose à une évolution défa-
vorable. Cependant, de plus en plus d’études tendent à mon-
trer que, pour les tumeurs non métastatiques dont l’exérèse
est possible, c’est la réponse à la chimiothérapie initiale qui
est étroitement corrélée à la survie des patients [17].
4.2.2. Stratégies thérapeutiques
4.2.2.1. Historique. La radiosensibilité de la TE est connue
depuis les années 1940 [18]. Cependant, et parfois en dépit
d’une réponse locale complète, l’apparition quasi-
systématique d’une récidive menait le patient au décès en deux
à trois ans. Dans les années 1960, fut soulevée l’hypothèse
que, dans bien des cas de TE apparemment localisées, une
dissémination infraclinique de cellules tumorales existait déjà
[19]. Vint donc s’ajouter au traitement local, un traitement
général par une chimiothérapie adjuvante (postopératoire),
elle-même complétée au début des années 1980 d’une chi-
miothérapie néoadjuvante (préopératoire) afin d’enrayer plus
précocement la dissémination métastatique et de rendre le
traitement local plus efficace en réduisant préalablement la
taille de la tumeur [20].
4.2.2.2. Chimiothérapie néoadjuvante. Toutes les décisions
autour de la stratégie thérapeutique ne peuvent être prises que
dans le cadre d’une concertation multidisciplinaire en centre
spécialisé. La chimiothérapie d’induction, ou néoadjuvante,
est donnée dès le bilan diagnostique et d’extension réalisé.
Les protocoles actuels reposent sur des associations de deux
à six médicaments anticancéreux parmi la doxorubicine,
l’actinomycine D, le cyclophosphamide, l’ifosfamide, la vin-
cristine, l’étoposide, le busulfan, le melphalan et le carbopla-
1387M. Taylor et al. / Archives de pédiatrie 12 (2005) 1383–1391
 6
6
 7
7
 8
8
 9
9
1
/
9
100%