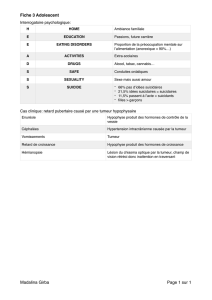
le sarcome d`ewing

LE SARCOME D’EWING
I. Epidémiologie
C’est un cancer des os qui touche principalement les enfants et les jeunes adultes. Il est un peu plus souvent
présent chez le garçon. L’âge médian se situe entre 12 et 13 ans. Le sarcome d’Ewing est une tumeur rare, son
incidence est de 3/1 000 000. Mais c’est la 2e cause de tumeurs osseuses malignes chez l’enfant après
l’ostéosarcome.
II. Physiopathologie
Le sarcome d’Ewing (sarcome à petites cellules neuro-ectodermiques) réalise typiquement une lésion
ostéolytique bordée d’une réaction périostée pluri lamellaire en bulbe d’oignon.
L'analyse anatomo-pathologique du sarcome d'Ewing retrouve une prolifération de petites cellules tumorales
rondes sans production osseuse. Il s'agit de cellules indifférenciées à noyaux hyperchromatiques.
Le mécanisme le plus souvent retrouvé est une translocation t(11,22)(q24;q12) responsable de l'apparition d'une
protéine chimère ; EWS-FLI1. Cette anomalie peut être détectée par PCR. La protéine anormale entraîne une
activation continue du récepteur membranaire IGF-1, responsable de la prolifération cellulaire.

III. Clinique
Les symptômes
Le principal symptôme des tumeurs osseuses est la douleur, d’intensité variable, permanente ou
transitoire, elle est le plus souvent localisée à la zone tumorale mais peut aussi être projetée. Chez
l’enfant elle n’est pas toujours exprimée et si la lésion siège dans le membre inférieur, elle peut se
traduire par une boiterie. Le caractère capricieux des douleurs explique un retard fréquent de plusieurs
mois au diagnostic.
Une tuméfaction d’aspect inflammatoire peut apparaître secondairement.
Dans 15-20% des cas on retrouve des signes généraux : fièvre, asthénie, amaigrissement. Ils sont
souvent associés à une maladie métastatique ou à une localisation pelvienne.
Des signes respiratoires sont révélateurs de métastases pulmonaires.
Des douleurs radiculaires ou une compression médullaire sont révélatrices d’une tumeur vertébrale.
Les atteintes des parties molles sont souvent volumineuses en particulier si elles touchent les os plats et
sont donc palpables.
IV. Diagnostic
Le bilan pré thérapeutique comprend une imagerie de la tumeur et une étude de l’extension.
Tumeur primitive
La radiographie standard : aspect caractéristique en « bulbe d’oignon », un épaississement cortical
concentrique multi lamellaire au niveau de la diaphyse d’un os long. La tumeur des parties molles est
souvent très volumineuse en particulier au niveau des os plats et il faut donc rechercher ne lésion
osseuse de voisinage pour orienter le diagnostic.
L’examen en IRM est essentiel pour évaluer l’extension de la tumeur dans les parties molles et le bilan
d’opérabilité. Dans les localisations axiales, elle précise l’extension intrarachidienne d’une tumeur
vertébrale et recherche une éventuelle épidurite. En cas de tumeur d’un membre, des radiomensurations
comparatives permettent de préparer la reconstruction chirurgicale ultérieure.

Tableau 1 - Répartition des sarcomes d'Ewing
Siège de la tumeur primitive
Fréquence
Ceinture pelvienne
22
Côtes
18
Vertèbre
10
Fémur
10
Tibia
10
Péroné
10
Humérus
8,5
Autres
11,5
Source : étude SFOP EW 88 "Memphis" sur 142 patients porteurs de tumeur localisée.
Bilan d’extension
La radiographie de thorax et le scanner thoracique recherchent l’existence de métastases
pulmonaires, plus rarement de métastases ganglionnaires médiastinales .Un épanchement pleural
tumoral ou réactionnaire peut exister en cas de tumeur costale, on réalisera alors un examen
cytologique du liquide pleural pour différentier un épanchement réactionnel ou tumoral.
La scintigraphie au MDP marqué au 99Technétium, non spécifique, est cependant évocatrice de
métastase lorsqu’elle dépiste une hyperfixation squelettique à distance.
Plusieurs myélogrammes et biopsies médullaires recherchent un envahissement médullaire en
présence d’une tumeur axiale, de signes généraux ou de patients métastatiques.
Biopsies et caractérisation biologique
Seule la biopsie permet d’affirmer le diagnostic. C’est une biopsie chirurgicale effectuée par un
orthopédiste et dont la voie d’abord est décidée en fonction du geste chirurgical ultérieur.
Un fragment de tumeur est mis dans un milieu de culture pour l’étude cytogénétique et immuno-
histo-chimique.
Un fragment est également congelé pour la recherche du transcrit de fusion en biologie moléculaire. La
mise en évidence de la translocation t(11 ;22)(q24 ;q12)) permet d’affirmer le diagnostic même s’il
existe des translocations variantes et complexes.

V. Complications
- Les métastases sont présentes dans 25% des cas : elles peuvent être pulmonaires (38%), osseuses (31%)
ou médullaires (11%).
- Récidives
- Envahissement médullaire
- Complications post chirurgicales : amputation, troubles mécaniques liés à l’atteinte d’une articulation
(handicap fonctionnel)…
- Complications liées à la chimiothérapie
VI. Traitement
La chirurgie, la radiothérapie et la chimiothérapie sont souvent associées.
Pré-op :
Une chimiothérapie néo adjuvante est réalisée permettant de diminuer la taille de la tumeur. Selon la réponse à la
chimio, on peut évaluer le pronostic.
Chirurgie :
- Exérèse chirurgicale large et monobloc si possible conservatrice
- Reconstruction par prothèse synthétique, greffe osseuse ou plastie de paroi thoracique
Post-op :
Le traitement post-opératoire fait appel à la :
- Chimiothérapie pour la prophylaxie des métastases et la prévention des récidives
- Et parfois à une radiothérapie complémentaire
La radiothérapie est aussi indiquée dans les formes inopérables mais le plus souvent en complément de la
chirurgie pour assurer le contrôle locorégional.
VII. Evolution / Pronostic
Le pronostic est encore sévère, émaillé de rechutes (métastases, envahissement médullaire). Dans les formes
métastatiques, lors du diagnostic, le taux de survie est faible et une chimiothérapie à forte dose associée à une ré
infusion de cellules souches hématopoïétiques autologues préalablement prélevées, permettrait d’améliorer le
pronostic.
1
/
4
100%